Классификация химических реакций (11 класс)
Содержание
- 2. это процессы, в результате которых из одних веществ образуются другие, отличающиеся
- 3. По числу и составу реагирующих и образующихся веществ По изменению степени
- 4. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие
- 5. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие
- 6. Горение серы в кислороде:
- 7. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие
- 8. Получение кислорода из перманганата калия:
- 9. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие
- 10. Взаимодействие натрия с водой:
- 11. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие
- 12. Получение аммиака из нашатыря
- 13. II. По изменению степеней окисления химических элементов: 1. Окислительно-восстановительные реакции –
- 14. Взаимодействие железа с медным купоросом:
- 15. III. По использованию катализатора: 1. Некаталитические реакции – реакции, идущие без
- 16. III. По использованию катализатора: 1. Каталитические реакции – реакции, идущие с
- 17. Разложение пероксида водорода:
- 18. IV. По направлению: 1. Необратимые реакции протекают в данных условиях только
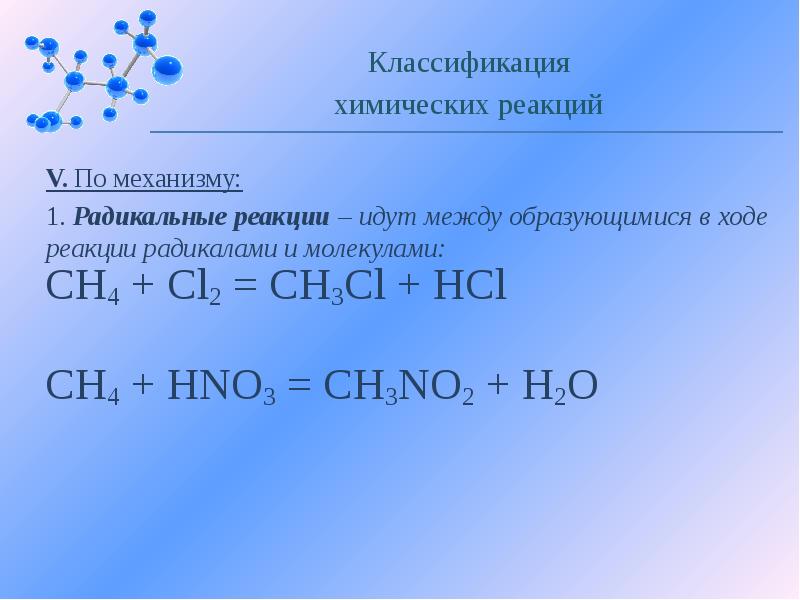
- 19. V. По механизму: 1. Радикальные реакции – идут между образующимися в
- 20. V. По механизму: 2. Ионные реакции – идут между уже имеющимися
- 21. VI. По тепловому эффекту: 1. Экзотермические реакции протекают с выделением энергии:
- 22. Горение фосфора в кислороде:
- 23. VI. По тепловому эффекту: 2. Эндотермические реакции протекают с поглощением энергии:
- 24. Разложение оксида ртути:
- 25. VII. По виду энергии, инициирующей реакцию: Фотохимические реакции инициируются световой энергией.
- 26. VIII. По фазовому составу: 1. Гетерогенные реакции – реакции, в которых
- 27. Восстановление оксида меди (II) водородом:
- 28. VIII. По фазовому составу: 2. Гомогенные реакции – реакции, в которых
- 29. Скачать презентацию



























Слайды и текст этой презентации
Презентация на тему Классификация химических реакций (11 класс) доступна для скачивания ниже:
Похожие презентации





























