Физико-химические методы анализа презентация
Содержание
- 2. План План Классификация физических и физико-химических методов анализа. Достоинства и недостатки
- 3. Классификация физических и физико-химических методов анализа: Оптические методы. Хроматографические методы. Электрохимические
- 4. Достоинства физических и физико-химических методов анализа: Низкий предел обнаружения (1-10-9
- 5. Недостатки физических и физико-химических методов анализа: Иногда воспроизводимость результатов хуже. Погрешности
- 6. Классификация оптических методов анализа: По изучаемым объектам: атомный и молекулярный спектральный
- 7. По области электромагнитного спектра. По области электромагнитного спектра. Спектроскопия
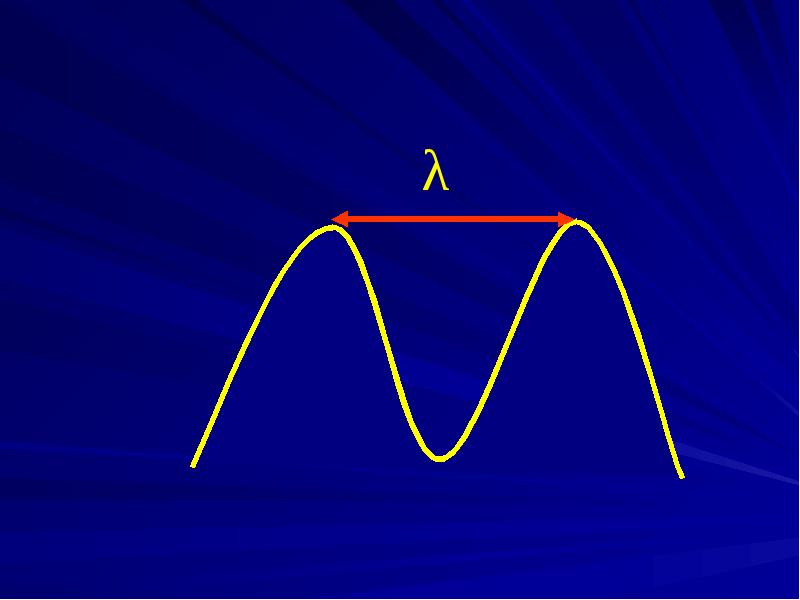
- 8. Общие положения Длина волны - расстояние, проходимое волной за время
- 12. Оптическая плотность
- 17. Если концентрация раствора выражена в процентах, то k представляет собой удельный
- 18. Связь между молярным и удельным коэффициентами поглощения выражается уравнениями: Связь
- 19. К физико-химическим причинам относятся: 1. Несоответствие подставляемого в уравнение значения
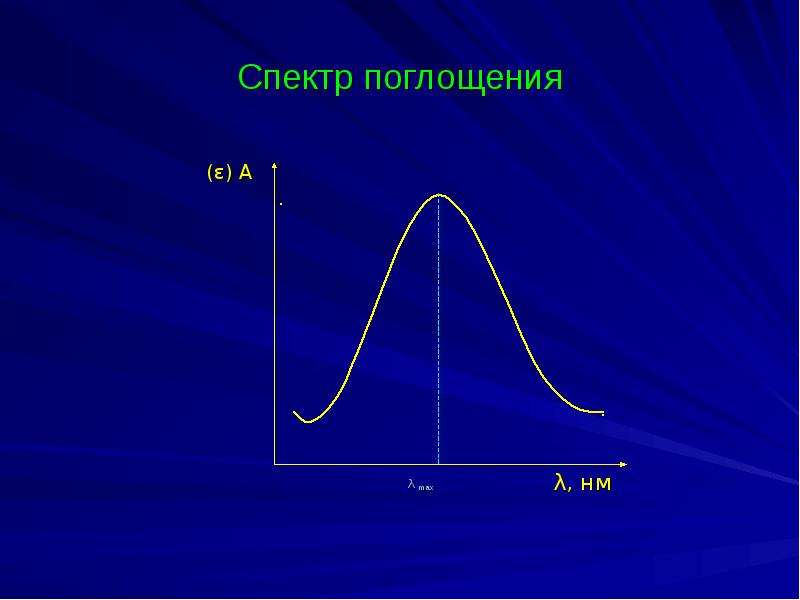
- 20. Спектр поглощения (ε) А
- 21. Выбор длины волны Величина молярного коэффициента поглощения должна быть большой.
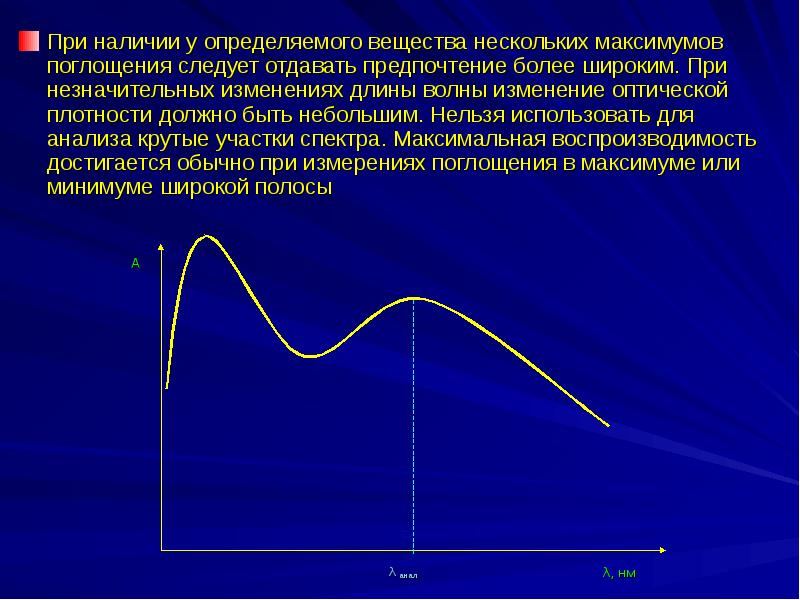
- 22. При наличии у определяемого вещества нескольких максимумов поглощения следует отдавать предпочтение
- 23. Некоторые вещества изменяют свои свойства при изменении рН среды, окислительно-восстановительного потенциала,
- 24. Если в исследуемом растворе присутствуют примеси, выбор длины волны проводят так,
- 25. Проверка подчинения поглощения исследуемыми растворами закону Бугера-Ламберта-Бера
- 26. Параллельно с исследуемым в тех же условиях готовят стандартный раствор (раствор
- 27. 2. Определение по удельному или молярному показателю поглощения Требует обязательного
- 28. 3. По калибровочной кривой Для построения калибровочного графика готовят серию стандартных
- 29. 4. Метод добавок
- 30. 5. Дифференциальный метод
- 31. Графический способ Для построения градуировочного графика готовят серию стандартных растворов с
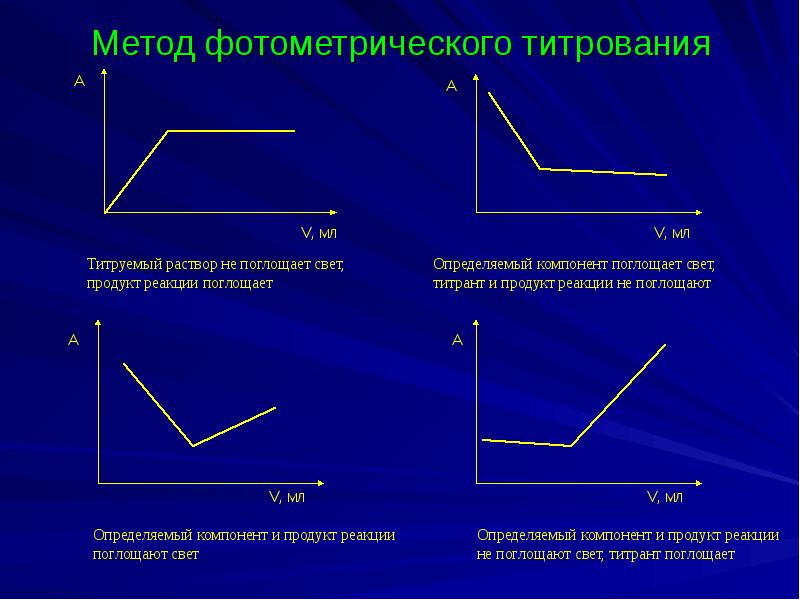
- 32. Метод фотометрического титрования
- 33. Анализ многокомпонентных систем В 1873 г. К. Фирордтом на примере
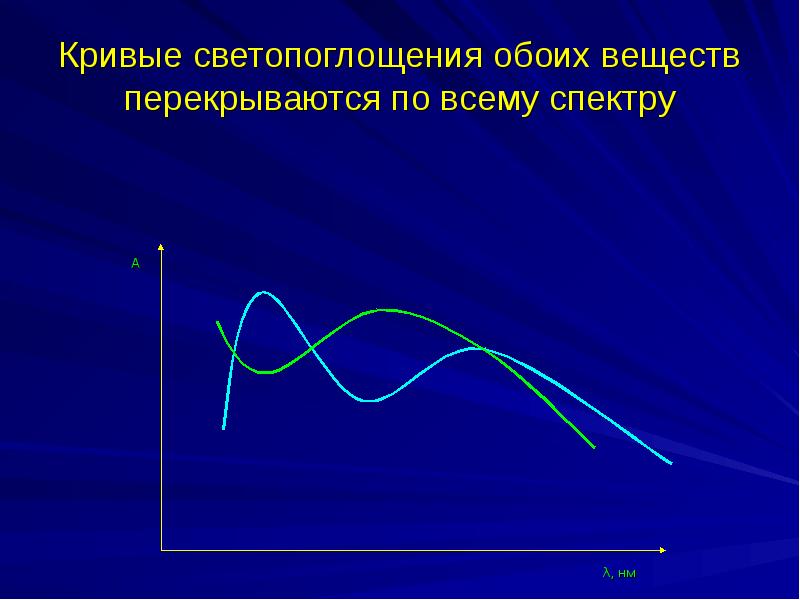
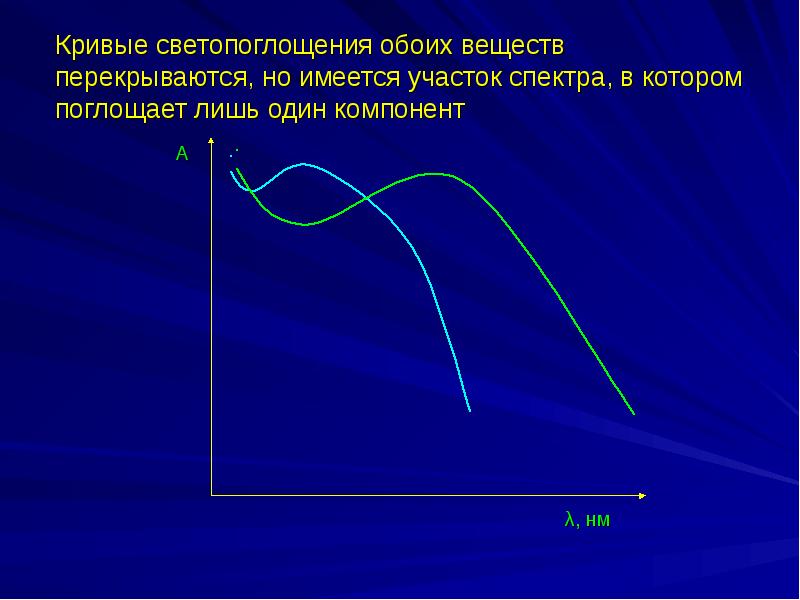
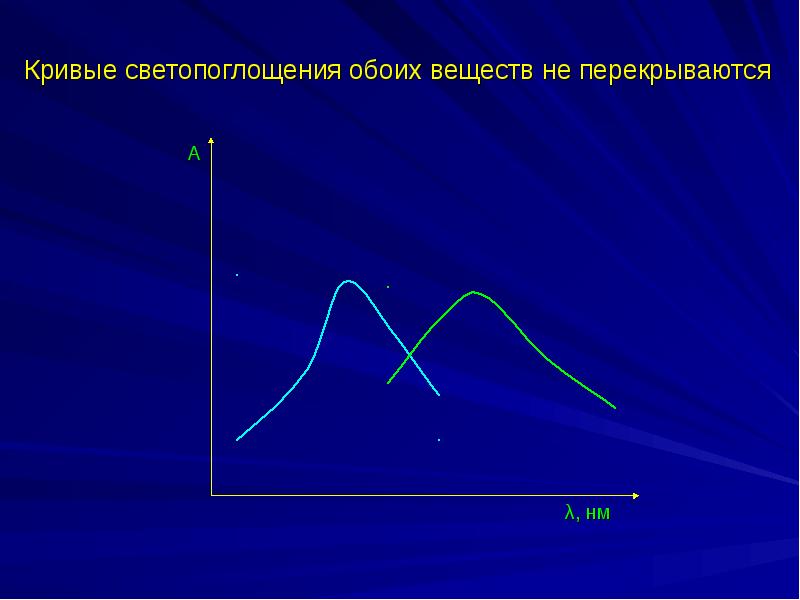
- 34. Спектрофотометрический анализ двухкомпонентных систем Кривые светопоглощения обоих веществ перекрываются
- 35. Кривые светопоглощения обоих веществ перекрываются по всему спектру
- 40. Скачать презентацию






























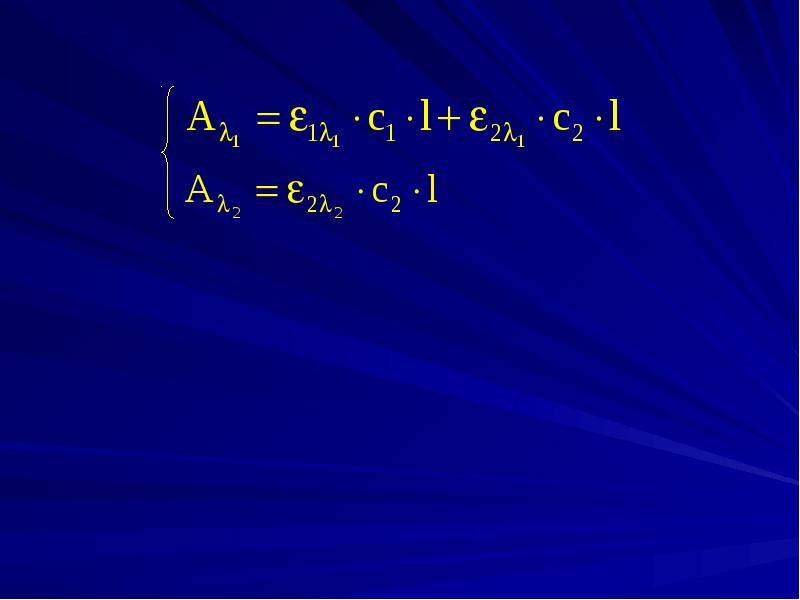
Слайды и текст этой презентации
Похожие презентации





























