Термодинамика химического равновесия презентация
Содержание
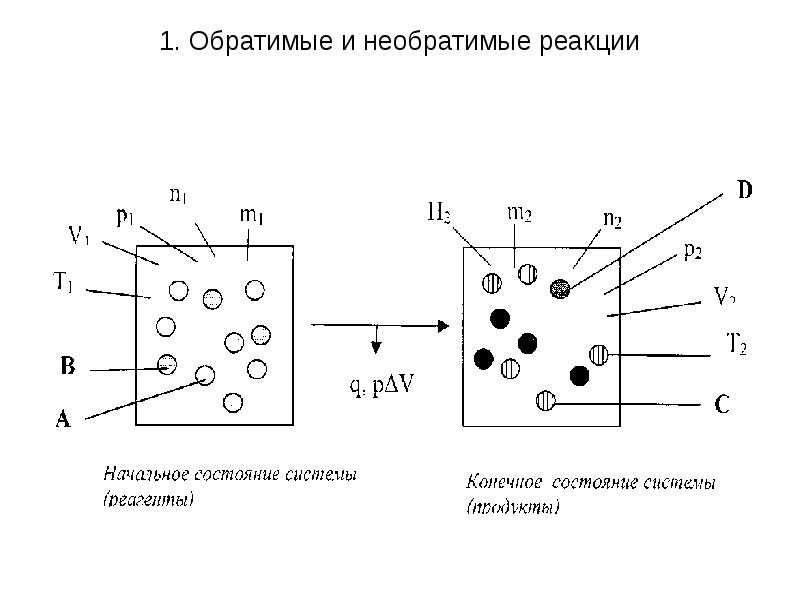
- 2. 1. Обратимые и необратимые реакции Необратимые химические реакции, или односторонние
- 3. 1. Обратимые и необратимые реакции
- 4. 1. Обратимые и необратимые реакции Рассмотрим признаки необратимости химических реакций. 1.
- 5. 1. Обратимые и необратимые реакции 2. Экзотермический характер (экзотермичность) реакции (ΔН
- 6. 1. Обратимые и необратимые реакции Для необратимых реакций, а их
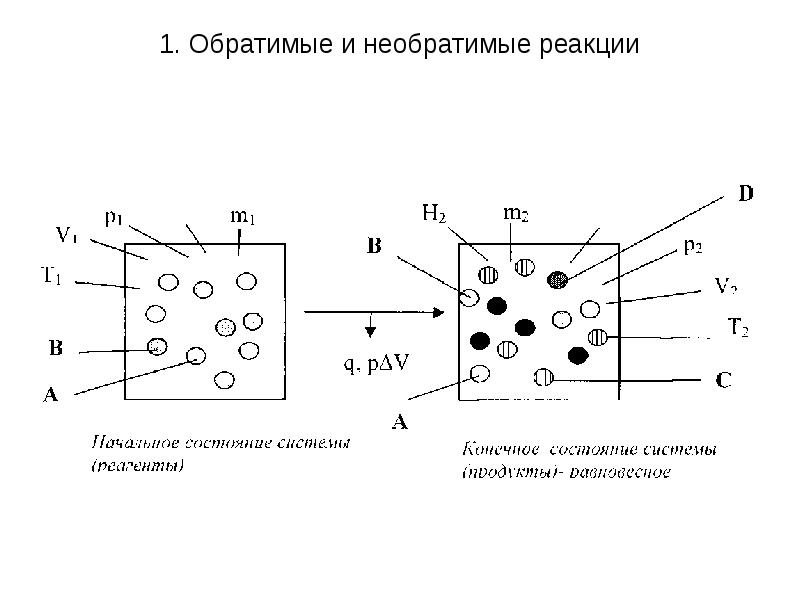
- 7. 1. Обратимые и необратимые реакции Обратимыми (двусторонними, или противоположно направленными)
- 8. 1. Обратимые и необратимые реакции
- 9. 1. Обратимые и необратимые реакции Обратимые реакции в отличие от
- 10. 2. Химическое равновесие и его термодинамические параметры Химическое равновесие может устанавливаться
- 11. 2. Химическое равновесие и его термодинамические параметры Обратимые (и необратимые)
- 12. 2. Химическое равновесие и его термодинамические параметры Обратимые гетерогенные реакции
- 13. 2. Химическое равновесие и его термодин. параметры Под химическим
- 14. 2. Химическое равновесие и его термодинамические параметры термодинамической устойчивостью —неизменностью во
- 15. 2. Химическое равновесие и его термодинамические параметры подвижностью — способностью положения
- 16. 2. Химическое равновесие и его термодинамические параметры возможностью достижения системой равновесного
- 17. 2. Химическое равновесие и его термодинамические параметры динамическим характером, означающим непрерывное
- 18. 2. Химическое равновесие и его термодинамические параметры В результате концентрации
- 19. 2. Химическое равновесие и его термодинамические параметры Количественно химическое равновесие характеризуют:
- 20. 2. Химическое равновесие и его термодинамические параметры Равновесным называют состав реакционной
- 21. 2. Химическое равновесие и его термодинамические параметры равновесные концентрации веществ, которые
- 22. 2. Химическое равновесие и его термодинамические параметры Равновесный выход продукта (η)
- 23. 2. Химическое равновесие и его термодинамические параметры Положение равновесия может
- 24. 2. Химическое равновесие и его термодинамические параметры Одна из важнейших
- 25. 2. Химическое равновесие и его термодинамические параметры Они изменяются в пределах
- 26. 2. Химическое равновесие и его термодинамические параметры Как выражают константу равновесия?
- 27. 2. Химическое равновесие и его термодинамические параметры
- 28. 2. Химическое равновесие и его термодинамические параметры Размерности: [Кс]=моль/м3;
- 29. 2. Химическое равновесие и его термодинамические параметры На основании уравнения состояния
- 30. 2. Химическое равновесие и его термодинамические параметры Отсюда получаем соотношение между
- 31. 2. Химическое равновесие и его термодинамические параметры На основании этого можно
- 32. 2. Химическое равновесие и его термодинамические параметры В случае неидеальных гомогенных
- 33. 2. Химическое равновесие и его термодинамические параметры Определения активности и фугитивности
- 34. 2. Химическое равновесие и его термодинамические параметры В случае гетерогенного равновесия
- 35. 3. Кинетический и термодинамический вывод Кр Кинетический вывод константы равновесия:
- 36. 3. Кинетический и термодинамический вывод Кр Термодинамический вывод константы равновесия (Я.Вант-Гофф):
- 37. 3. Кинетический и термодинамический вывод Кр
- 38. 3. Кинетический и термодинамический вывод Кр При равновесии ΔG=0,
- 39. 3. Кинетический и термодинамический вывод Кр Уравнение изотермы химической реакции Вант-Гоффа
- 40. 3. Кинетический и термодинамический вывод Кр Для вывода уравнения изохоры и
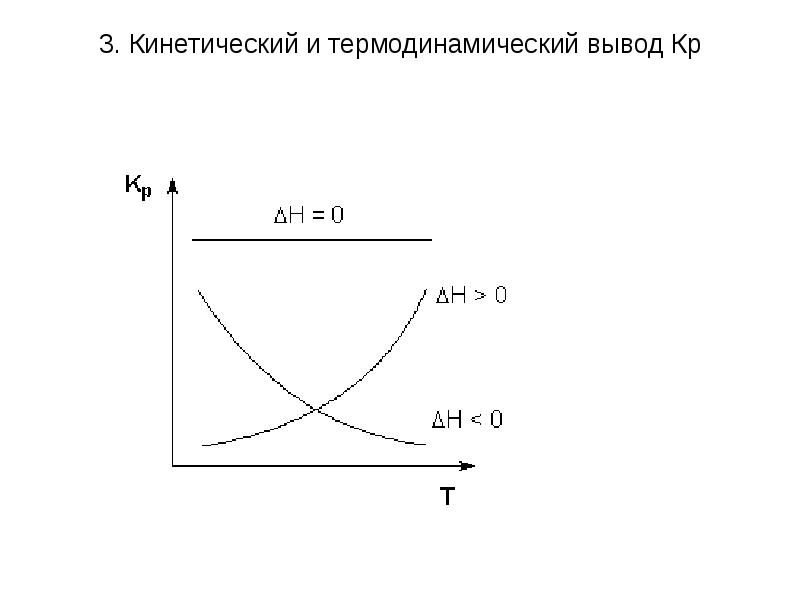
- 41. 3. Кинетический и термодинамический вывод Кр Анализ уравнений Вант-Гоффа: Изменение константы
- 42. 3. Кинетический и термодинамический вывод Кр
- 43. 3. Кинетический и термодинамический вывод Кр Уравнения изобары и изохоры Вант-Гоффа
- 44. спасибо за внимание!
- 45. Скачать презентацию

























![2. Химическое равновесие и его термодинамические параметры
Размерности:
[Кс]=моль/м3;
2. Химическое равновесие и его термодинамические параметры
Размерности:
[Кс]=моль/м3;](/documents_3/36d95b73b643421b8fc118debde9b087/img27.jpg)















Слайды и текст этой презентации
Скачать презентацию на тему Термодинамика химического равновесия можно ниже:
Похожие презентации





























