Галогены презентация
Содержание
- 2. К элементам VII группы, главной подгруппы относятся К элементам VII
- 3. В свободном виде не встречаются В свободном виде не встречаются
- 4. Галит NaCl
- 6. Иод — элемент редкий Иод — элемент редкий
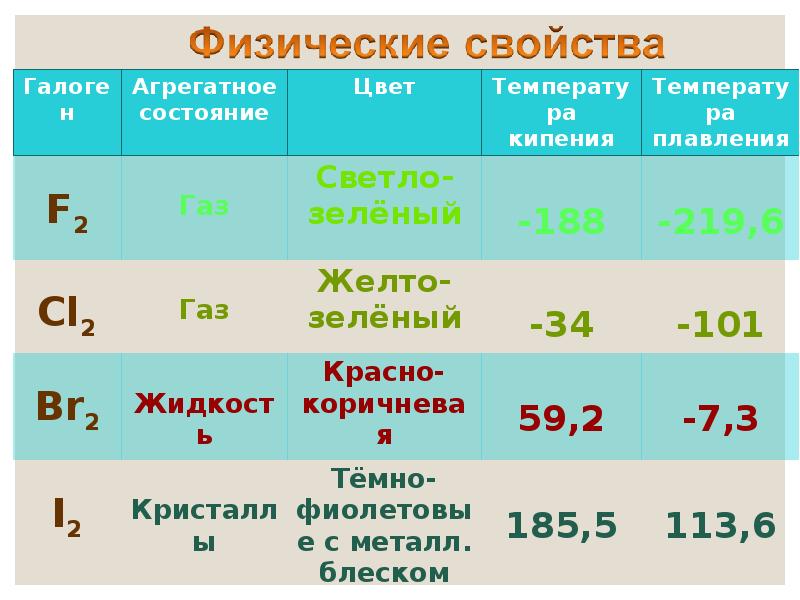
- 8. Неметаллы
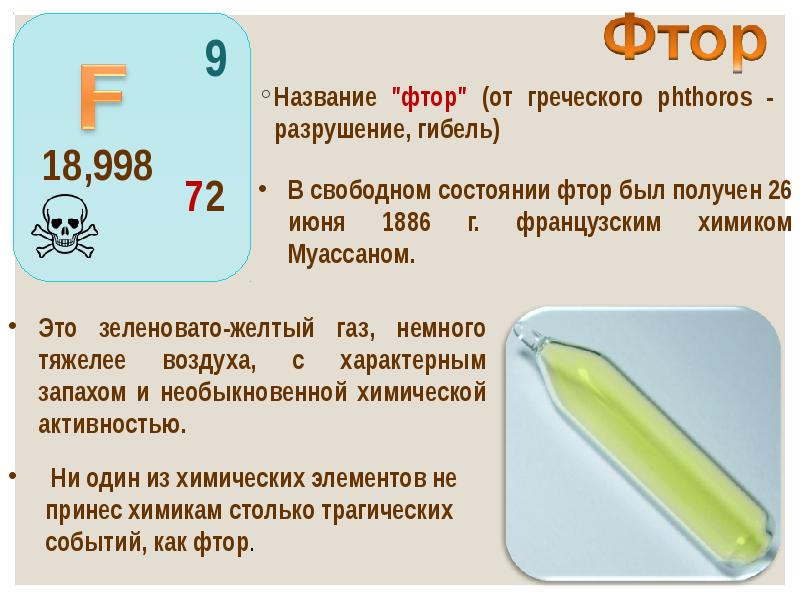
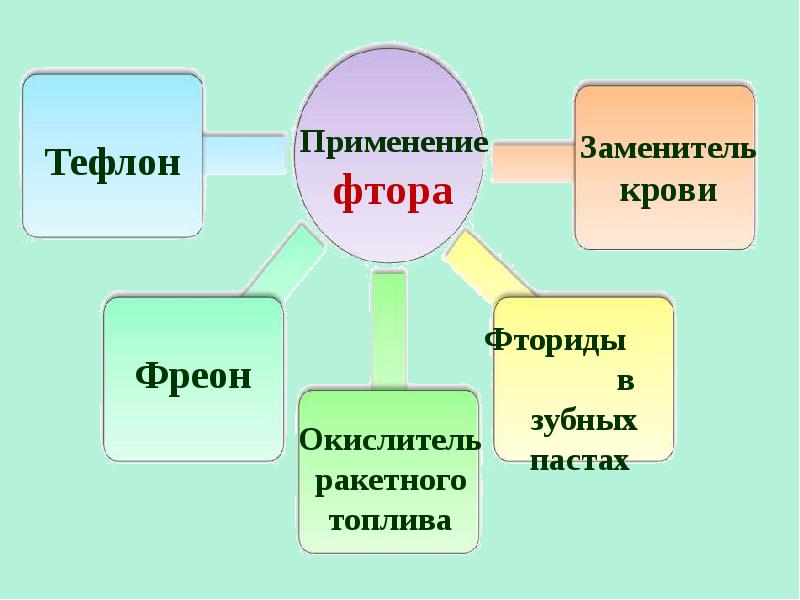
- 10. Название "фтор" (от греческого phthoros - разрушение, гибель) Название "фтор" (от
- 11. Хлор был открыт шведским химиком Карлом Шееле в 1774 г. Хлор
- 12. от греч. bromos – зловоние от греч. bromos – зловоние единственный
- 13. от греч. iodes—имеющий фиалковый цвет от греч. iodes—имеющий фиалковый цвет в
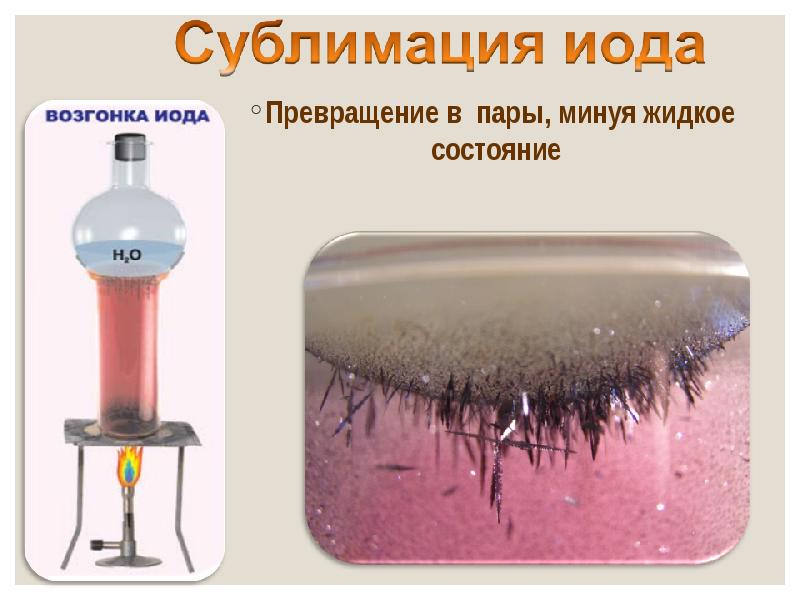
- 14. Превращение в пары, минуя жидкое состояние Превращение в пары, минуя
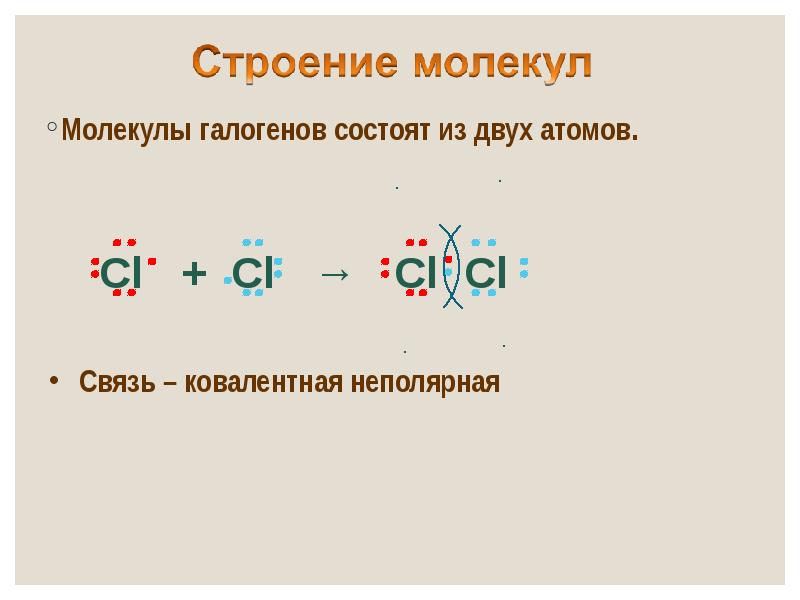
- 15. Молекулы галогенов состоят из двух атомов. Молекулы галогенов состоят из двух
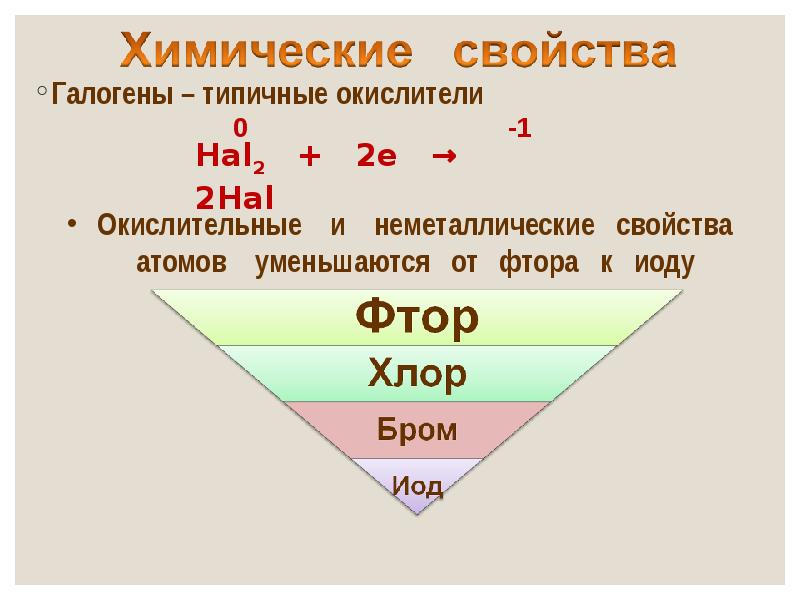
- 16. Галогены – типичные окислители Галогены – типичные окислители
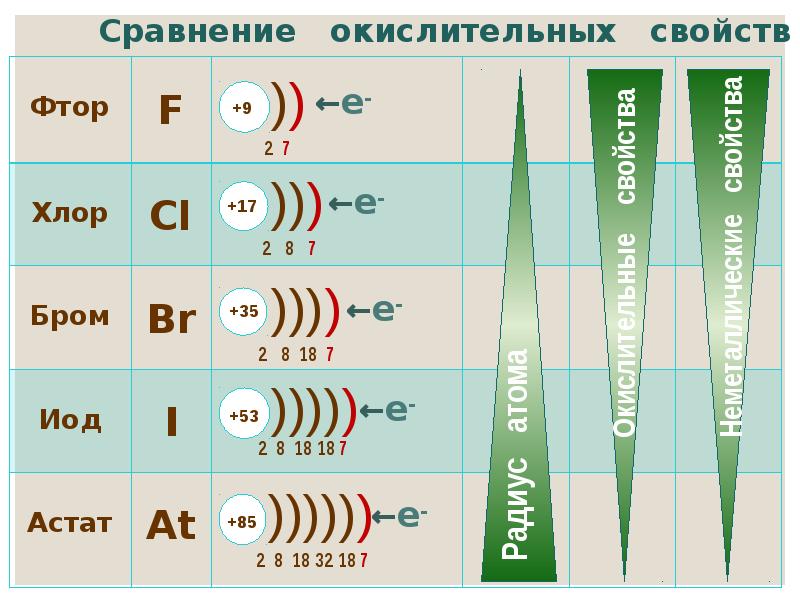
- 17. Сравнение окислительных свойств
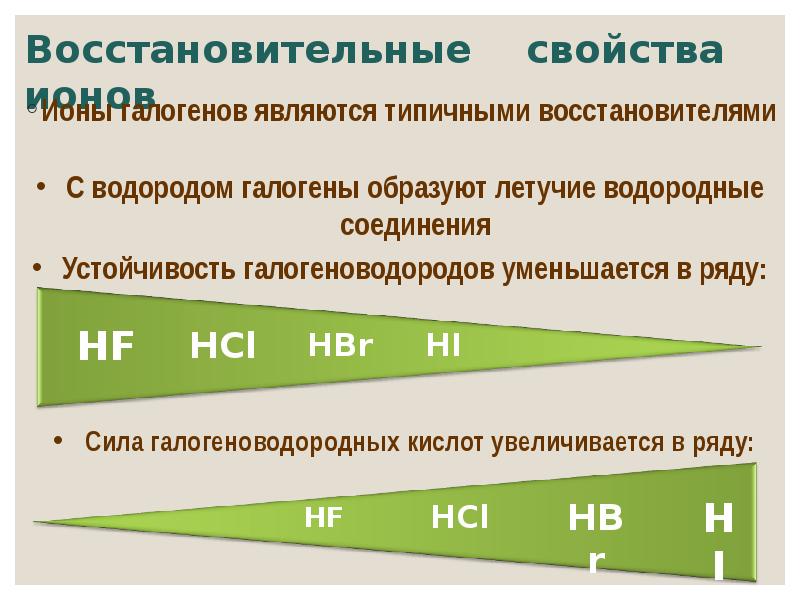
- 18. Восстановительные свойства ионов Ионы галогенов являются типичными восстановителями
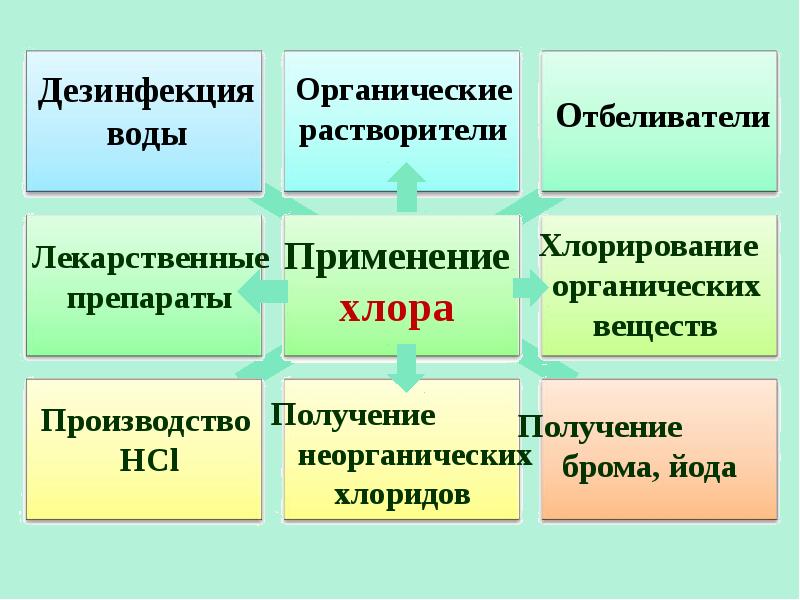
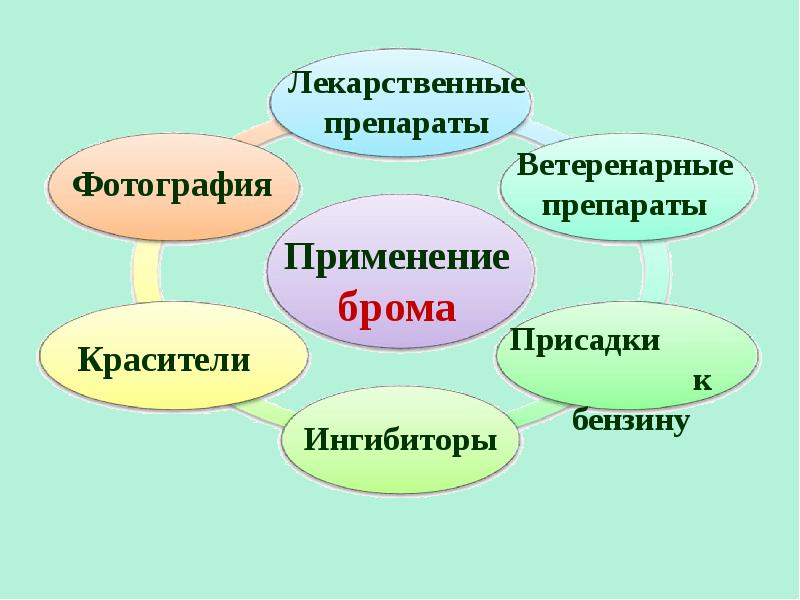
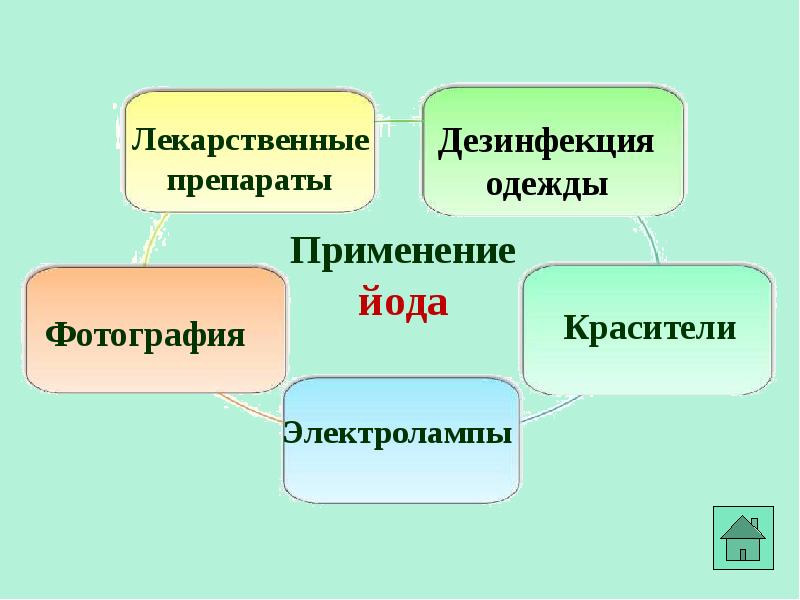
- 19. Соединения галогенов
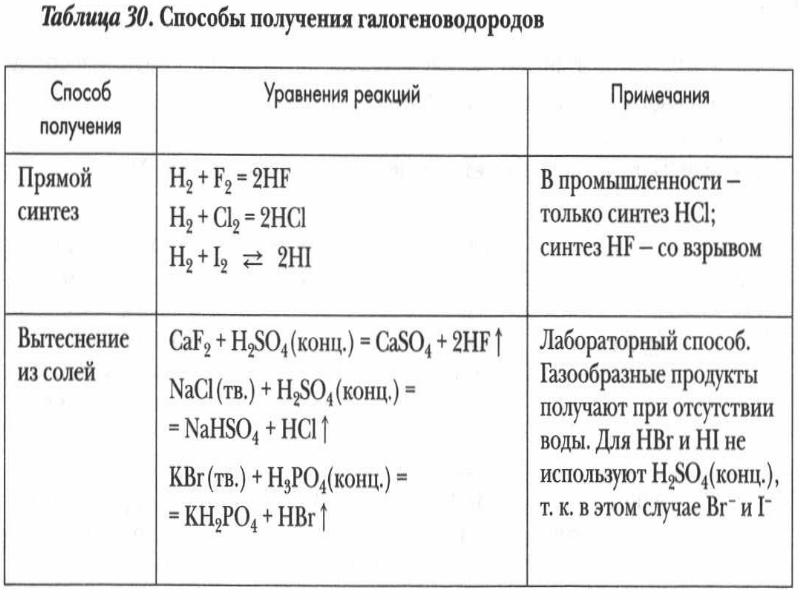
- 20. Галогеноводородные кислоты
- 21. PH3 – H2S – HCl Усиление кислотных св-в. Чем больше радиус
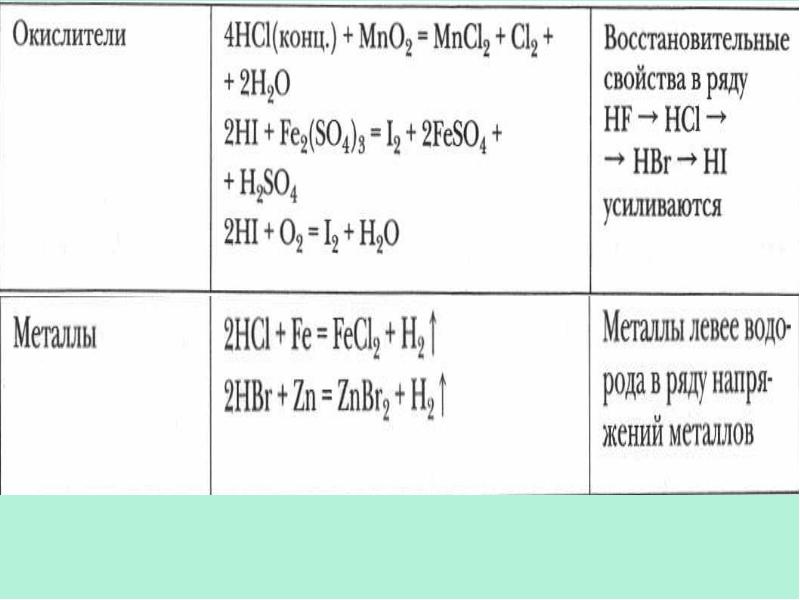
- 24. Химические свойства галогеноводородов
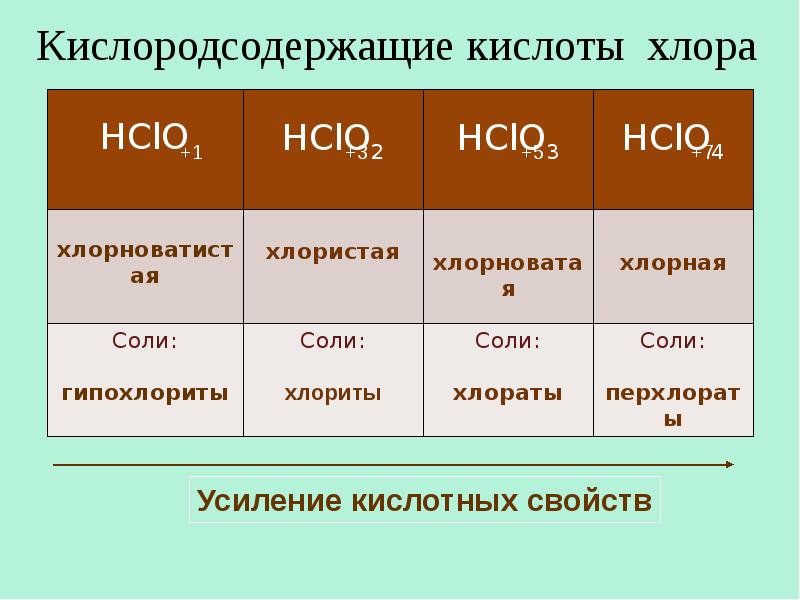
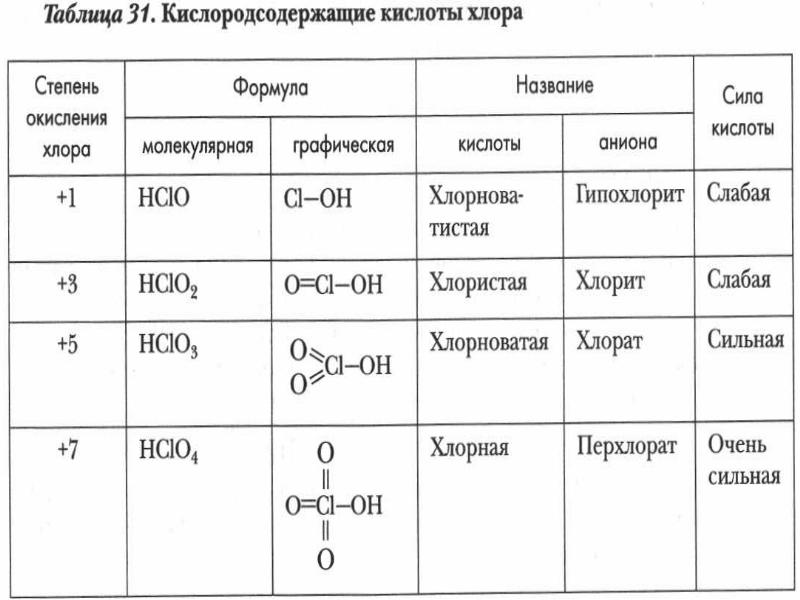
- 27. Кислородсодержащие кислоты хлора
- 29. Химические свойства
- 30. Химические свойства хлора
- 31. 5. Взаимодействие сo щёлочами:
- 32. В промышленности: электролиз расплава или раствора хлорида натрия В промышленности: электролиз
- 37. Скачать презентацию





















Слайды и текст этой презентации
Похожие презентации





























