Строение атома презентация
Содержание
- 2. Свидетельства сложности строения атома Электролиз (1800 г.) Фотоэффект ( Герц, Столетов,
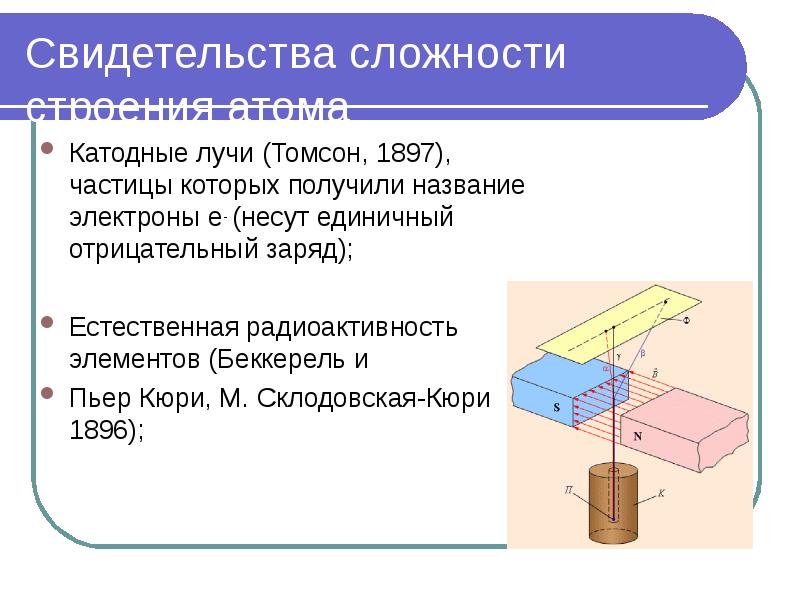
- 3. Свидетельства сложности строения атома Катодные лучи (Томсон, 1897), частицы которых получили
- 4. Основные понятия и определения Атом это наименьшая частица химического элемента, способная
- 5. Основные понятия и определения Электрон – стабильная элементарная частица, имеющая массу
- 6. Основные понятия и определения Протон – ядро атома легкого изотопа водорода
- 7. Основные понятия и определения Нейтрон – электрически нейтральная элементарная частица с
- 8. Атомные спектры Данные о спектрах химических элементов - экспериментальное основание теории
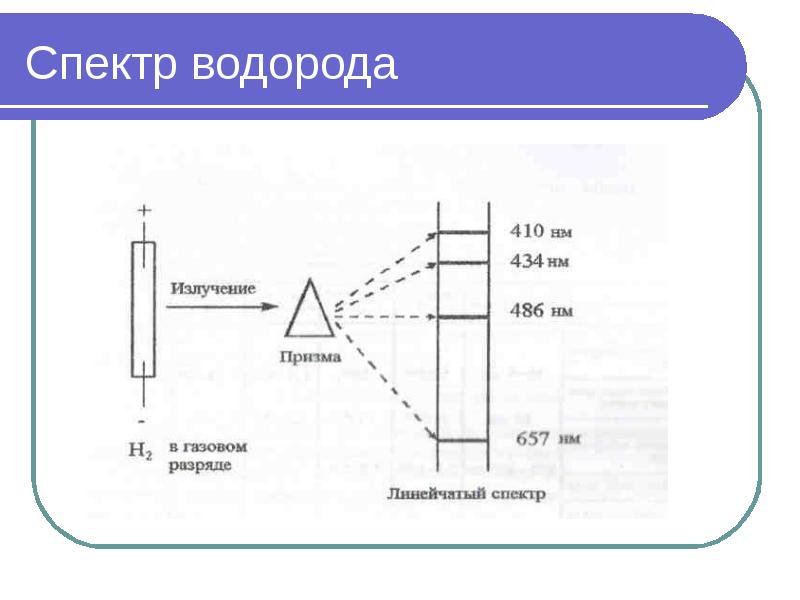
- 9. Спектр водорода
- 10. Атомный спектр водорода в видимой и ближней УФ-области (серия Бальмера)
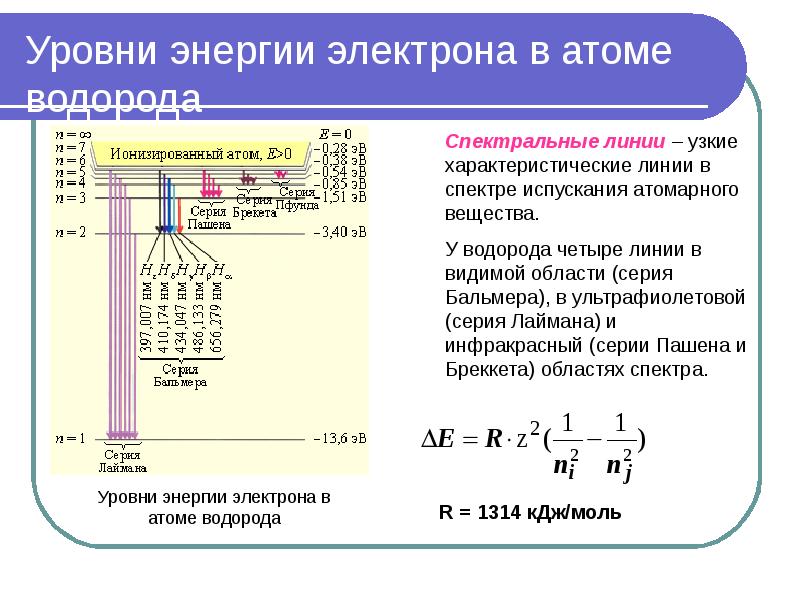
- 11. Уровни энергии электрона в атоме водорода
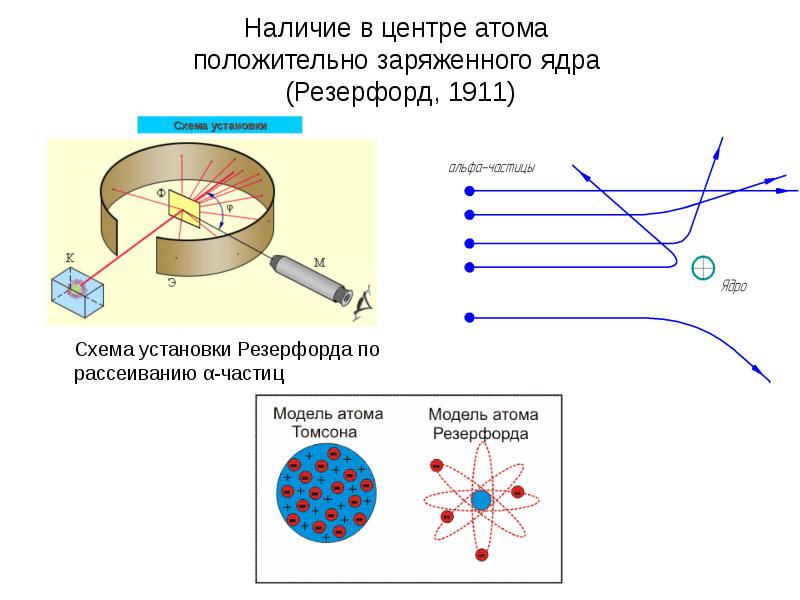
- 12. Наличие в центре атома положительно заряженного ядра (Резерфорд, 1911)
- 13. Планетарная модель строения атома.(Бор,1910г.) Постулаты Бора. 1. Электрон вращается по строго
- 14. Планетарная модель строения атома.(Бор,1910г.) Постулаты Бора
- 15. Постулаты Бора 2. Поглощение и излучением атомом энергии имеет место при
- 16. Основные понятия и определения
- 17. Теория ЗОММЕРФЕЛЬДА Стационарные орбиты в атомах могут быть не только круговыми,
- 18. Недостатки теории Бора-Зоммерфельда 1. При расчете ряда спектральных характеристик теория дает
- 19. Квантово-механическая модель строения атома Двойственная природа электрона. Электрон обладает корпускулярно-волновым дуализмом,
- 20. Квантово-механическая модель строения атома Принцип неопределенности Гейзенберга (1927 г.): невозможно в
- 21. Уравнение Шредингера Э. Шредингер предложил описывать движение микрочастиц с помощью уравнения,
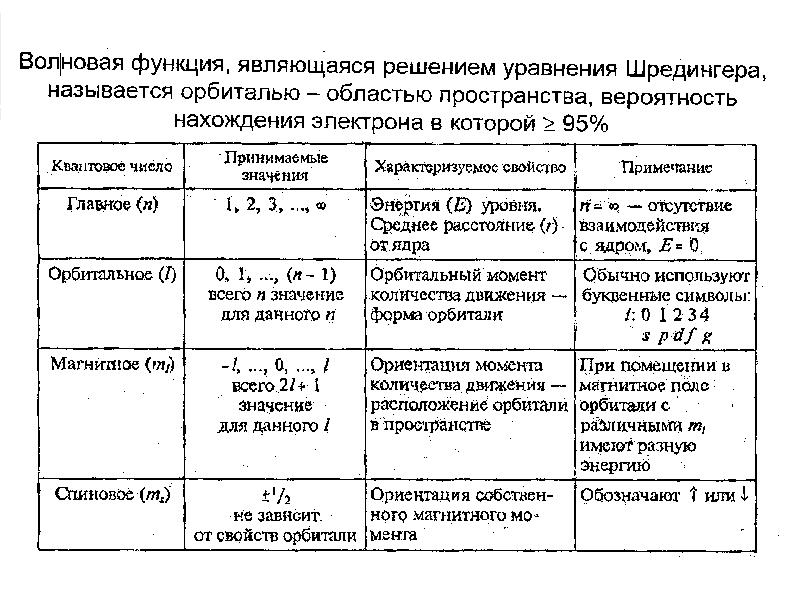
- 22. Квантовые числа Для описания орбитали (электрона) используют квантовые числа (параметры в
- 23. n характеризует: а) номер энергетического уровня; б) интервал энергии электронов, находящихся
- 24. Энергия связи электрона с ядром определяется формулой: Энергия связи электрона с
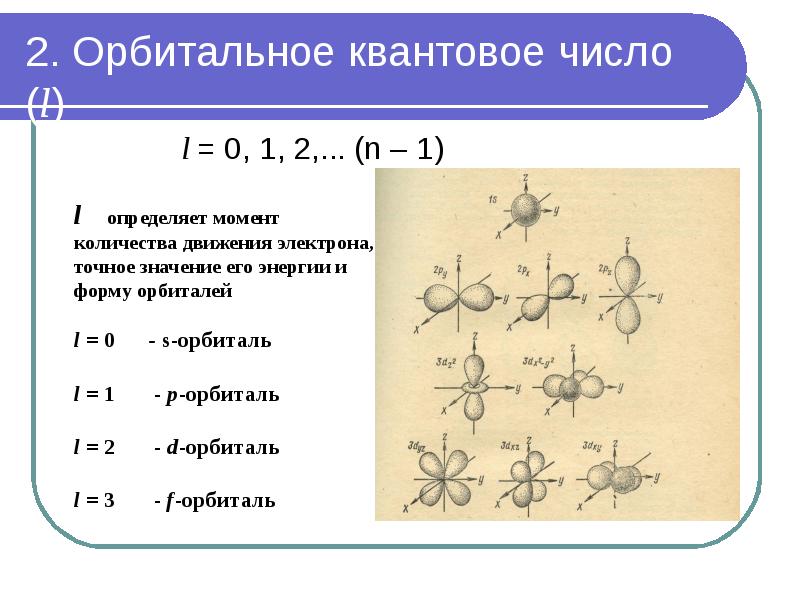
- 25. 2. Орбитальное квантовое число (l)
- 26. 2. Орбитальное квантовое число (l)
- 27. 3. Магнитное квантовое число (m) m = -l…0…+ l определяет возможные
- 28. Спиновое квантовое число S s = ± 1/2 отражает
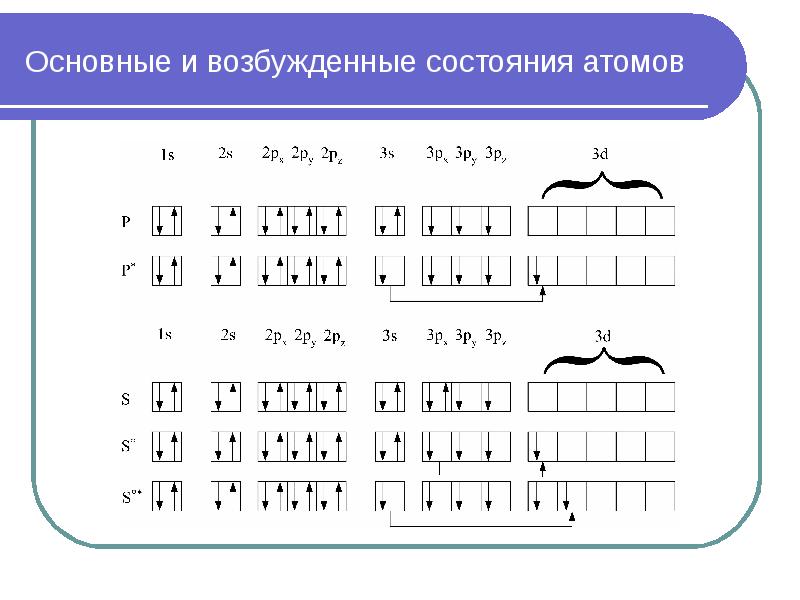
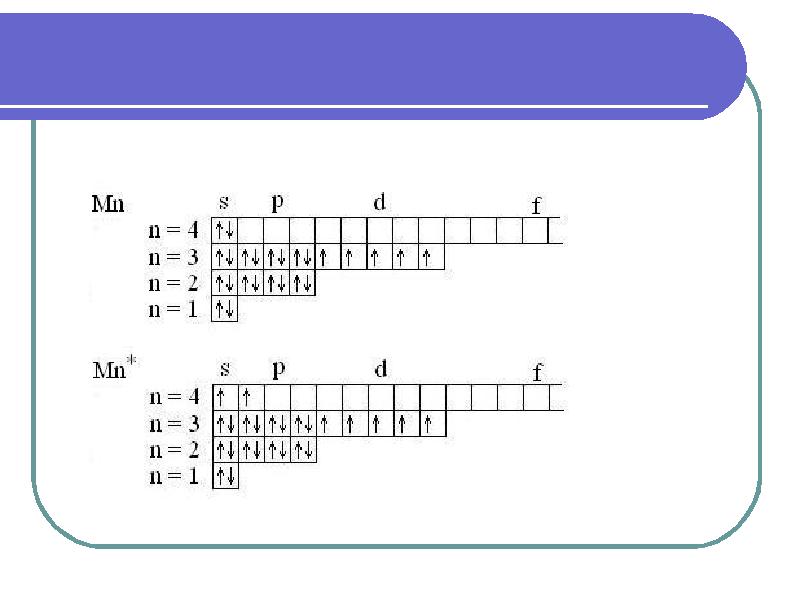
- 32. Возбужденные состояния атомов
- 34. Основные и возбужденные состояния атомов
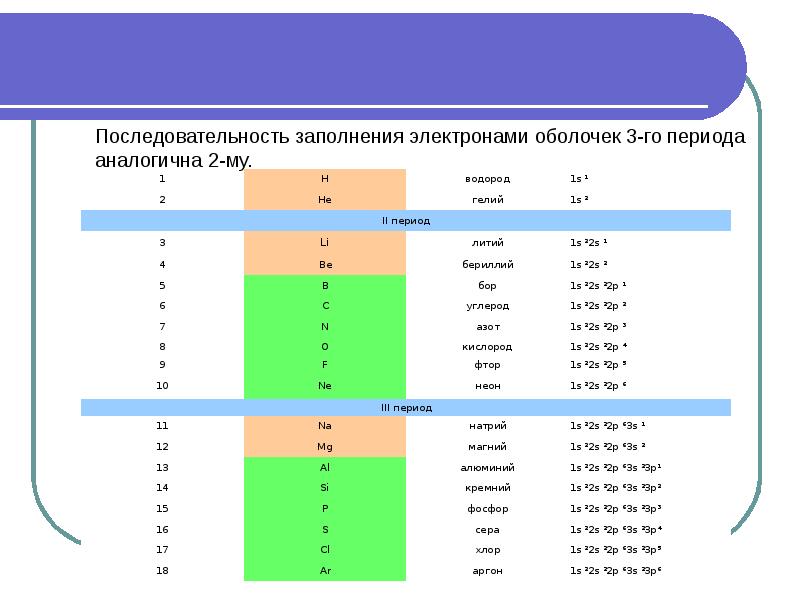
- 35. Третий период заканчивается Ar+18 1S22S22p63S23p6 Третий период заканчивается Ar+18 1S22S22p63S23p6
- 37. Заполнение электронами внешнего уровня начинается у Заполнение электронами внешнего уровня
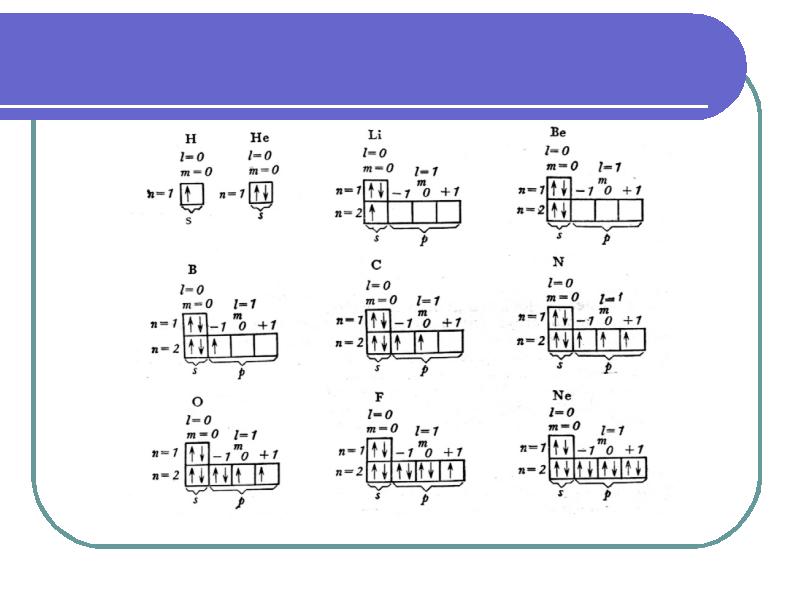
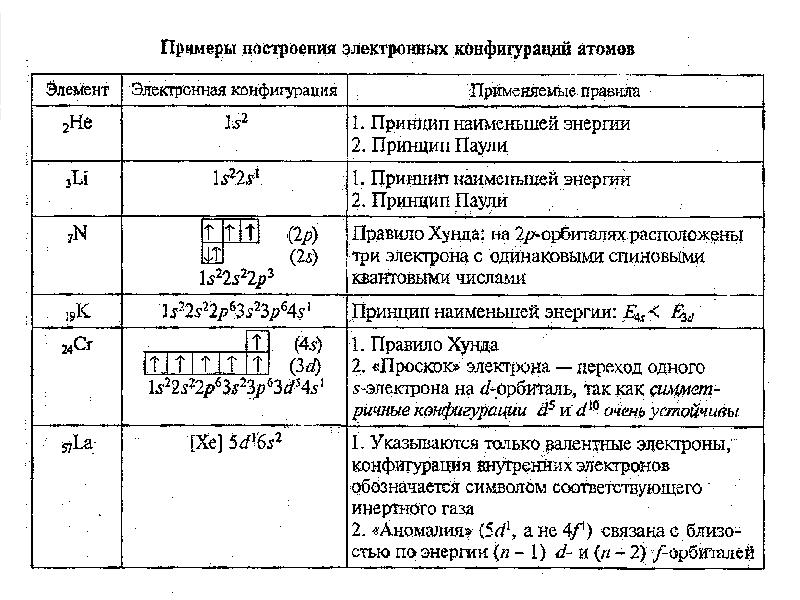
- 38. Принцип Паули и правило Хунда Принцип Паули. В атоме не может
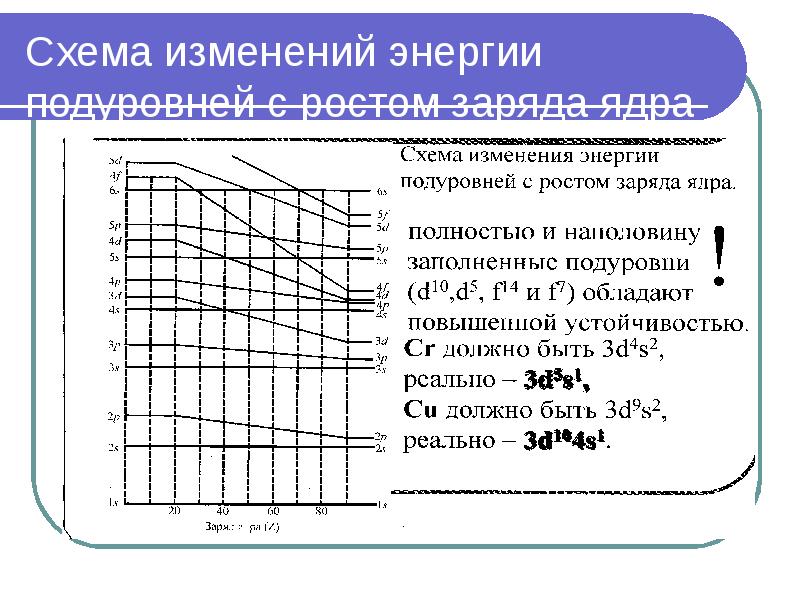
- 39. Многоэлектронные атомы 1. Принцип минимума энергии В атоме каждый электрон занимает
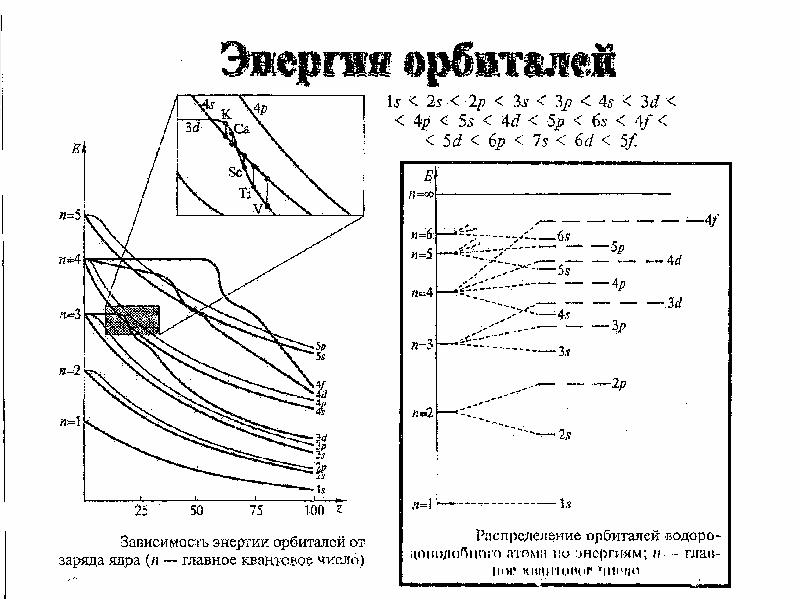
- 40. Схема изменений энергии подуровней с ростом заряда ядра
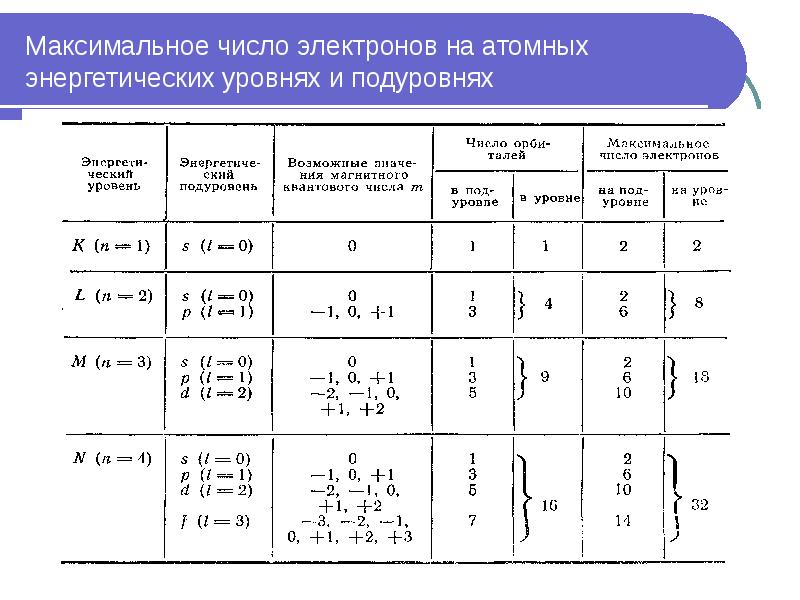
- 43. Максимальное число электронов на атомных энергетических уровнях и подуровнях
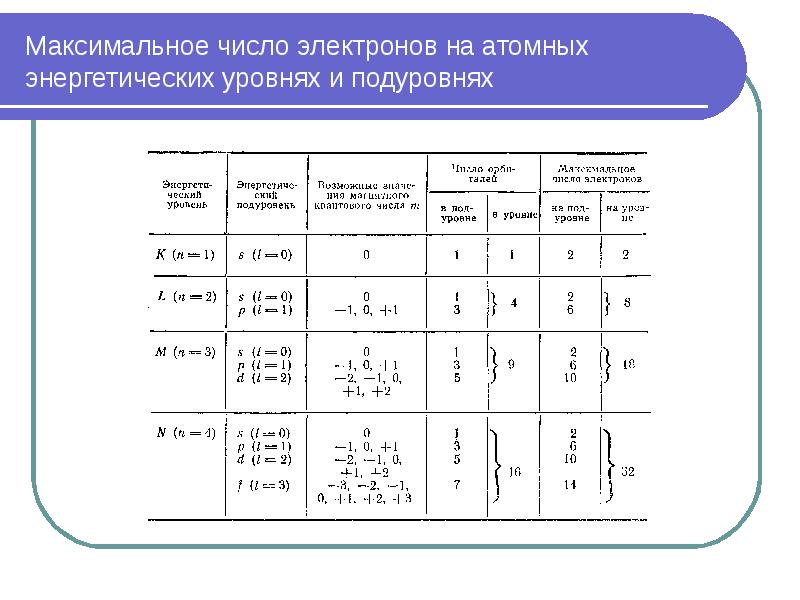
- 44. Максимальное число электронов на атомных энергетических уровнях и подуровнях
- 47. Скачать презентацию






























Слайды и текст этой презентации
Похожие презентации





























