Охрана окружающей среды от загрязнения сульфуро-содержащими соединениями презентация
Содержание
- 2. Введение Основные сведения Сера в природе и ее применение Химические и
- 3. Основные сведения Сера известна человечеству с древнейших времен. Встречаясь в
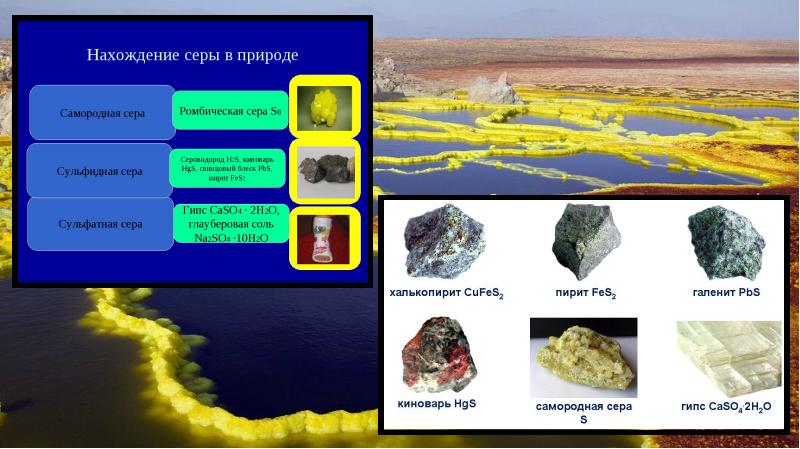
- 4. Сера в природе Главная масса серы находится в глубинах земли, в
- 6. Применение серы и ее соединений Серу используют для производства серной кислоты, изготовления
- 7. Физические свойства серы Сера представляет собой твердое хрупкое вещество желтого цвета,
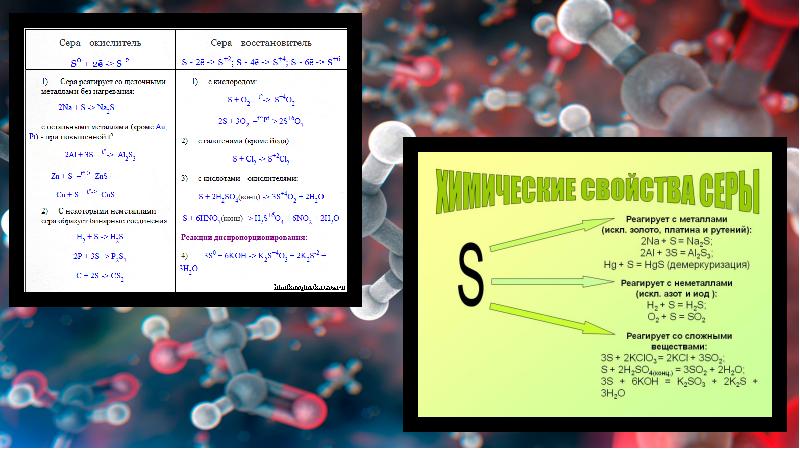
- 9. Химические свойства серы При комнатной температуре сера вступает в реакции только
- 11. Основная часть Биологическая роль и формы существования серы в окружающей среде
- 12. Биологическая роль и формы существования серы в окружающей среде Биологическая
- 13. Влияние на человека Газ сероводород крайне ядовит: уже при концентрации
- 14. Неблагоприятные факторы окружающей среды: загрязнение атмосферного воздуха, воды, почвы, сельскохозяйственной продукции.
- 15. Загрязнение атмосферы Тепловые электростанции загрязняют атмосферу выбросами, которые содержат сернистый ангидрид,
- 16. Кислотные осадки Кислотными называют любые осадки: дожди, туманы, снег, – кислотность
- 17. Источники кислотных осадков Химический анализ кислотных осадков показывает присутствие серной и
- 19. Влияние кислотных осадков на леса Многие учёные считают эти осадки, как
- 20. Влияние кислотных остатков на памятники архитектуры С точки зрения неспециалиста, одно
- 22. Пути поступления серы в окружающую среду в условиях техногенеза При
- 24. Заключение Решение проблемы Вывод
- 25. Решение проблемы: В результате очистки конечных газов, от серы можно получить
- 26. Вывод В настоящее время серосодержащие вещества в огромных количествах выбрасываются в
- 27. Скачать презентацию
























Слайды и текст этой презентации
Скачать презентацию на тему Охрана окружающей среды от загрязнения сульфуро-содержащими соединениями можно ниже:
Похожие презентации