Химическая кинетика презентация
Содержание
- 2. ХИМИЧЕСКАЯ КИНЕТИКА Скорость химической реакции есть число элементарных актов химической
- 3. ХИМИЧЕСКАЯ КИНЕТИКА Одной из задач, стоящих перед химической кинетикой, является
- 4. ХИМИЧЕСКАЯ КИНЕТИКА Скорость химической реакции зависит от множества факторов: природы
- 5. ХИМИЧЕСКАЯ КИНЕТИКА Закон действующих масс: Скорость химической реакции прямо пропорциональна
- 6. ХИМИЧЕСКАЯ КИНЕТИКА Коэффициент пропорциональности k есть константа скорости химической реакции.
- 7. ХИМИЧЕСКАЯ КИНЕТИКА Зависимость скорости реакции от концентраций реагирующих веществ определяется
- 8. ХИМИЧЕСКАЯ КИНЕТИКА Показатель степени при концентрации каждого из реагирующих веществ
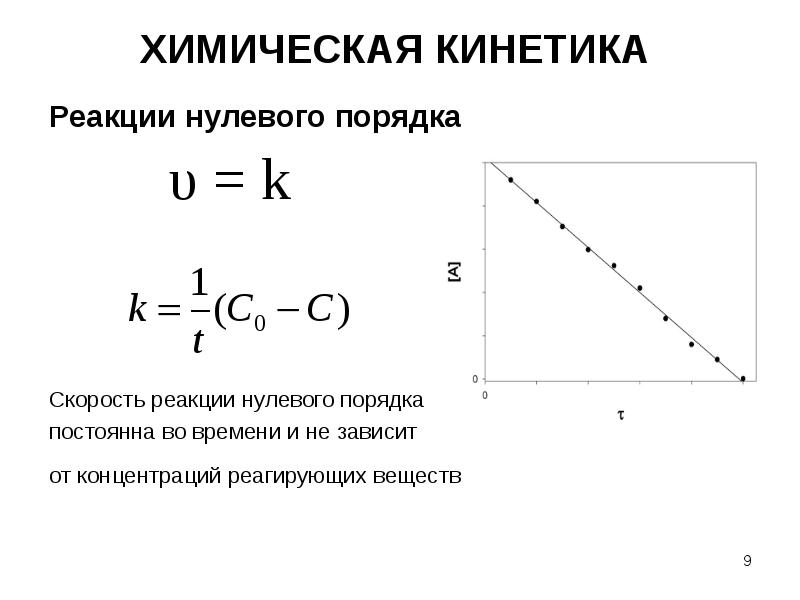
- 9. ХИМИЧЕСКАЯ КИНЕТИКА Реакции нулевого порядка Скорость
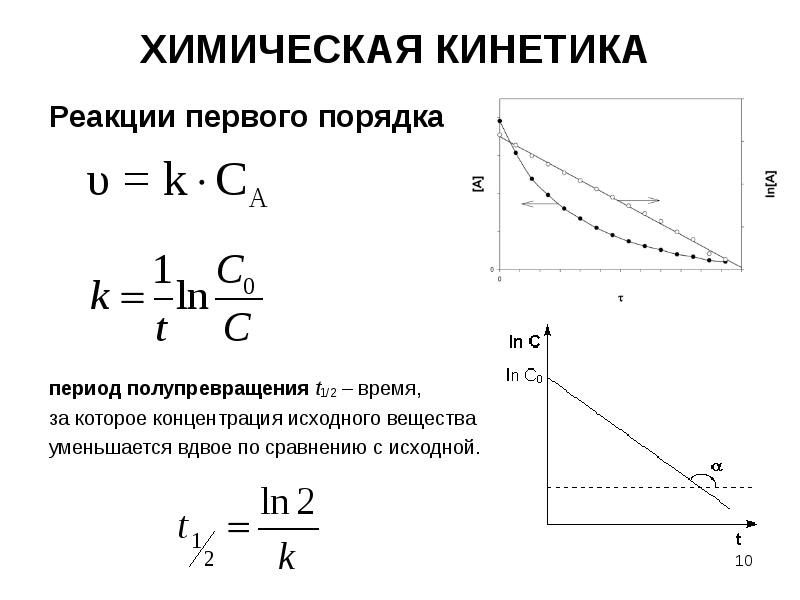
- 10. ХИМИЧЕСКАЯ КИНЕТИКА Реакции первого порядка
- 11. ХИМИЧЕСКАЯ КИНЕТИКА Реакции второго порядка
- 12. ХИМИЧЕСКАЯ КИНЕТИКА Молекулярность число частиц, которые, согласно экспериментально установленному механизму
- 13. ХИМИЧЕСКАЯ КИНЕТИКА Влияние температуры на скорость реакции Правило Вант-Гоффа При
- 14. ХИМИЧЕСКАЯ КИНЕТИКА Теория активных столкновений (С. Аррениус) Условия для прохождения
- 15. ХИМИЧЕСКАЯ КИНЕТИКА Уравнение Аррениуса столкновения молекул будут эффективны (т.е. будут
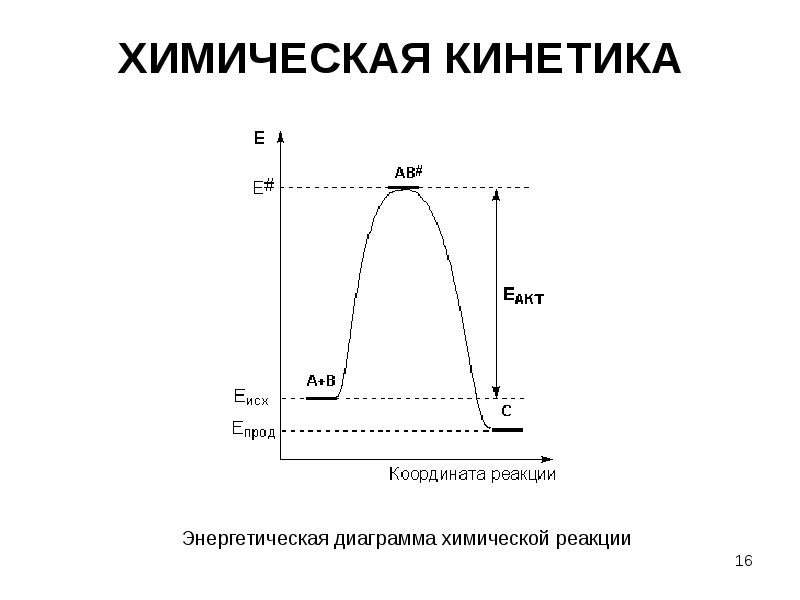
- 16. ХИМИЧЕСКАЯ КИНЕТИКА
- 17. ХИМИЧЕСКАЯ КИНЕТИКА Катализ – явление изменения скорости химической реакции в присутствии
- 18. ХИМИЧЕСКАЯ КИНЕТИКА Свойства катализаторов: Специфичность - способность ускорять только одну реакцию
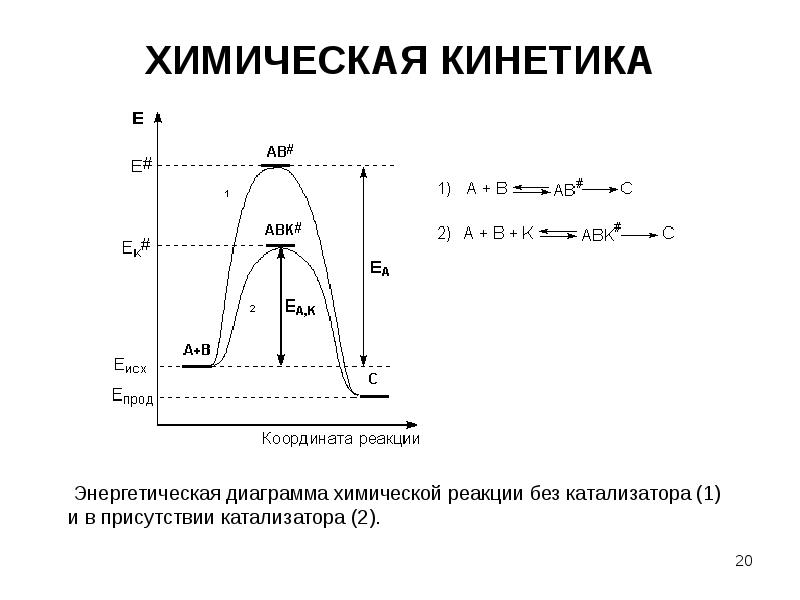
- 19. ХИМИЧЕСКАЯ КИНЕТИКА Причиной увеличения скорости реакции при положительном катализе является уменьшение
- 20. ХИМИЧЕСКАЯ КИНЕТИКА
- 21. ХИМИЧЕСКАЯ КИНЕТИКА В зависимости от фазового состояния реагентов и катализатора различают:
- 22. ХИМИЧЕСКАЯ КИНЕТИКА Автокатализ процесс каталитического ускорения химической реакции одним из её
- 23. ХИМИЧЕСКАЯ КИНЕТИКА Ферментативный катализ каталитические реакции, протекающие с участием ферментов –
- 24. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Обратимыми называют реакции, продукты которых могут между собой взаимодействовать
- 25. ХИМИЧЕСКОЕ РАВНОВЕСИЕ принцип Ле-Шателье - Брауна, или принцип подвижного равновесия
- 26. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- 27. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- 28. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- 29. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- 30. ХИМИЧЕСКОЕ РАВНОВЕСИЕ N2 + 3H2 ↔ 2NH3 ΔH = -
- 31. Скачать презентацию


























Слайды и текст этой презентации
Похожие презентации