Строение атома презентация
Содержание
- 2. Цели урока Дать понятие о составе атома и составе атомного
- 3. Актуализация знаний 1. В предложение вставьте слова „атом” и „молекула”
- 4. Основные положения атомно-молекулярного учения (М. Ломоносов) Вещества состоят из молекул,
- 5. Атом - сложная частица Введение понятия „электрон” (Стони) Открытие
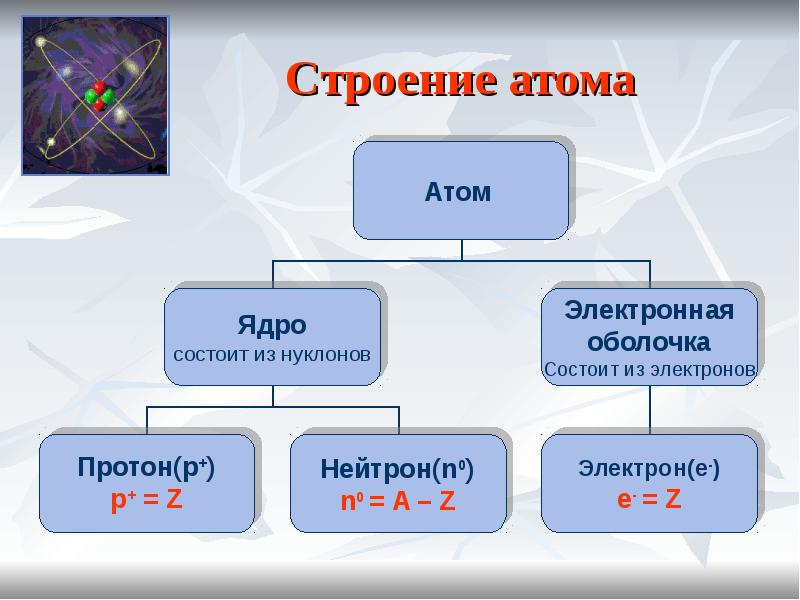
- 6. Строение атома
- 7. Планетарная модель атома (Резерфорд) Атом –это микрочастица, которая имеет форму шара.
- 8. Строение атома Связь строения атома и Периодической системы химических элементов
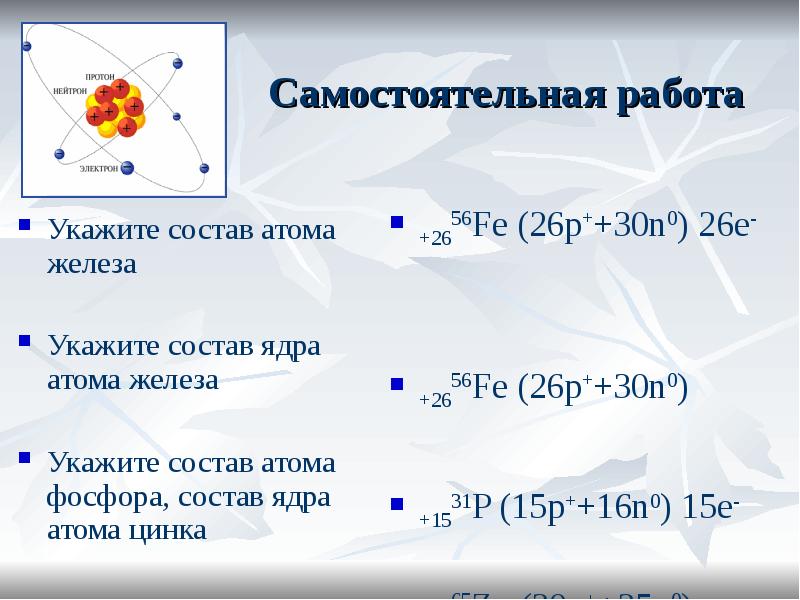
- 9. Самостоятельная работа Укажите состав атома железа Укажите состав ядра атома
- 10. Домашнее задание § 6 Задание №3, №5 (с.43) Творческое задание: Пользуясь
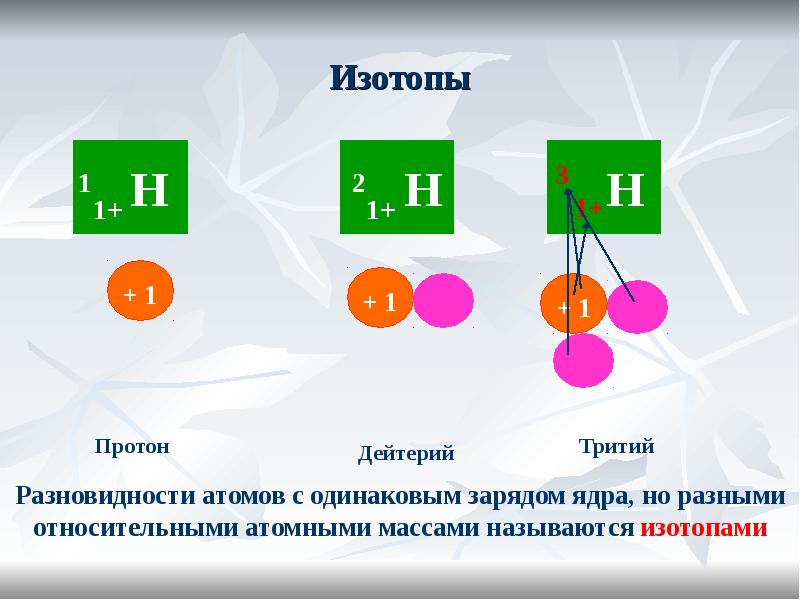
- 11. Изменения в составе ядер атомов химических элементов. Изотопы
- 12. Что произойдет с атомом элемента, если в его ядре изменить число
- 13. Что произойдет с атомом элемента, если в его ядре изменить число
- 14. Изотопы Укажите состав изотопов хлора: 35Сl и 37Сl +1735Сl(17p++18n0) 17е- Аr=35
- 15. Строение ядра
- 16. Изотопы
- 17. Электронное облако
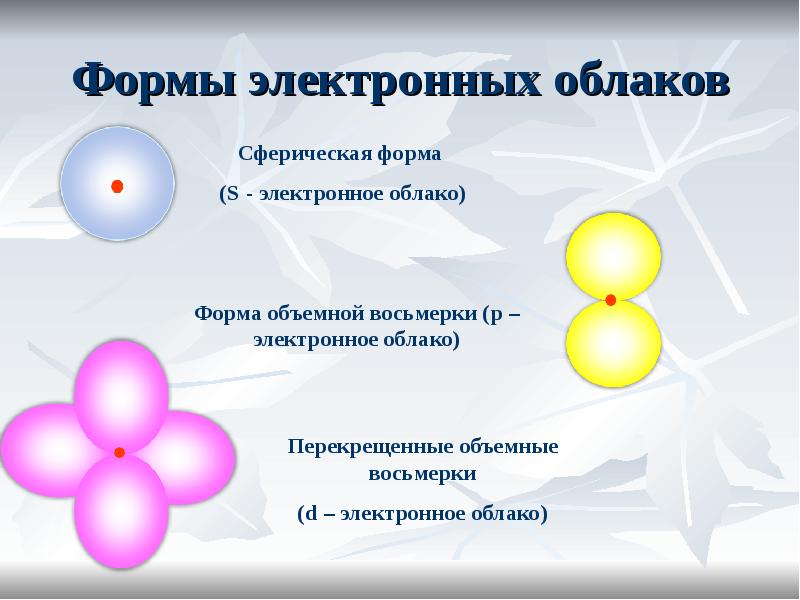
- 18. Формы электронных облаков
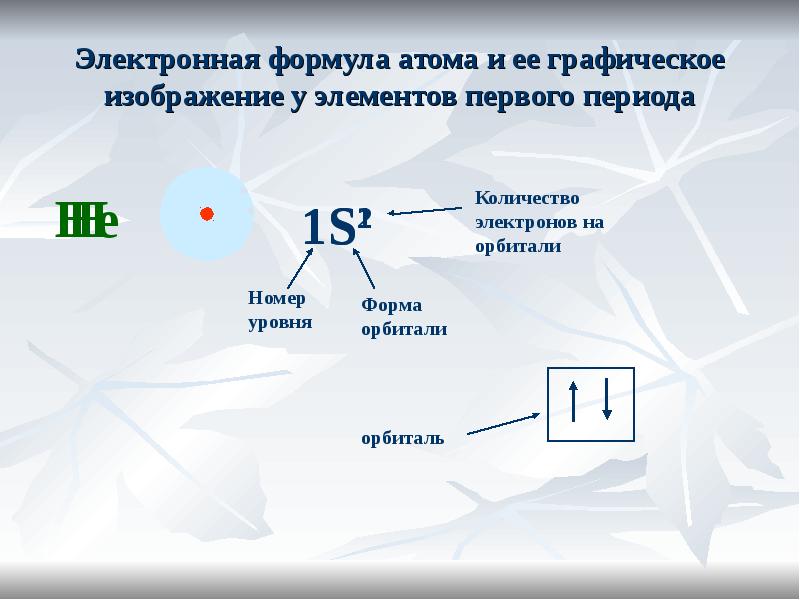
- 20. Электронная формула атома и ее графическое изображение у элементов первого периода
- 21. Задание 1 Символ изотопа элемента +1939Э. Определите, какой это элемент,
- 22. Задание 2 Природный хлор состоит из 75% изотопа с массовым числом
- 23. Задание 3 Символ изотопа элемента +1939Э. Определите, какой это элемент, состав
- 24. Задание 4 Относительная атомная масса хлора 35,5. Хлор существует в природе
- 25. Домашнее задание §7 Задание №6 (с.46) Дополнительное задание: Подготовить сообщение
- 26. Скачать презентацию




















Слайды и текст этой презентации
Похожие презентации





























