Химическая связь презентация
Содержание
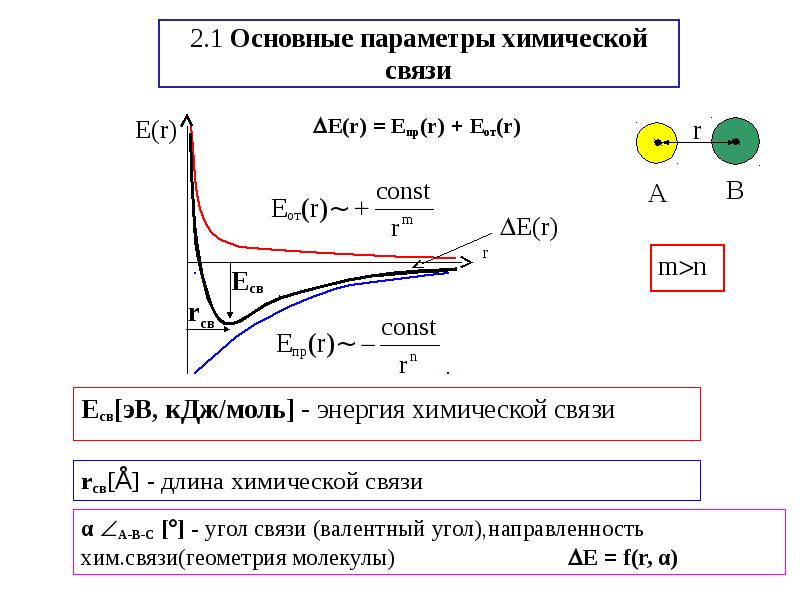
- 2. 2.1 Основные параметры химической связи
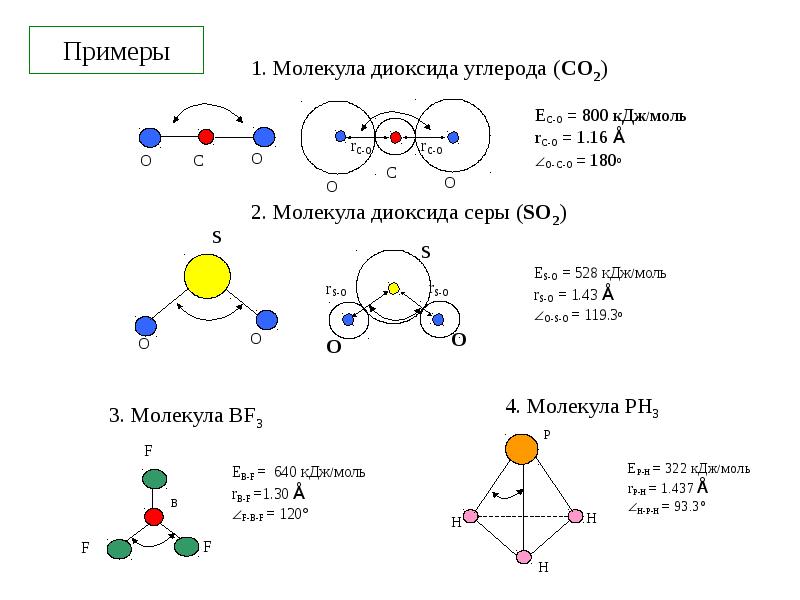
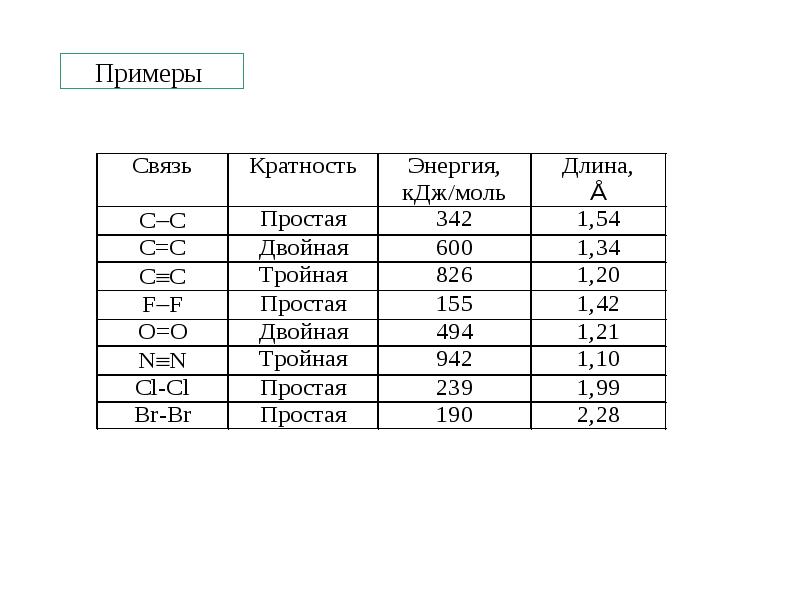
- 3. Примеры
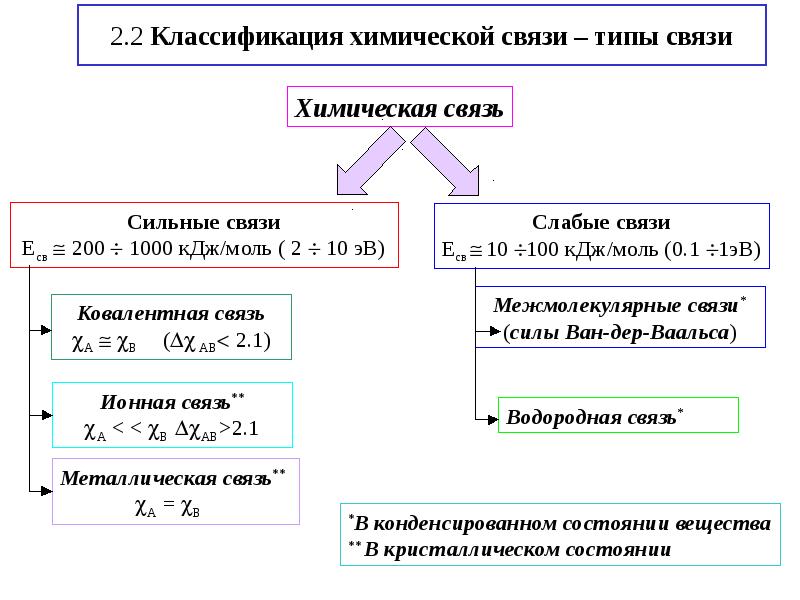
- 4. 2.2 Классификация химической связи – типы связи
- 5. 2.3 Ковалентная хим.связь Количественное квантово-механическое описание связи - это определение параметров
- 6. Потенциальная энергия при образовании молекулы Н2
- 7. Метод валентных связей (ВС) (на примере молекулы Н2) В.Гайтлер и Ф.Лондон
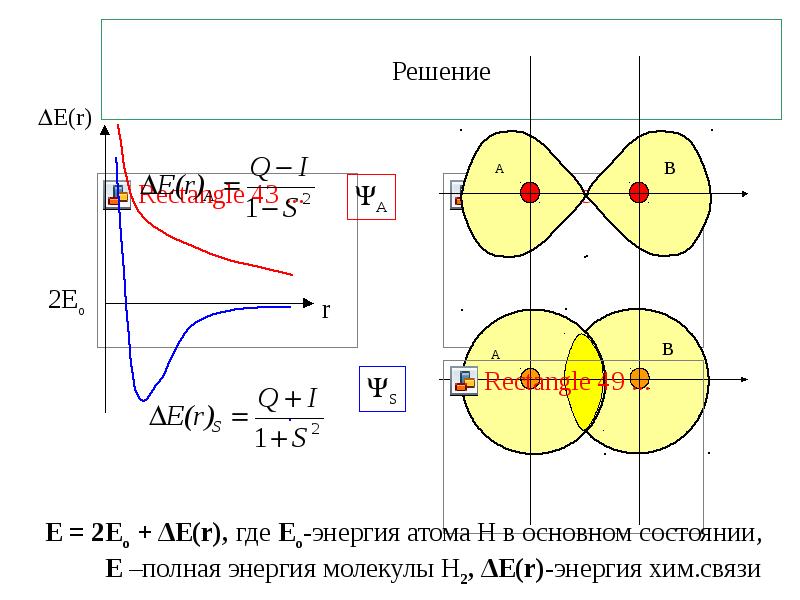
- 8. Решение
- 9. Интегралы
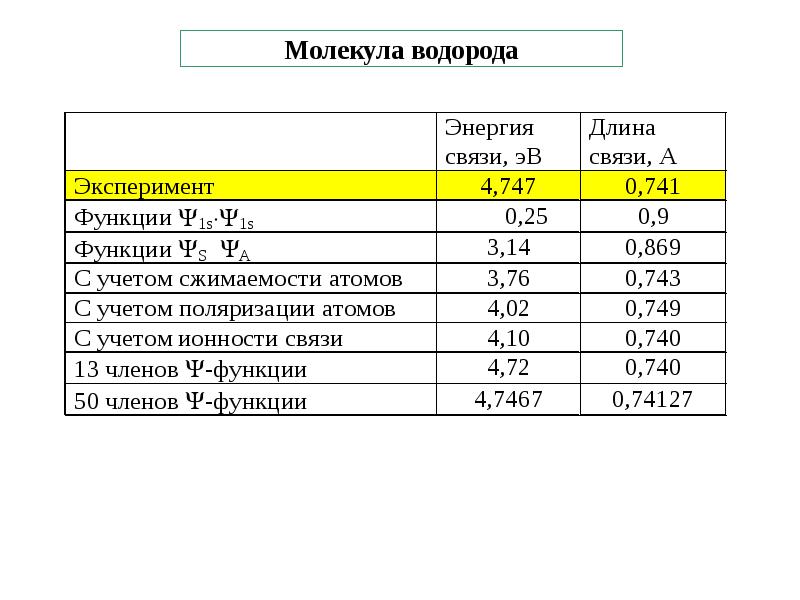
- 10. Молекула водорода
- 11. Принципы (постулаты) метода ВС(на основе представлений при расчете молекулы водорода)
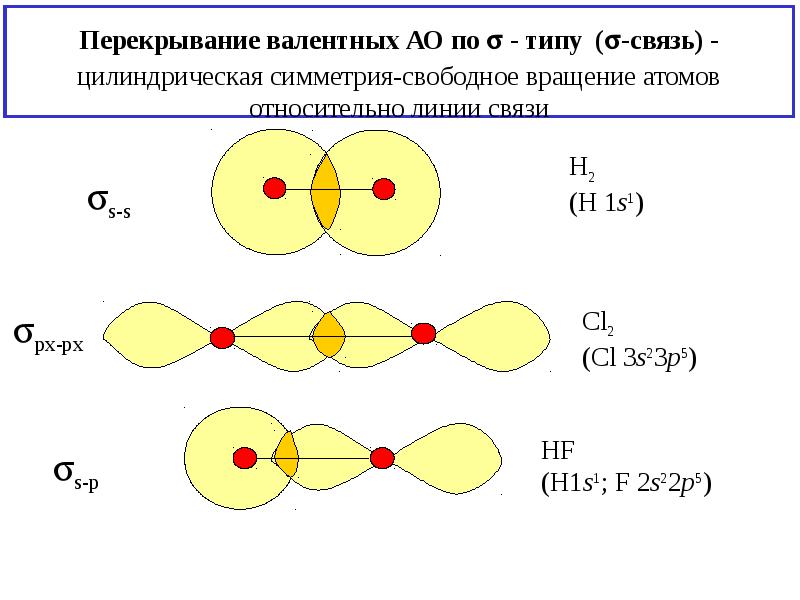
- 12. Перекрывание валентных АО по - типу (-связь) - цилиндрическая симметрия-свободное
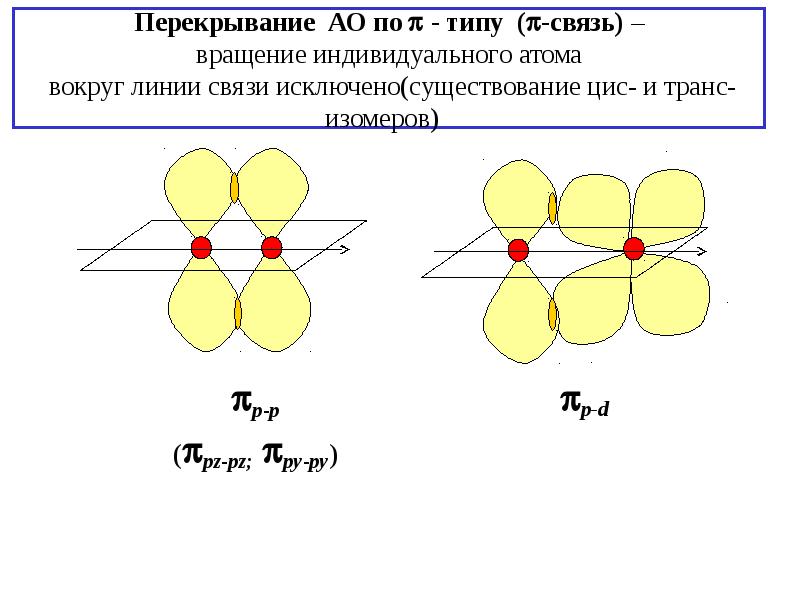
- 13. Перекрывание АО по - типу (-связь) – вращение индивидуального атома
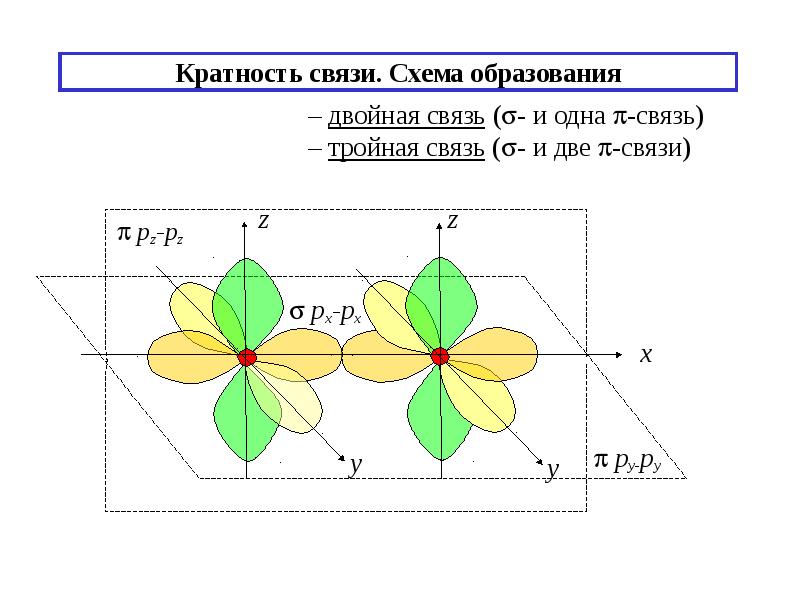
- 14. Кратность связи. Схема образования
- 15. Примеры
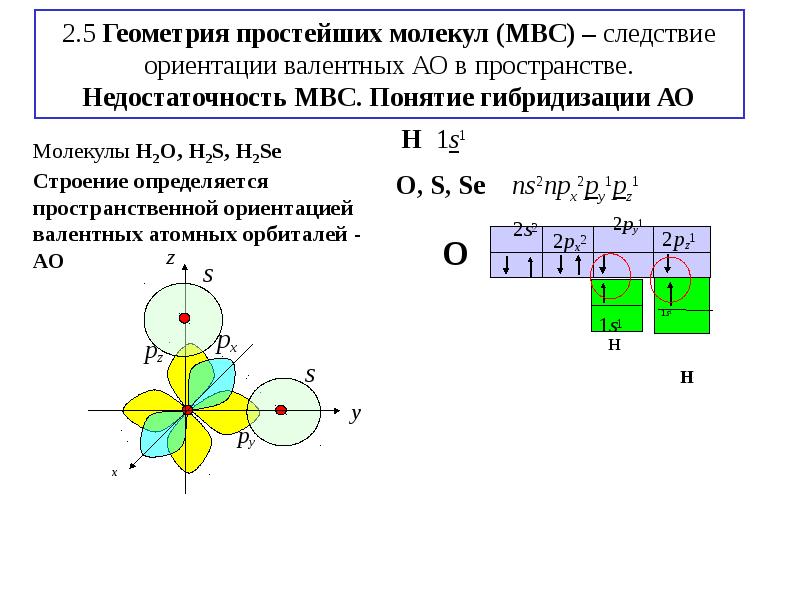
- 16. 2.5 Геометрия простейших молекул (МВС) – следствие ориентации валентных АО в
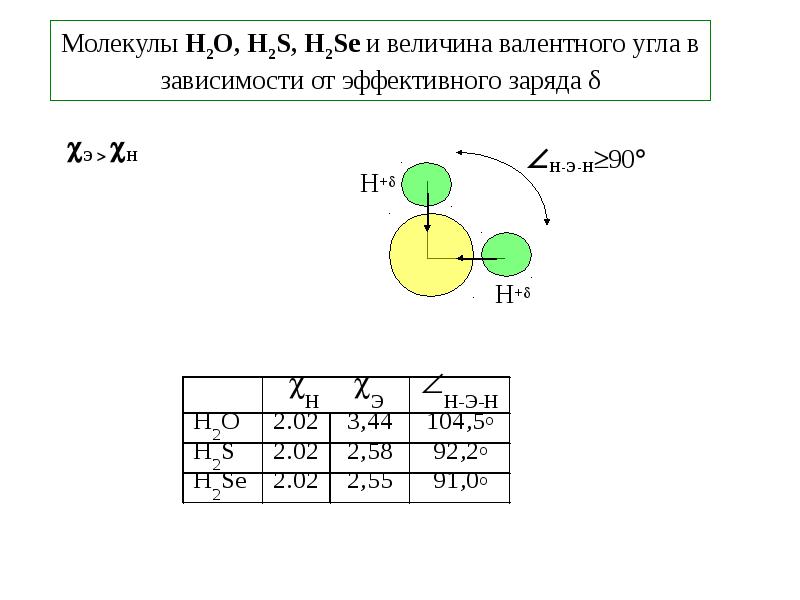
- 17. Молекулы H2O, H2S, H2Se и величина валентного угла в зависимости от
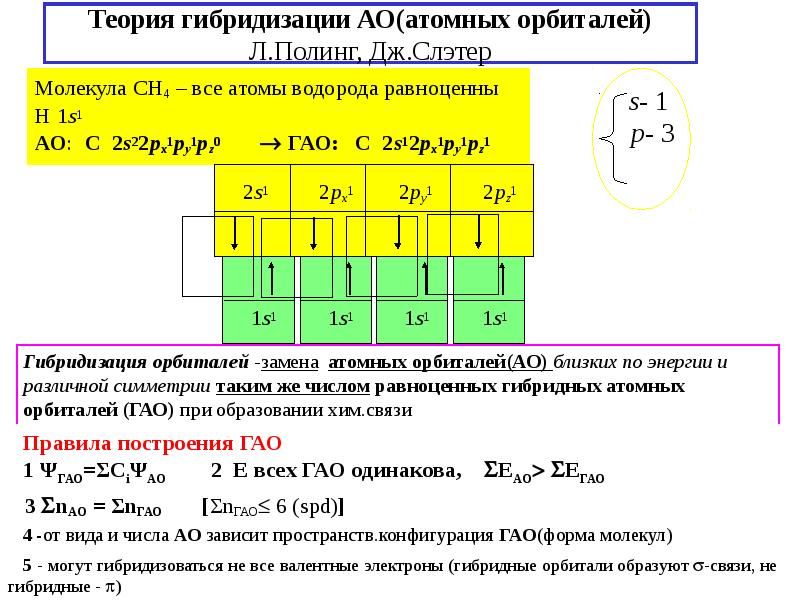
- 18. Теория гибридизации АО(атомных орбиталей) Л.Полинг, Дж.Слэтер
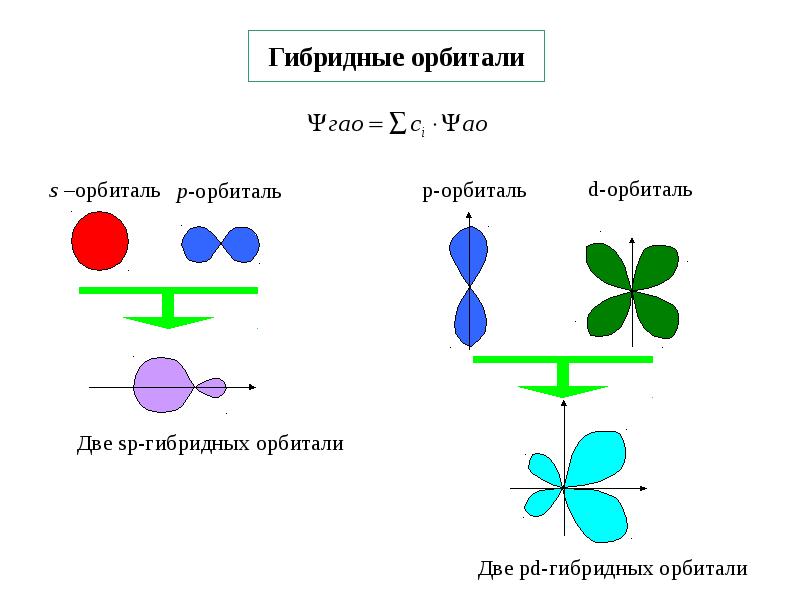
- 19. Гибридные орбитали
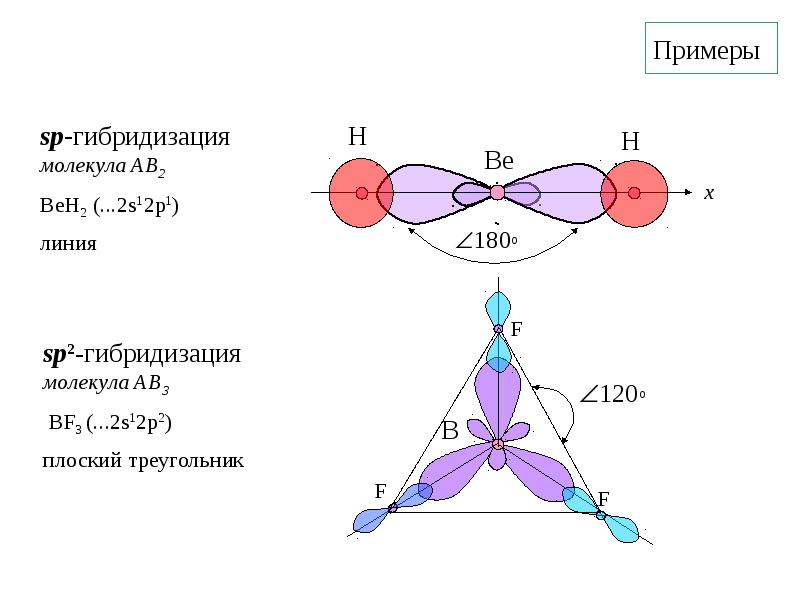
- 20. Примеры
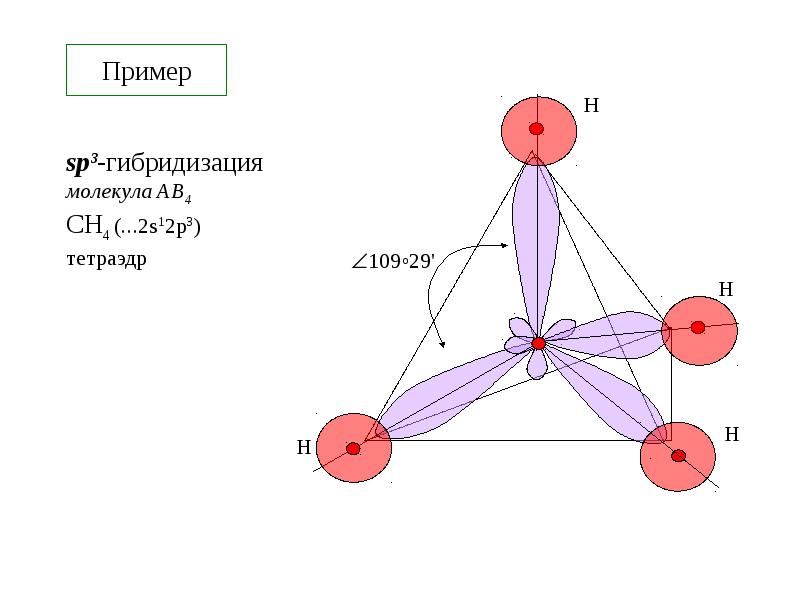
- 21. Пример
- 22. Пример
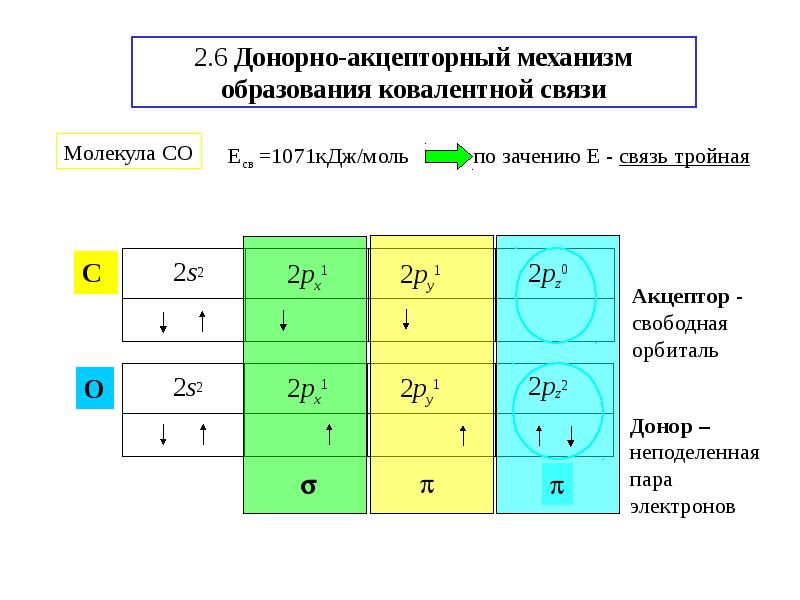
- 23. 2.6 Донорно-акцепторный механизм образования ковалентной связи
- 24. Ион [NH4]+ NH3 + H+ [NH4]+
- 25. 2.7 Метод молекулярных орбиталей (ММО) Роберт Малликен
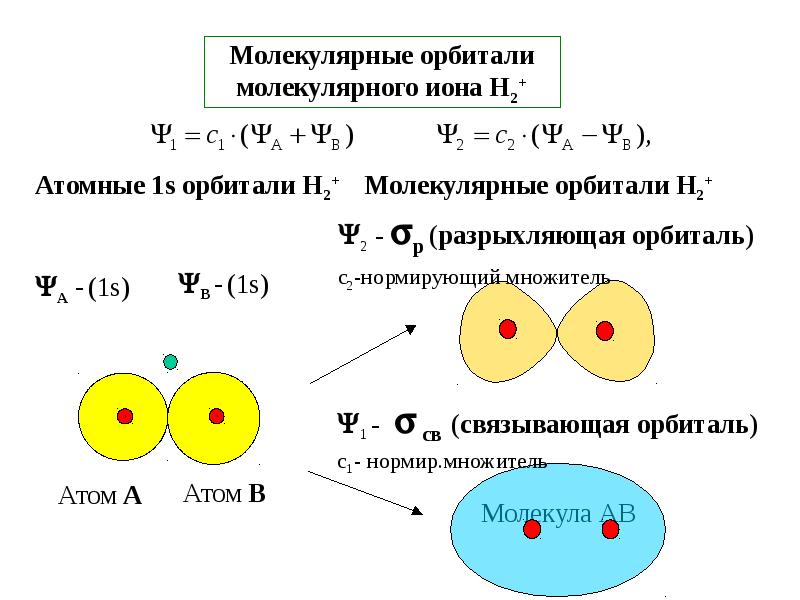
- 26. Молекулярные орбитали молекулярного иона Н2+
- 27. Энергетическая диаграмма молекулы водорода
- 28. Правила построения энергетических диаграмм ММО
- 29. Пример: энергетическая диаграмма молекулы NO
- 30. Скачать презентацию







![Ион [NH4]+ NH3 + H+ [NH4]+ Ион [NH4]+ NH3 + H+ [NH4]+](/documents_3/620b62731b21b32eaa5be06ffd1aa2b0/img23.jpg)




Слайды и текст этой презентации
Похожие презентации





























