Актуальные вопросы регулирования обращения биологических препаратов
Содержание
- 2. Основные проблемы Перспективы рынка биологических ЛС Биологическое ЛС, биоаналог –
- 3. Биофармацевтический рынок является привлекательным для фармацевтических компаний Объем мировых продаж биофармацевтического
- 4. Препараты биологической природы Первые биологические лекарственные средства начали использоваться в
- 5. Биологические препараты Группа ЛС, близких по строению/ составу к природным
- 6. Биологическое лекарственное средство иммунобиологические лекарственные средства; лекарственные средства, производимые
- 7. Биологические препараты Потенциал медицинского применения клеточных и генных биологических препаратов
- 8. Определение понятия «биологическое ЛС»
- 9. Чем отличаются биопрепараты от других ЛС? Высоким молекулярным весом Сложностью
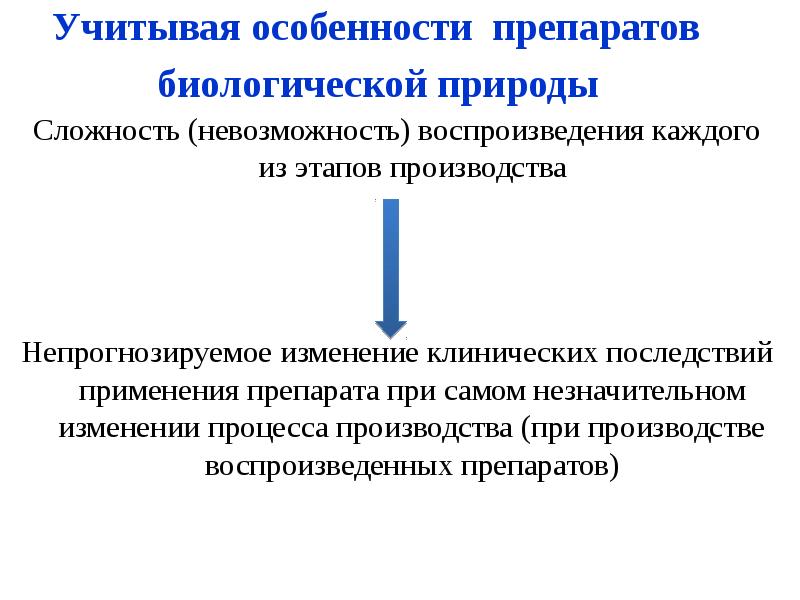
- 10. Учитывая особенности препаратов биологической природы Сложность (невозможность) воспроизведения каждого из
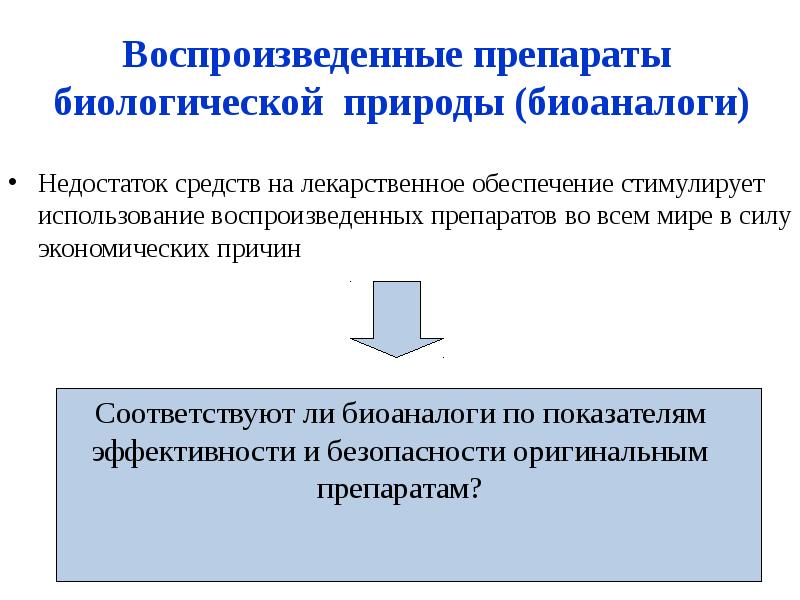
- 11. Недостаток средств на лекарственное обеспечение стимулирует использование воспроизведенных препаратов во всем
- 12. Биоаналог = дженерик? «Биоаналог - это биологическое лекарственное средство, схожее с
- 13. Какова законодательная основа регуляции обращения воспроизведенных лекарственных средств в РФ?
- 14. Утвержден Приказом Министерства Здравоохранения и социального развития РФ от 30.10.06. №736
- 15. АДМИНИСТРАТИВНЫЙ РЕГЛАМЕНТ от 30.10.06. №736 «…В том случае, если отличия
- 16. Для прохождения ускоренной процедуры рассмотрения документов и принятия решения о государственной
- 17. 1) заявление о государственной регистрации ЛС; 2) квитанцию об осуществлении платы
- 18. Терапевтическая эквивалентность Лекарственный препарат терапевтически эквивалентен другому препарату, если он содержит
- 19. Подтверждение терапевтической эквивалентности:
- 20. Примеры отзывов биоаналогов с рынка 1996 г, рекомбинантный человеческий интерферон альфа
- 21. Учитывая вышесказанные аспекты в европейском и американском законодательстве предусмотрены особые требования
- 22. Регуляторные органы в ЕС (ЕМЕА) и США (FDA) признают, что биоаналоги
- 23. Появление Директив, описывающих регистрацию биоаналогов в ЕС: Появление Директив, описывающих регистрацию
- 24. Directive 2004/27/EC – Article 10.4 (Определение): Directive 2004/27/EC – Article 10.4
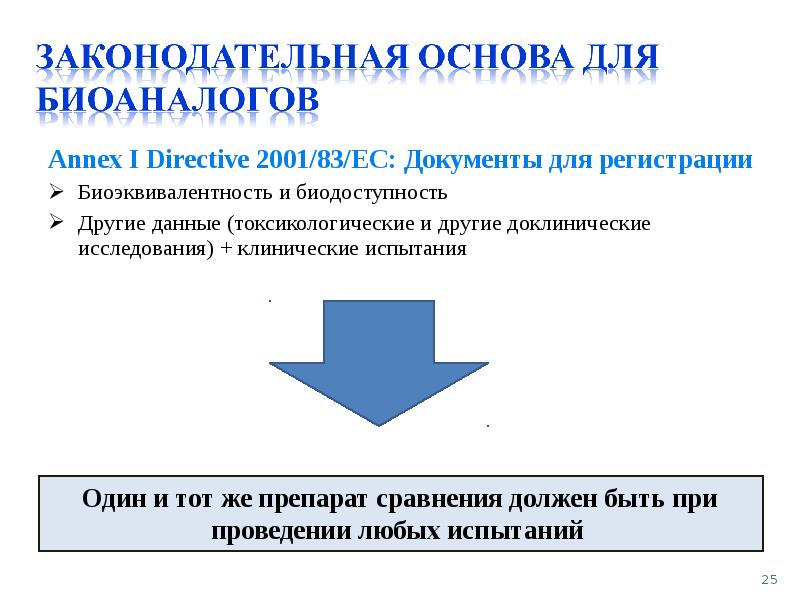
- 25. Annex I Directive 2001/83/EC: Документы для регистрации Annex I Directive
- 26. Процедура центральной регистрации (Centralized procedure) для всех биопрепаратов и их аналогов
- 28. EMEA не гарантирует взаимозаменяемость биологических лекарственных препаратов EMEA не гарантирует
- 29. Обзор взаимозаменяемости биологических лекарственных средств в различных странах
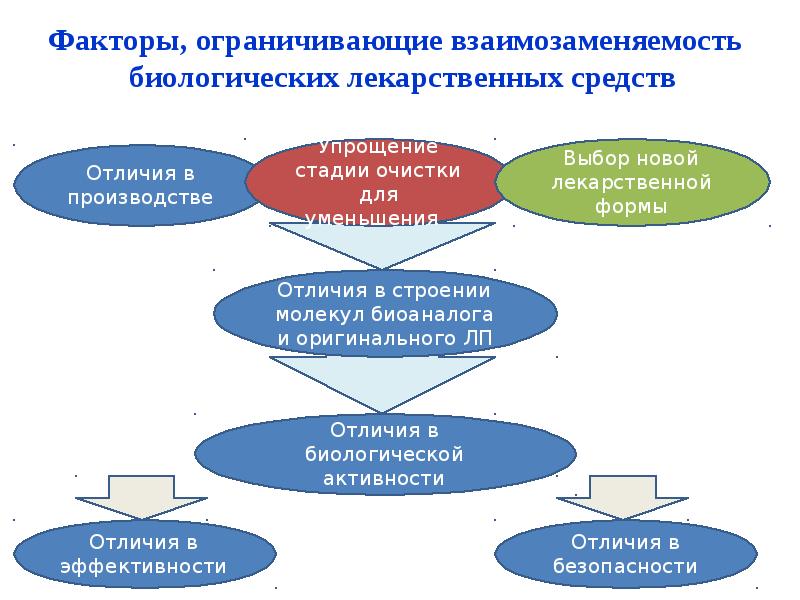
- 30. Факторы, ограничивающие взаимозаменяемость биологических лекарственных средств
- 31. Регулирование взаимозаменяемости биологических лекарственных средств в Российском законодательстве При отпуске препарата
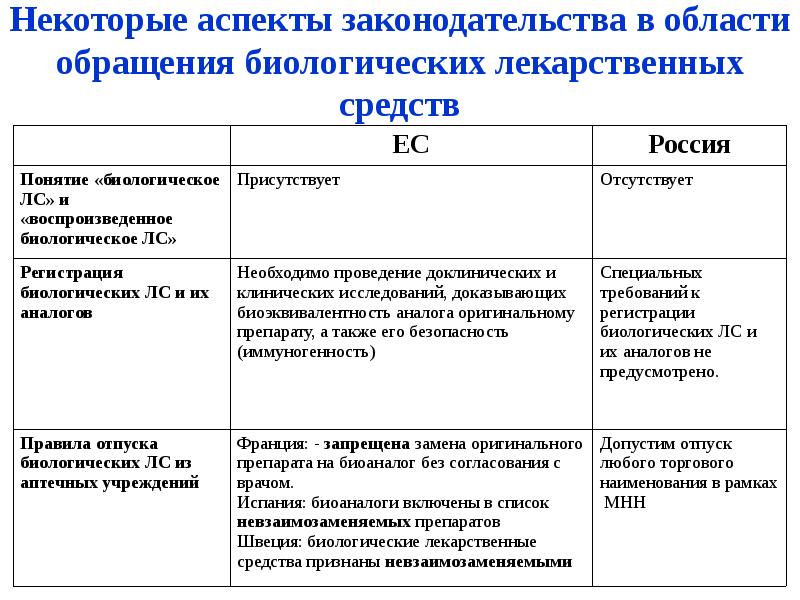
- 32. Некоторые аспекты законодательства в области обращения биологических лекарственных средств
- 33. Выводы: Гармонизация российского законодательства в области обращения биологических ЛС с законодательством
- 34. Существующие аспекты регулирования обращения препаратов биологической природы в РФ не гарантируют
- 37. Скачать презентацию






























Слайды и текст этой презентации
Презентация на тему Актуальные вопросы регулирования обращения биологических препаратов доступна для скачивания ниже:
Похожие презентации