единая природа химической связи презентация
Содержание
- 2. Цель: дать представление о причинах единства всех типов химической связи
- 3. Что такое химическая связь? Какова природа химической связи?
- 4. Любая химическая связь образуется только тогда, когда сближение частиц приводит к
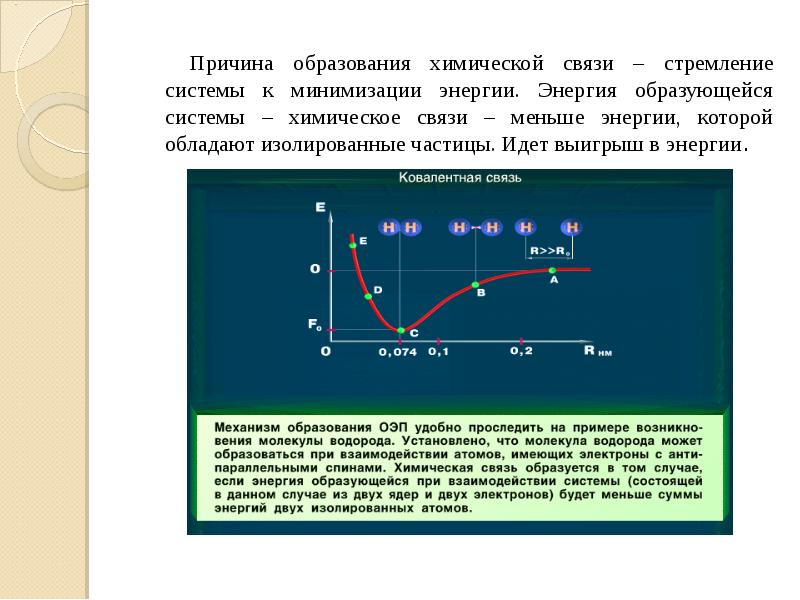
- 5. Причина образования химической связи – стремление системы к минимизации энергии. Энергия
- 8. Важнейшим фактором характеристики атома является его электроотрицательность
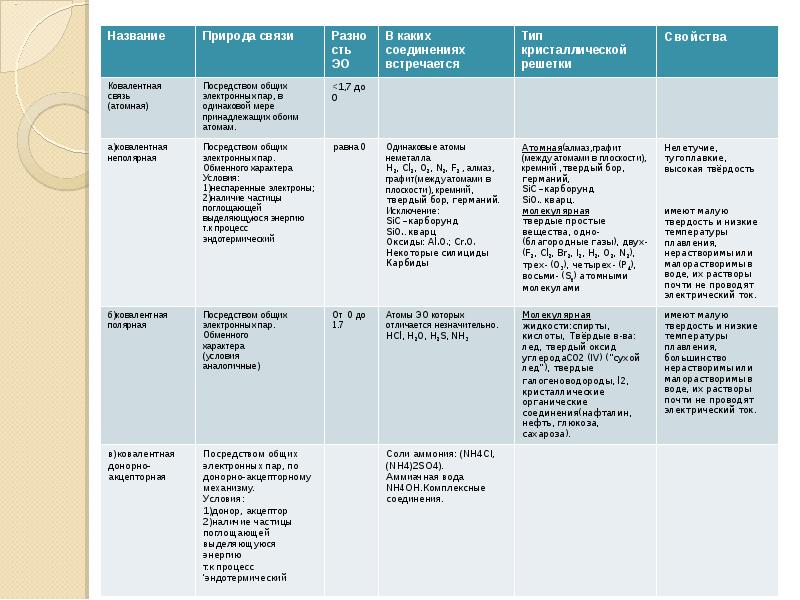
- 9. Определение типа связи(по ЭО): Равная ЭО – ковалентная неполярная; Разность ЭО
- 10. Кристаллические решётки веществ – это упорядоченное расположение частиц(атомов, молекул, ионов) в
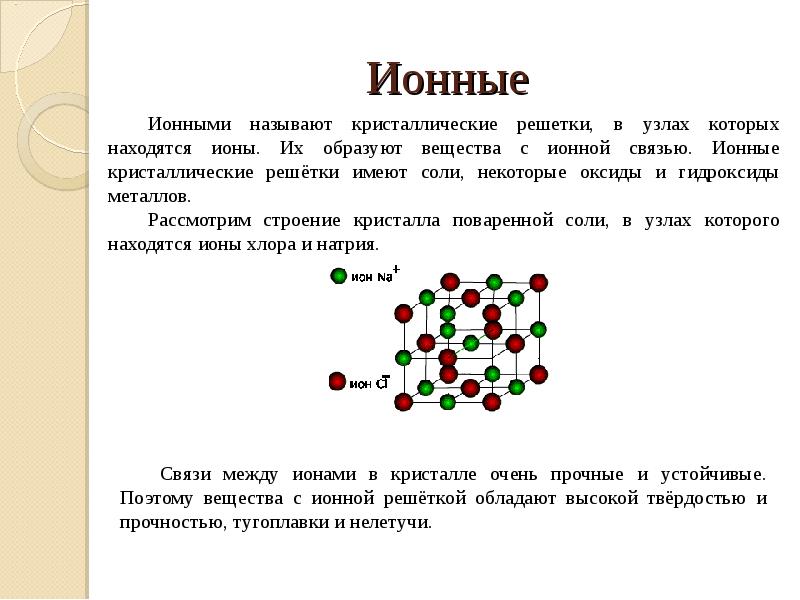
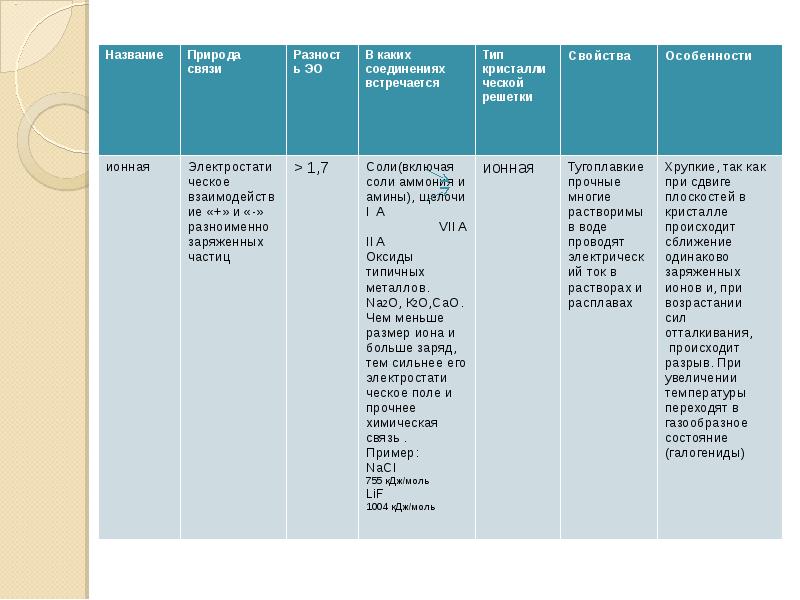
- 11. Ионные
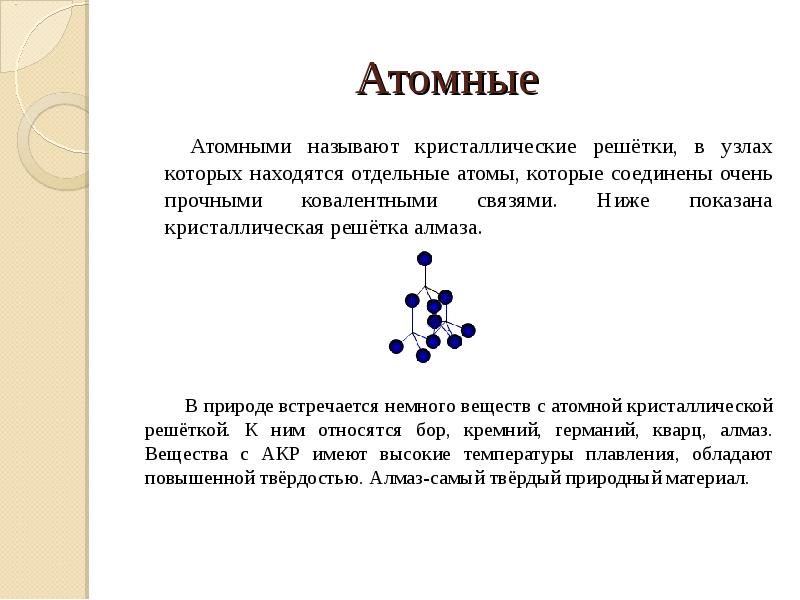
- 12. Атомные Атомными называют кристаллические решётки, в узлах которых находятся отдельные
- 13. Молекулярные Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы.
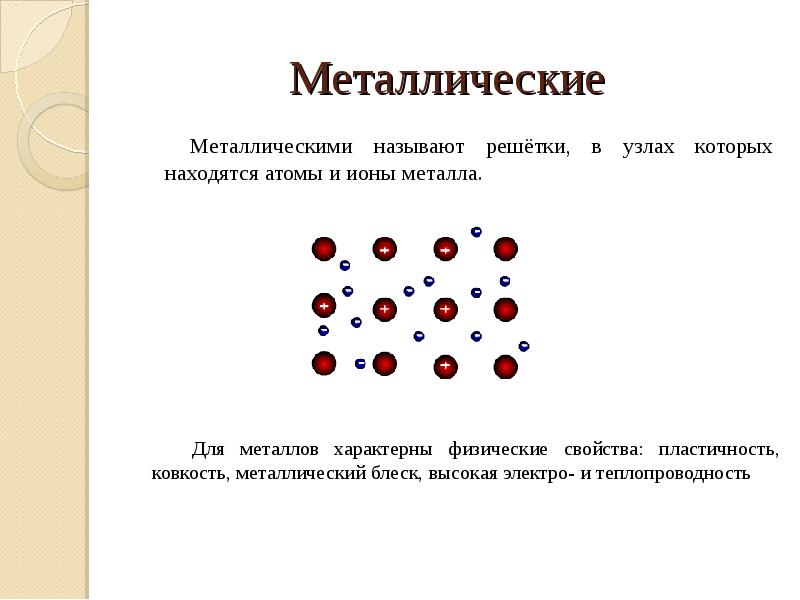
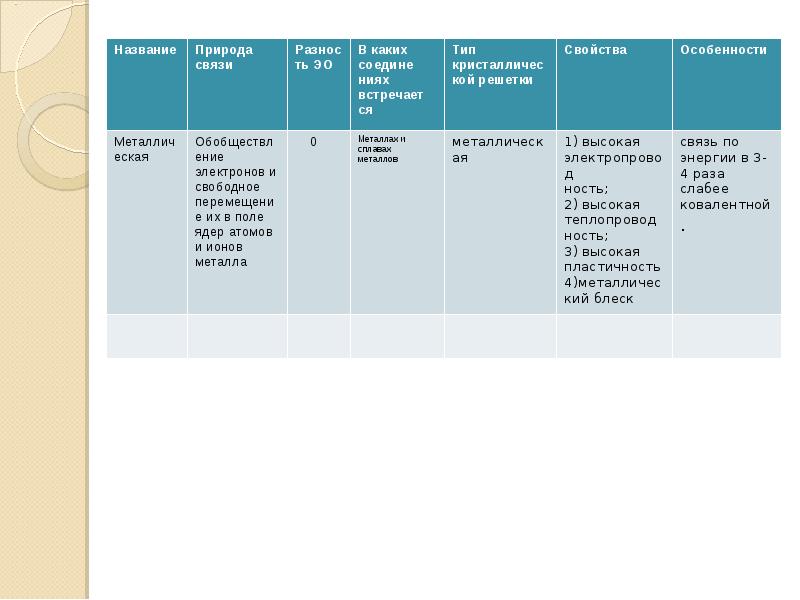
- 14. Металлические Металлическими называют решётки, в узлах которых находятся атомы и
- 19. Какова природа возникновения химической связи? Электронно-ядерное взаимодействие атомов, сопровождающееся выделением энергии
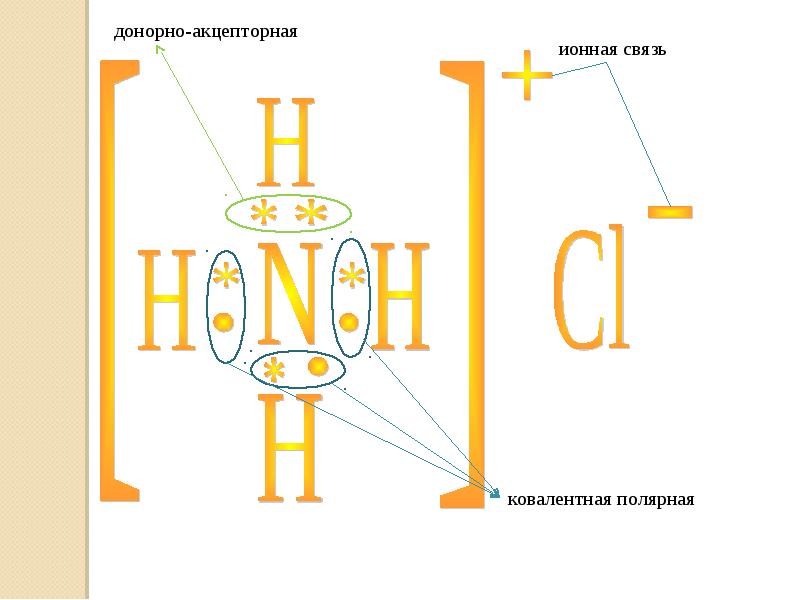
- 21. В зависимости от условий,возможен переход от одного вида связи в другой:
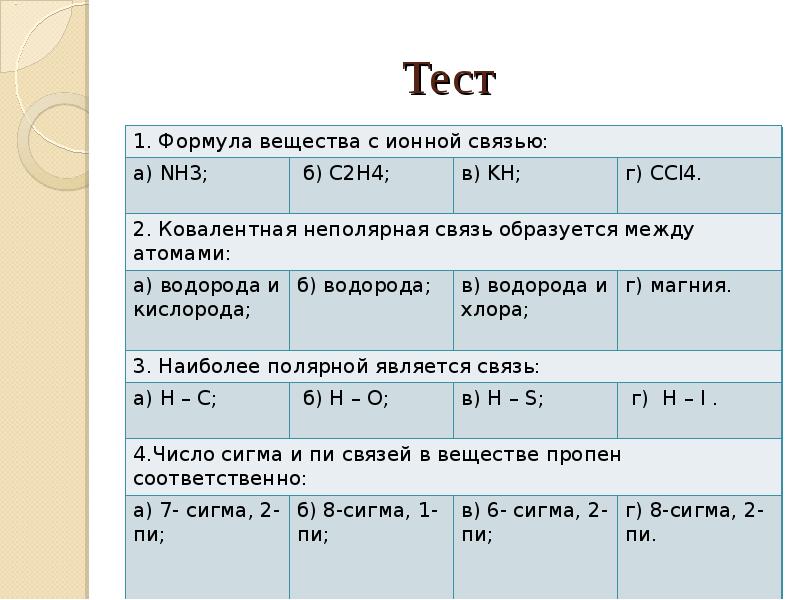
- 22. Тест
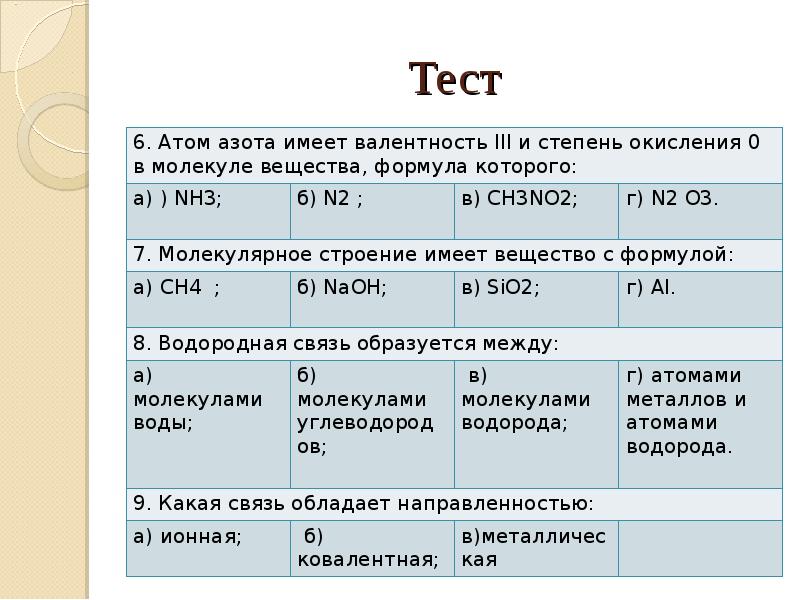
- 23. Тест
- 24. Самопроверка в б б б в
- 25. Рефлексия: что? какой? зачем? Домашнее задание: - повторить § 6; -
- 26. Учебно-методический комплект Габриелян О.С., Лысова Г.Г., . Общая химия.11класс., -М.: Дрофа,
- 27. Скачать презентацию
















Слайды и текст этой презентации
Похожие презентации





























