Модуль «Ферменты» Лекция 1 История развития энзимологии. Номенклатура, презентация
Содержание
- 2. Ферменты или энзимы (Е) – биокатализаторы, от латинского слова «fermentum» -
- 3. В 1783 г. итальянский ученый Спаланцани, изучая переваривание мяса у хищных
- 4. В 1814 г. русский ученый, К. Кирхгоф
- 5. В 1833 г. французские химики А. Пайен и Ж.
- 6. Луи Пастер высказал предположение, что
- 7. Ю. Либих и К. Бернар отстаивали химическую природу брожения, считая, что
- 8. В 1837 г. шведский химик Й.
- 9. В 1897 г. немецкие ученые Ганс и
- 10. После этого стало ясно, что в нем содержится смесь ферментов («зимаза»),
- 11. В 1926 г. американский биохимик Д.
- 12. В 1930 г., норвежец Д. Нортроп
- 13. С этого периода стало общепринятым утверждение, что все ферменты являются белками
- 14. Большинство ферментов белки Но есть ферменты небелковой природы. Н-р, рибозимы, состоящие
- 15. В 1961 г. в Москве на 5-ом биохимическом конгрессе Международная комиссия
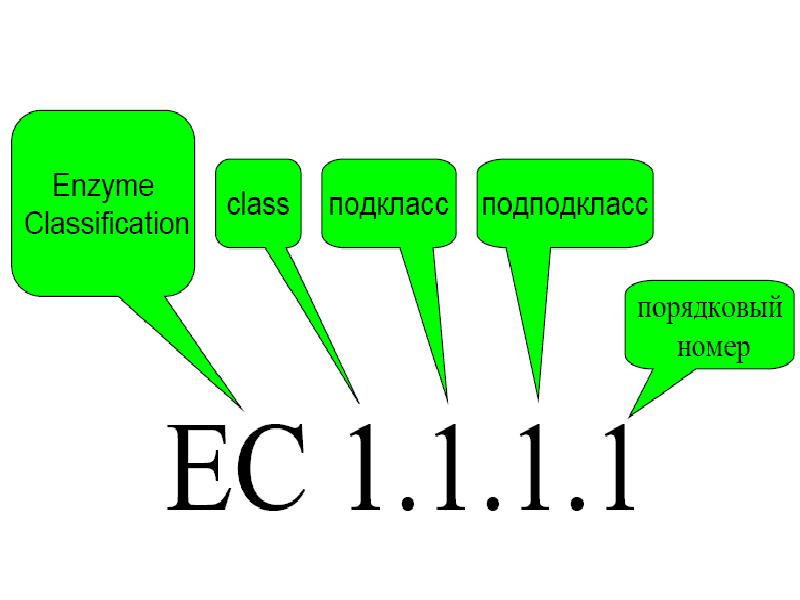
- 16. Номенклатура ферментов Каждый фермент имеет два названия:
- 17. 1 тип названия находится в зависимости от субстрата, на который действует
- 18. Некоторые ферменты имеют специфическое название: например, пепсин, трипсин и т.д.
- 19. 2 тип включает в себя название субстрата + название реакции, катализируемой
- 20. Классификация ферментов Все ферменты разделены на 6 классов, каждый
- 21. Для каждого фермента существует специальный шифр, состоящий из 4-х цифр:
- 23. Например: 1.1.1.1. – алкогольдегидрогеназа
- 24. Классы ферментов: I. Оксидоредуктазы II. Трансферазы III. Гидролазы IV. Лиазы V.
- 25. I. Оксидоредуктазы Катализируют окислительно-восстановительные реакции с участием двух субстратов
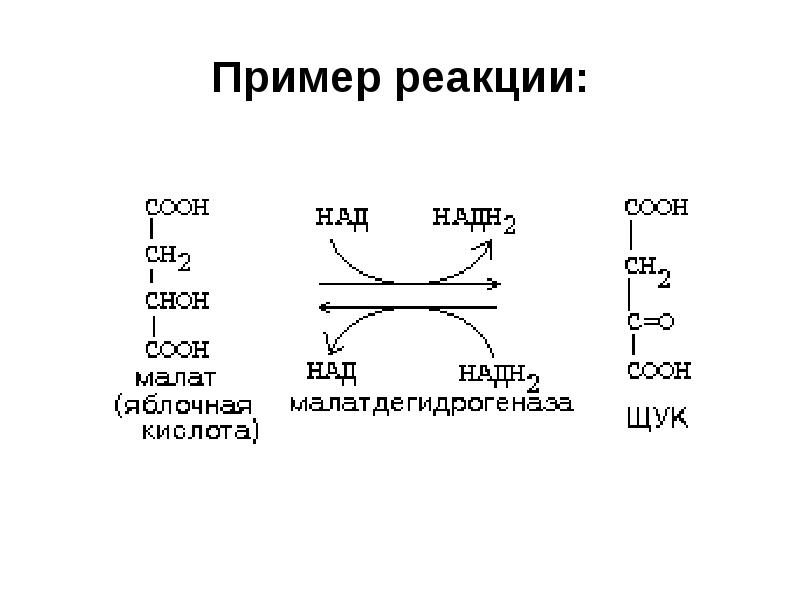
- 26. В классе 17 подклассов. Например: 1. Дегидрогеназы
- 27. Пример реакции:
- 28. 2. Оксидазы Акцептором
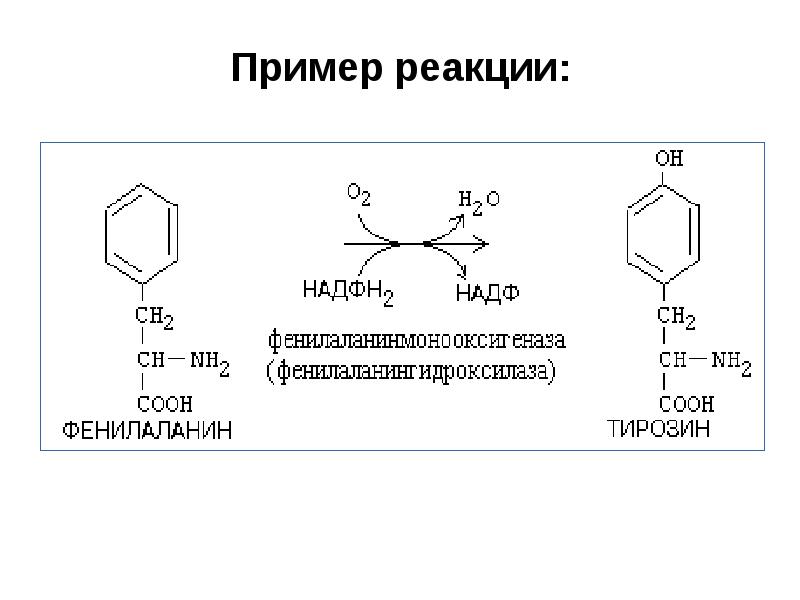
- 29. 3. Оксигеназы (гидроксилазы) Атом кислорода из
- 30. Пример реакции:
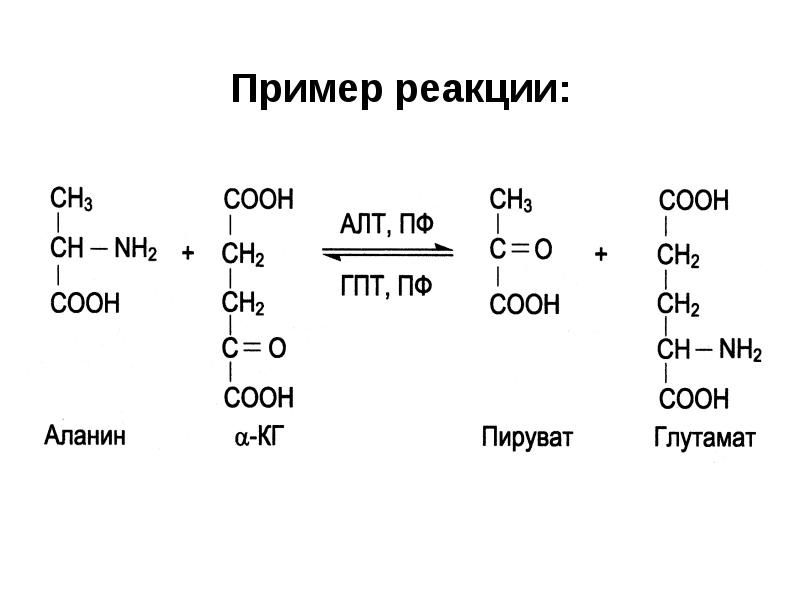
- 31. II. Трансферазы Катализируют перенос функциональных групп от одного соединения к другому.
- 32. Пример реакции:
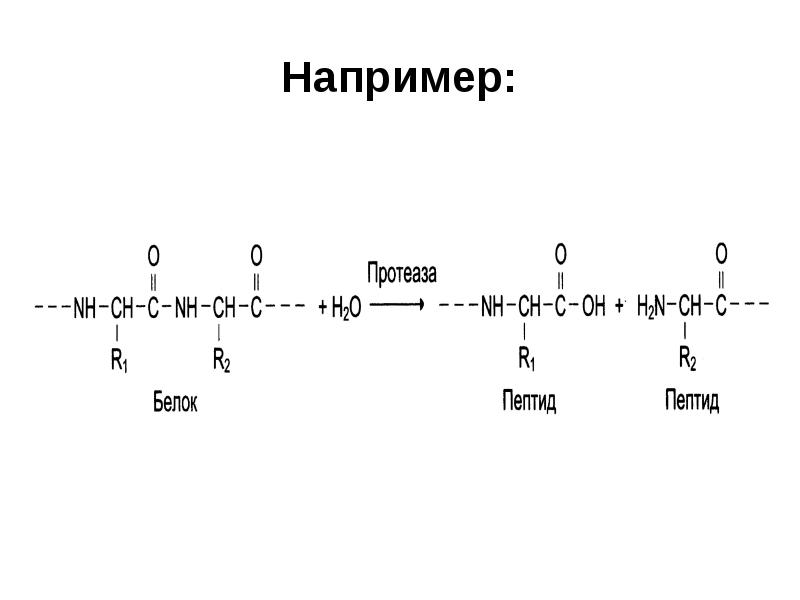
- 33. III. Гидролазы Катализилируют реакции гидролиза (расщепление ковалентных связей с присоединением молекулы воды
- 34. Например:
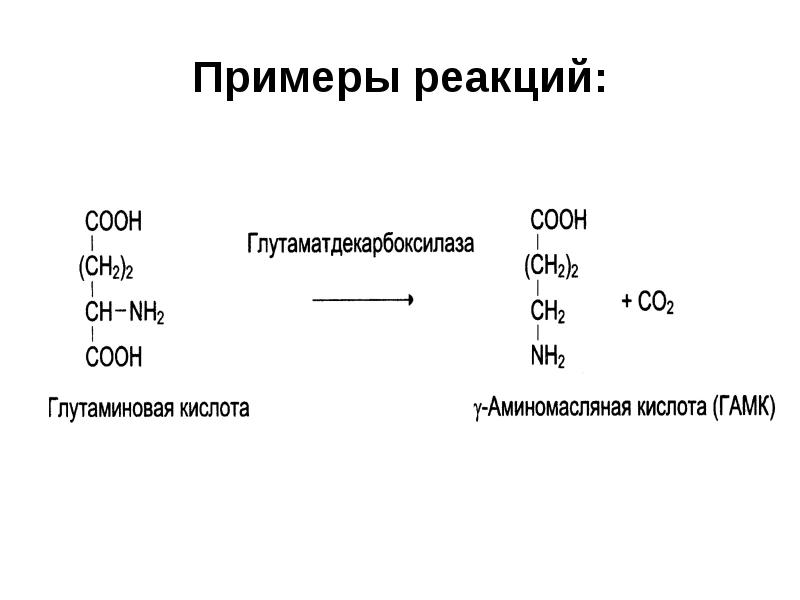
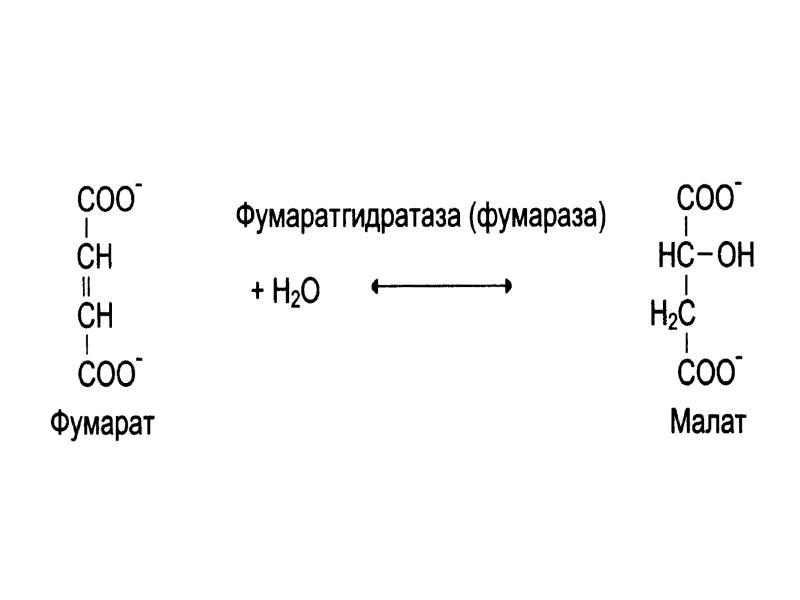
- 35. IV. Лиазы Катализируют отщепление от субстратов определенные группы (СО2, Н2О, NH2, SH2
- 36. Примеры реакций:
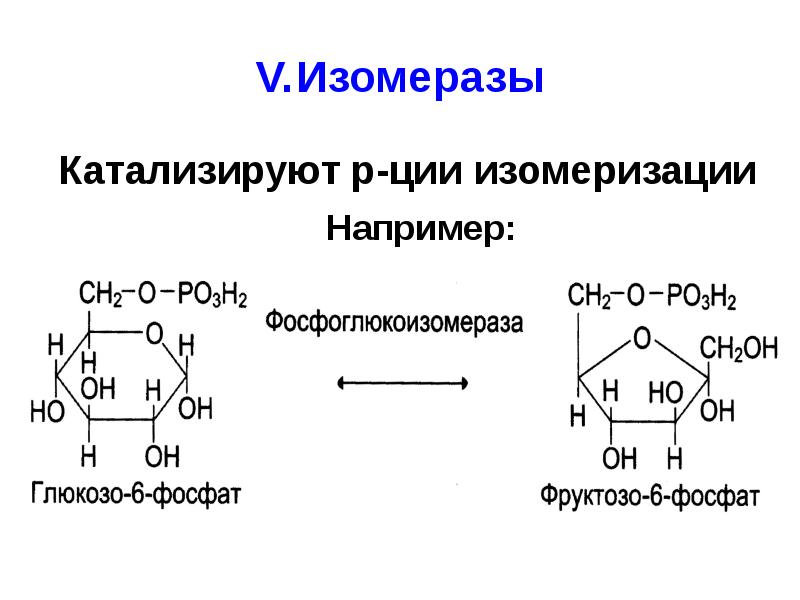
- 38. V. Изомеразы Катализируют р-ции изомеризации Например:
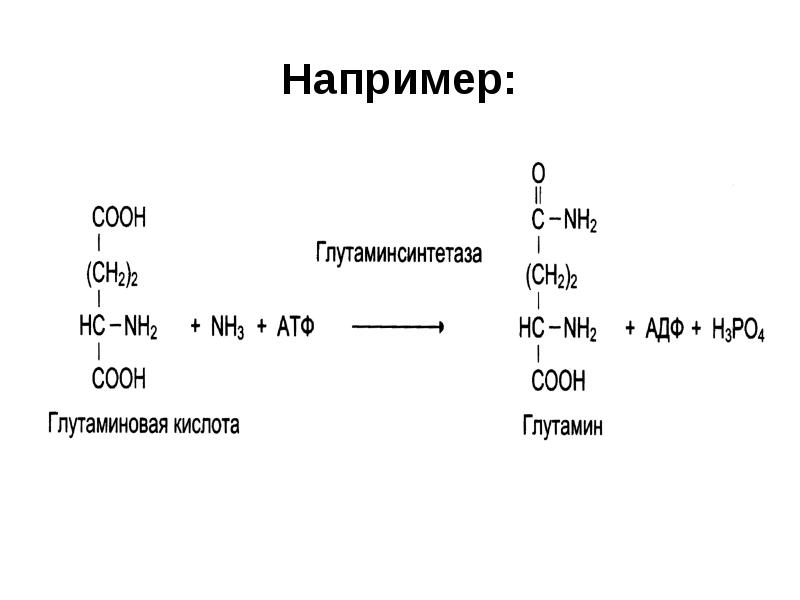
- 39. VI. Лигазы (синтетазы) Катализируют реакции синтеза различных веществ при участии
- 40. Например:
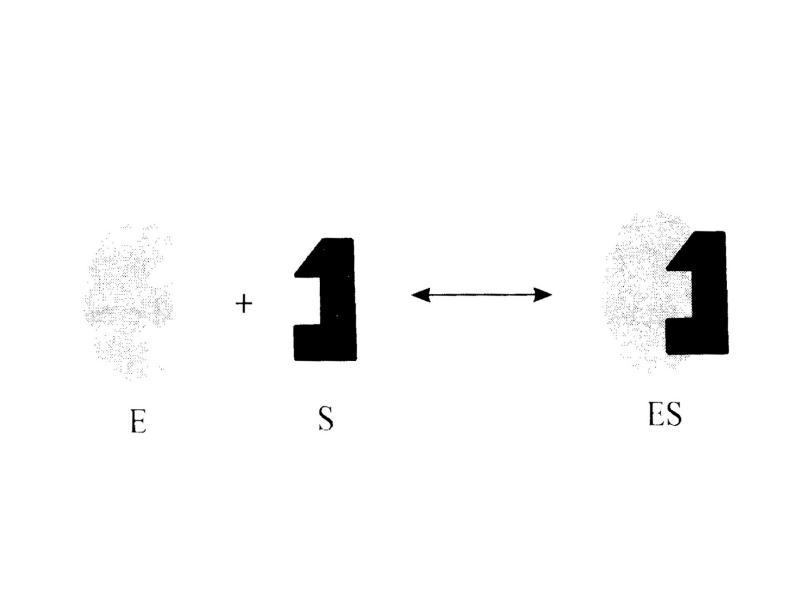
- 41. Структура ферментов Простые ферменты состоят только из белка (пепсин, трипсин, папаин,
- 42. Если константа диссоциации (Kd) комплекса «белок-кофактор» очень мала и обе части
- 43. Другие термины небелковой части: Кофермент (коэнзим) - часть некоторых ферментов, которая
- 44. Коферменты: производные витаминов; гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы,
- 45. Убихинон (кофермент Q), участвующий в переносе ē и Н+ в дыхательной
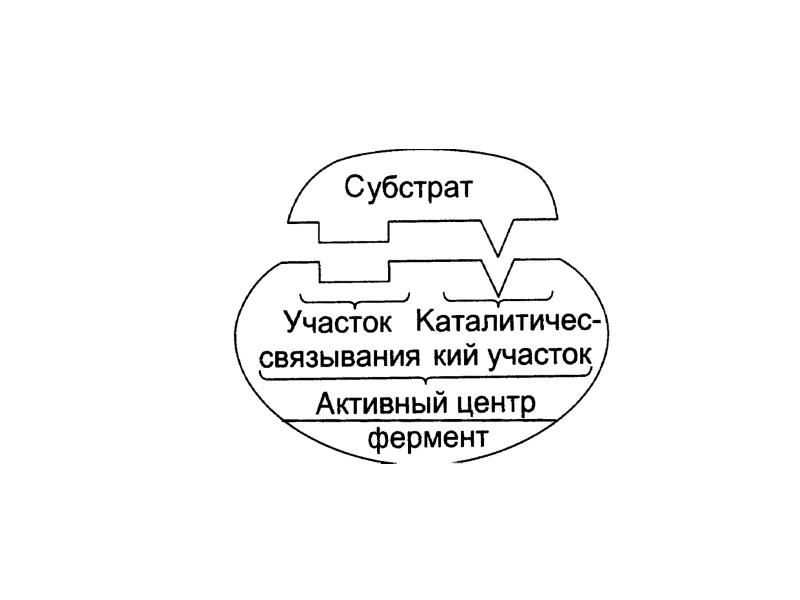
- 46. Активный центр фермента (А) А – участок ответственный за присоединение субстрата
- 47. 1. Каталитический центр – участок, непосредственно вступающий в химическое взаимодействие с
- 48. Простой фермент: 1-каталитический участок, 2 - контактный
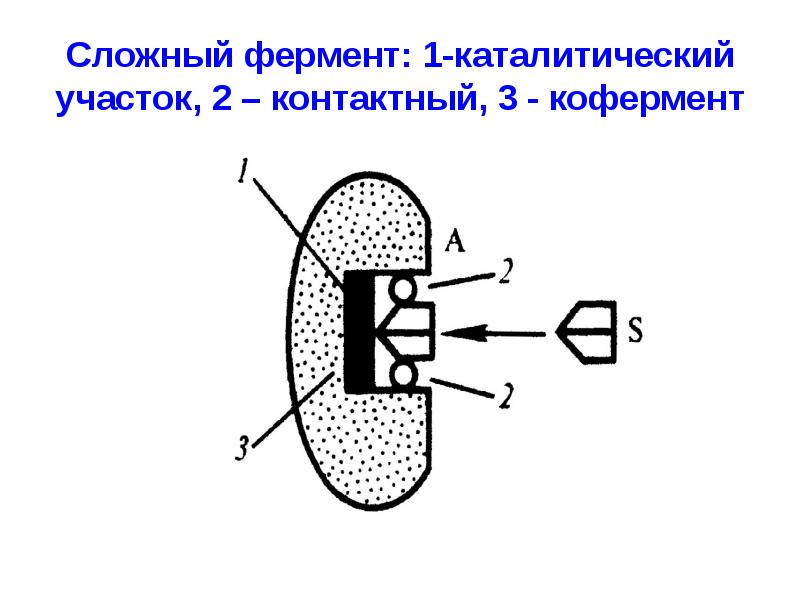
- 49. Сложный фермент: 1-каталитический участок, 2 – контактный, 3 - кофермент
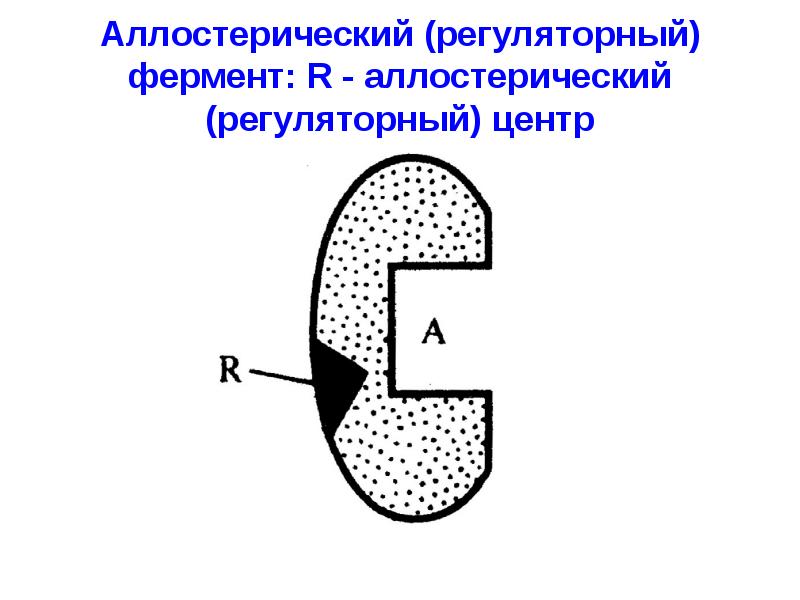
- 50. Аллостерический (регуляторный) фермент: R - аллостерический (регуляторный) центр
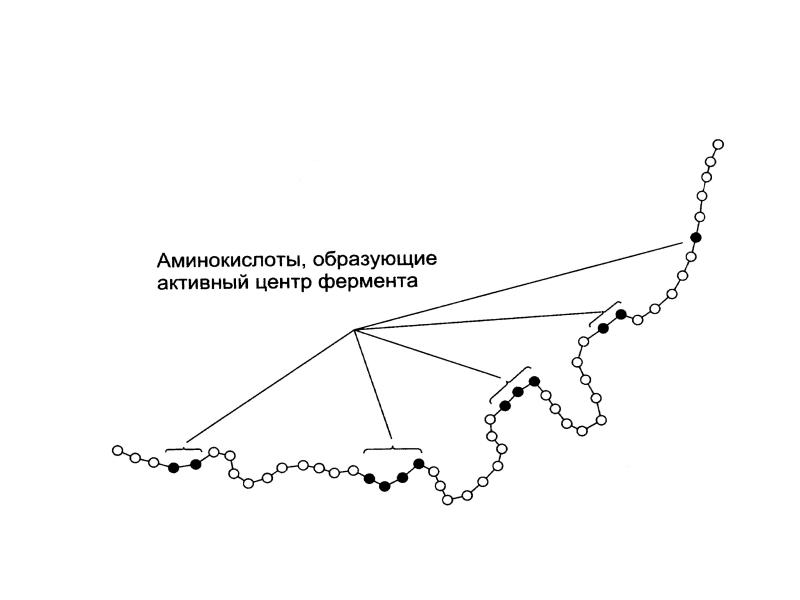
- 51. В активном центре обычно 12-16 аминокислотных остатков АМК А
- 55. У сложных ферментов главную роль контактных и каталитических центров активного центра
- 56. А может содержать различные функциональные группы: NH2 (лизина, гуанидиновых групп аргинина,
- 57. имидазольные гистидина, тиоэфирные метионина, фенольные группы тирозина, гидрофобные
- 58. Взаимодействие субстрата с активным центром фермента
- 59. Свойства ферментов. Общность и отличия их от неорганических катализаторов
- 60. Сходство с неорганическими катализаторами : Повышают скорость химической реакции, но
- 61. Отличия: Ферменты обладают намного большей активностью Неорганические катализаторы активны в
- 62. Ферменты обладают специфичностью, т.е. способностью катализировать строго определенные реакции, в которые
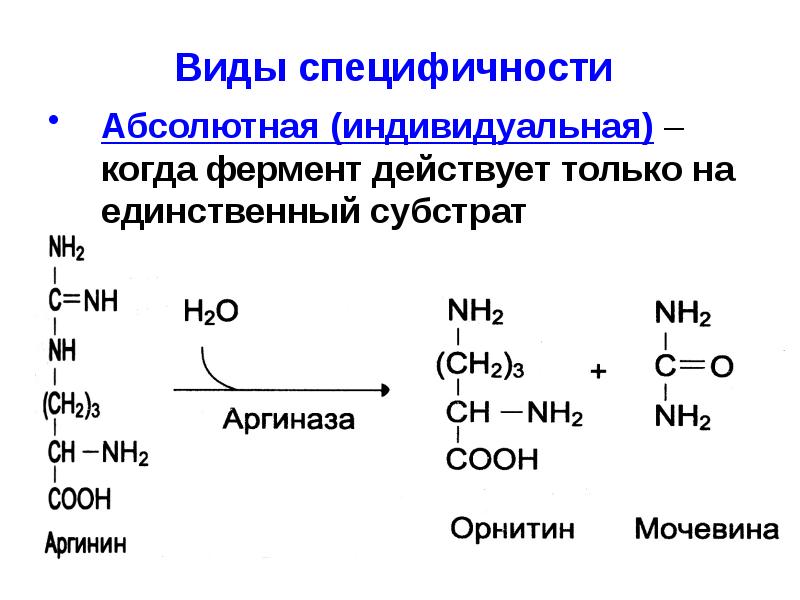
- 63. Виды специфичности Абсолютная (индивидуальная) – когда фермент действует только на
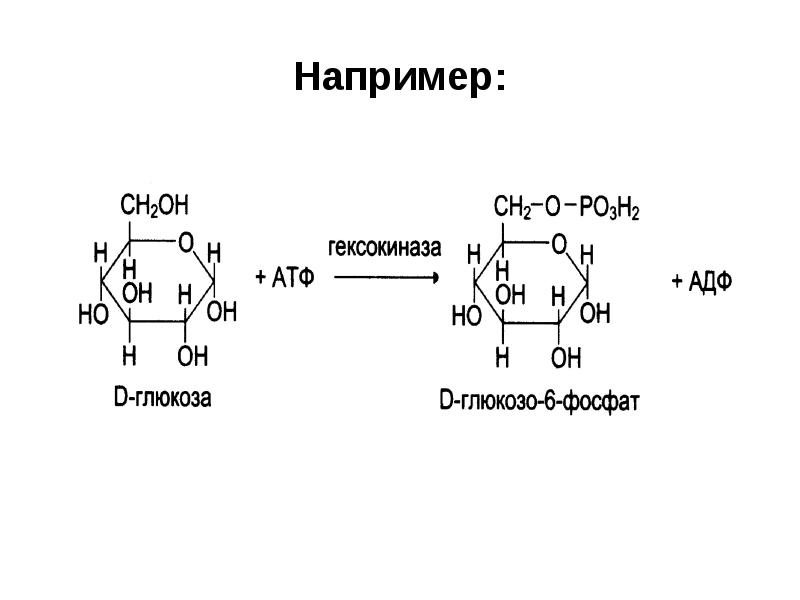
- 64. Групповая (относительная) – когда фермент действует на группу субстратов или на
- 65. Стереохимическая – когда фермент действует только на
- 66. Выделяют: Стереоспецифичность к одному из оптических стереоизомеров: - к
- 67. Например:
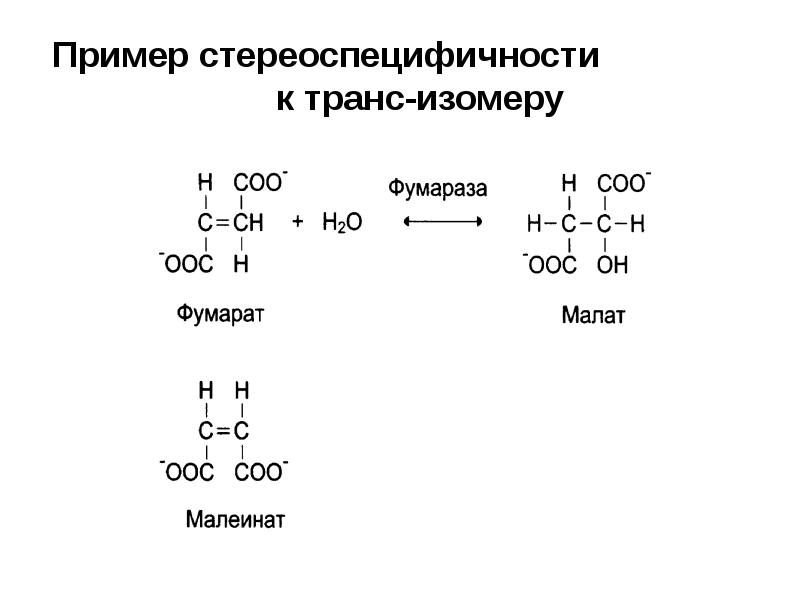
- 68. Стереоспецифичность к одному из геометрических
- 69. Пример стереоспецифичности к транс-изомеру
- 70. Различают две основные теории специфичности ферментов: «жесткого соответствия» «индуцированного соответствия»
- 71. 1-ая теория предложена Э. Фишером предусматривает наличие
- 73. 2-ую теорию предложил Кошленд По данной теории молекула фермента является гибкой,
- 74. Скачать презентацию
























































Слайды и текст этой презентации
Скачать презентацию на тему Модуль «Ферменты»
Лекция 1
История развития энзимологии. Номенклатура, можно ниже:
Похожие презентации





























