Общая характеристика элементов VA-группы. Азот
Содержание
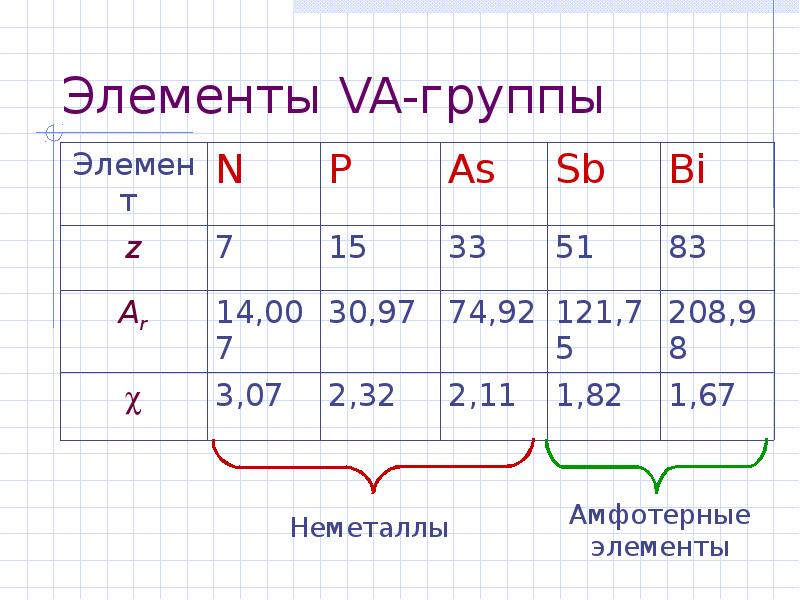
- 2. Элементы VA-группы
- 3. Элементы VА-группы Общая электронная формула: […] ns 2 (n–1)d 10np 3
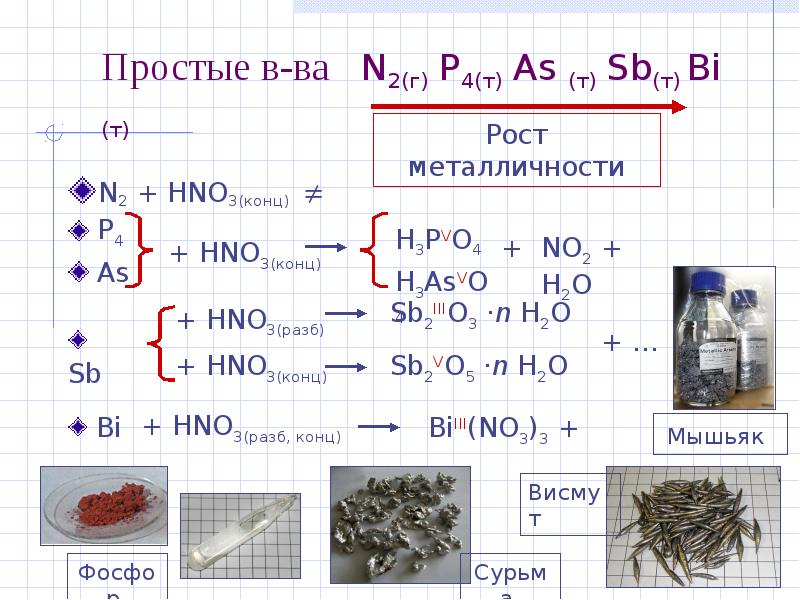
- 4. Простые в-ва N2(г) P4(т) As (т) Sb(т) Bi (т) N2
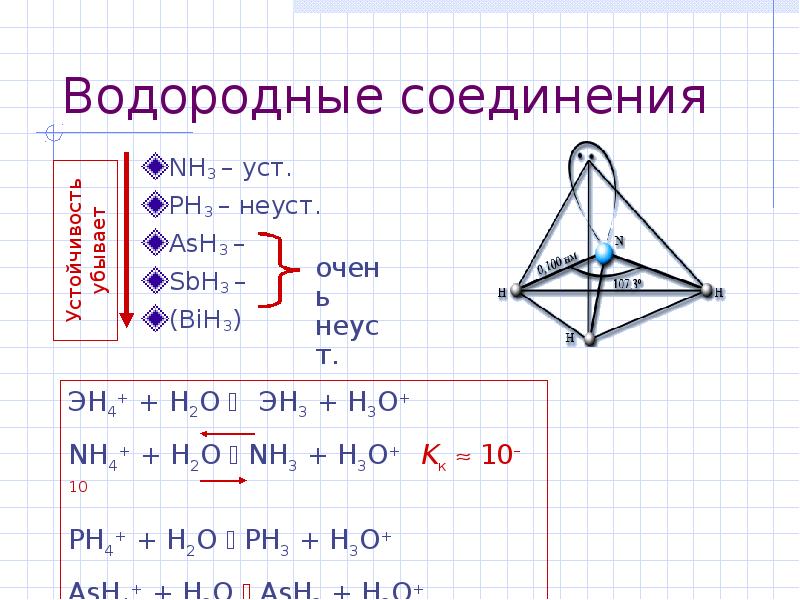
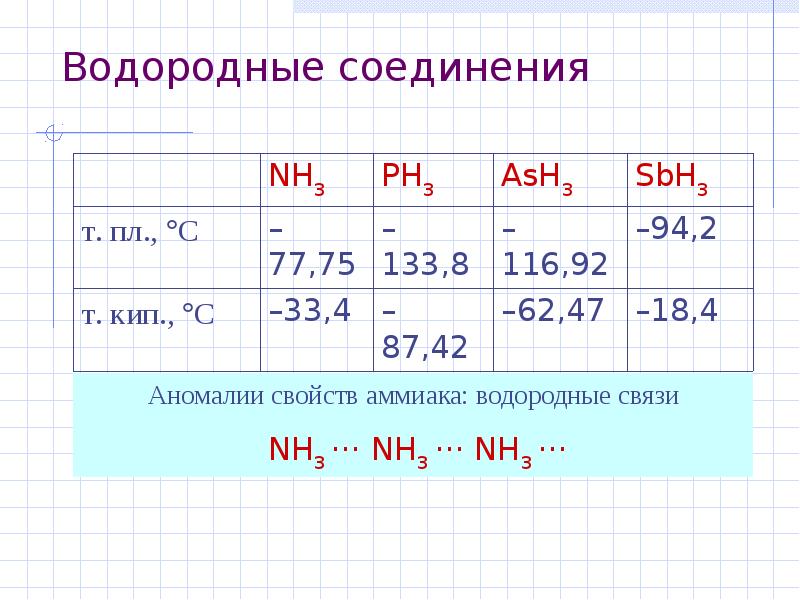
- 5. Водородные соединения NH3 – уст. PH3 – неуст. AsH3 –
- 6. Водородные соединения
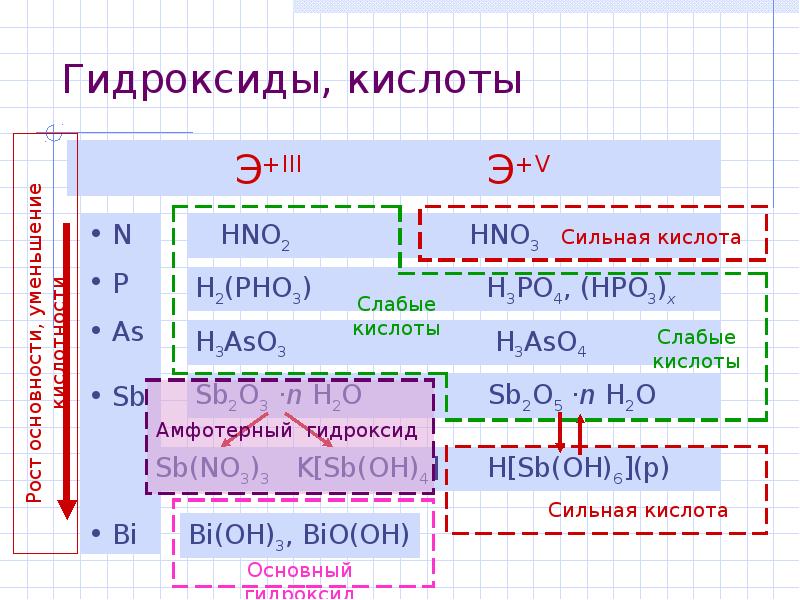
- 7. Гидроксиды, кислоты
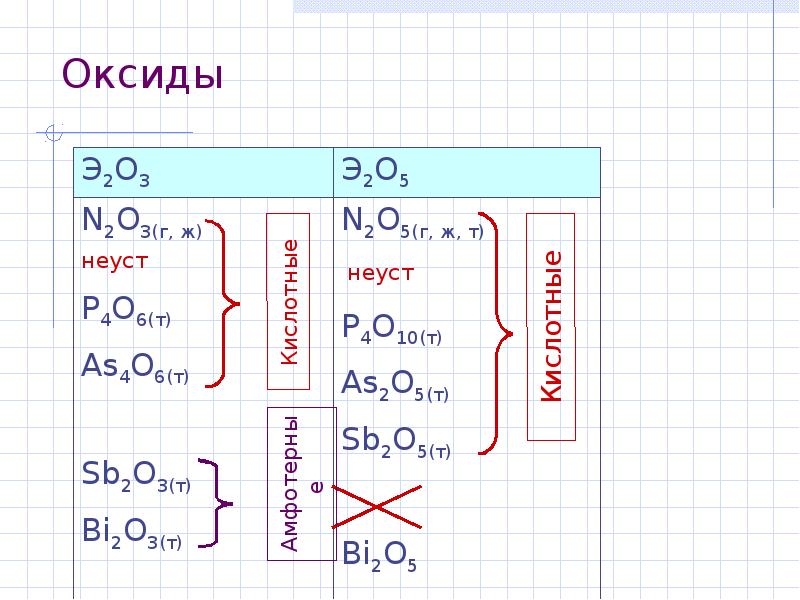
- 8. Оксиды
- 9. Степени окисления Ст.ок. +V: P, As, Sb N(+V), Bi(+V) –
- 10. Распространение в природе 12. P – 0,09 масс.% 16. N
- 11. Азот, фосфор Нитратин (чилийская селитра) NaNO3 Нитрокалит (индийская селитра) KNO3
- 12. Мышьяк, сурьма, висмут Реальгар As4S4 Аурипигмент As2S3 Арсенопирит FeAsS Тетраэдрит Cul2As4S13
- 13. История открытия элементов Азот: 1772 г., Д. Резерфорд, Г.Кавендиш, 1769-1771 гг.,
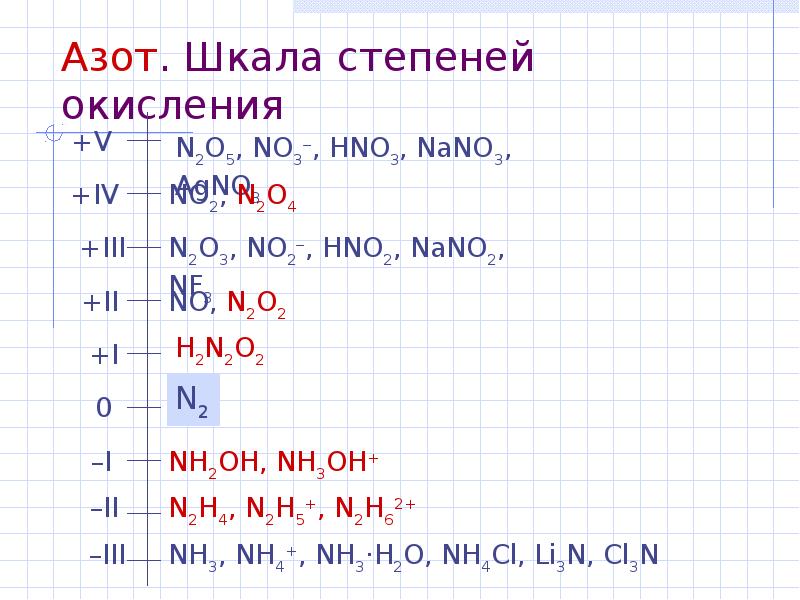
- 14. Азот. Шкала степеней окисления
- 15. Свойства азота N2 – бесцветный газ, без запаха и вкуса, т.пл.
- 16. Получение и применение азота В промышленности: фракционная дистилляция сжиженного воздуха (жидкий
- 17. Водородные соединения азота
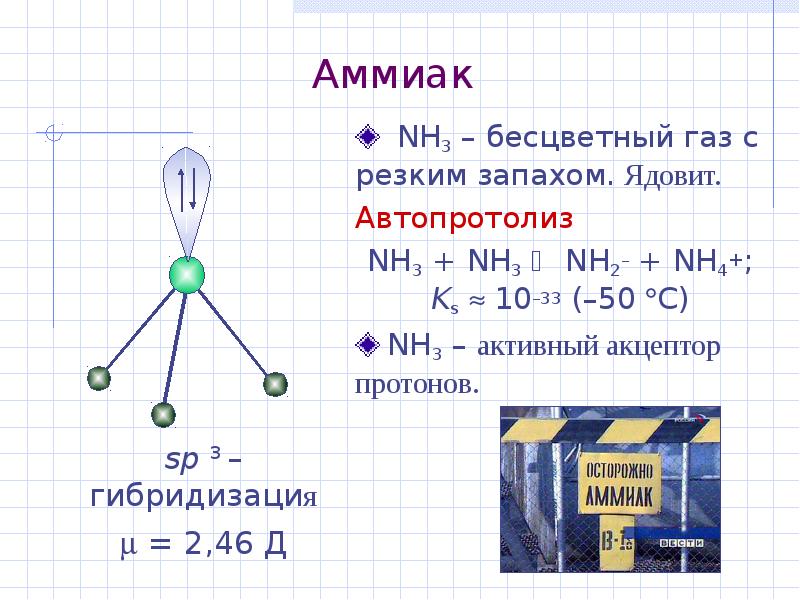
- 18. Аммиак NH3 – бесцветный газ с резким запахом. Ядовит. Автопротолиз NH3
- 19. Аммиак в водном растворе Высокая растворимость в воде (в 1 л
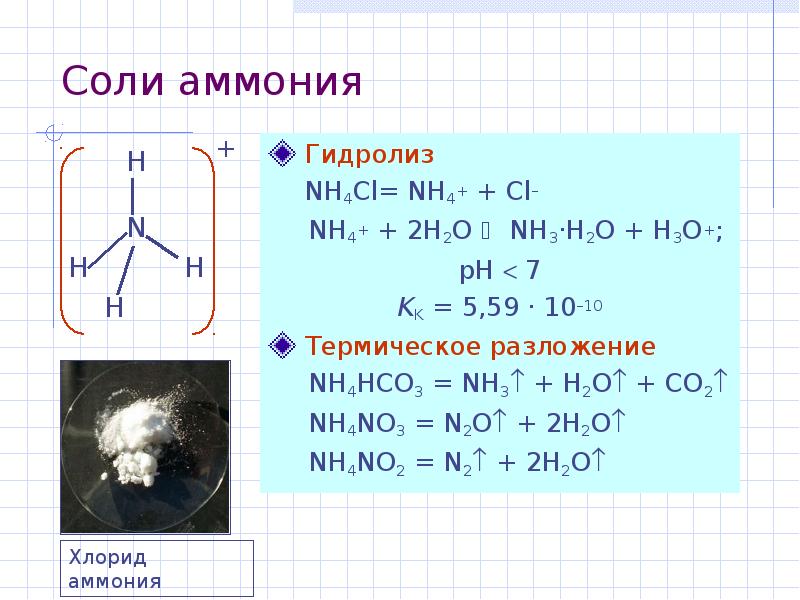
- 20. Соли аммония Гидролиз NH4Cl= NH4+ + Cl– NH4+ +
- 21. Окислительно-восстановительные свойства Горение 4 NH3 + 3O2 = 2N2 +
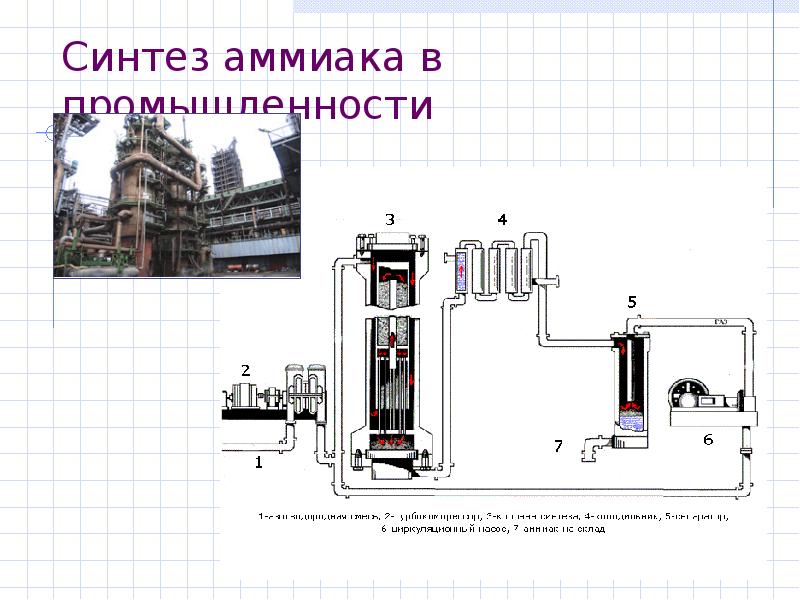
- 22. Получение аммиака В промышленности N2 + 3H2 2NH3 +
- 23. Синтез аммиака в промышленности
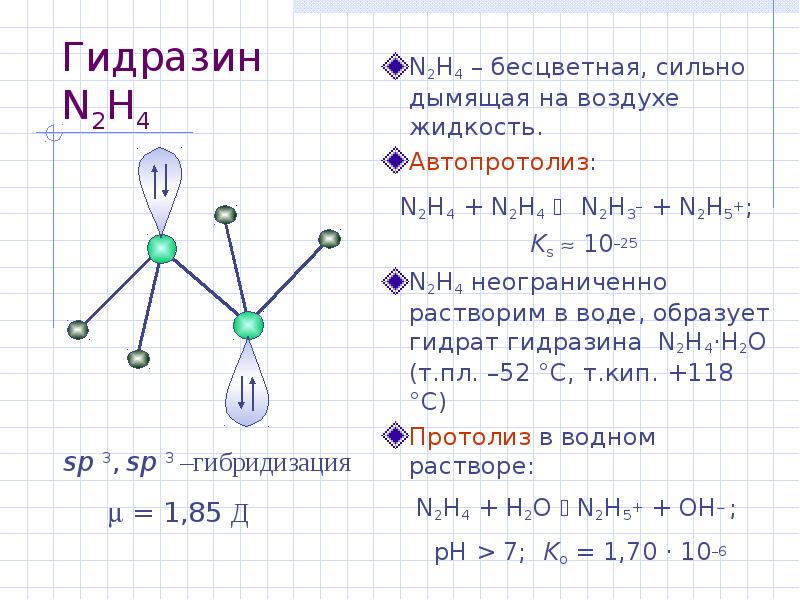
- 24. Гидразин N2H4 N2H4 – бесцветная, сильно дымящая на воздухе жидкость.
- 25. Протоноакцепторные свойства N2H4 – акцептор протонов (две неподеленные пары электронов): N2H4
- 26. Окислительно-восстановительные свойства гидразина Гидразин как восстановитель рН 7: N2H4·H2O +
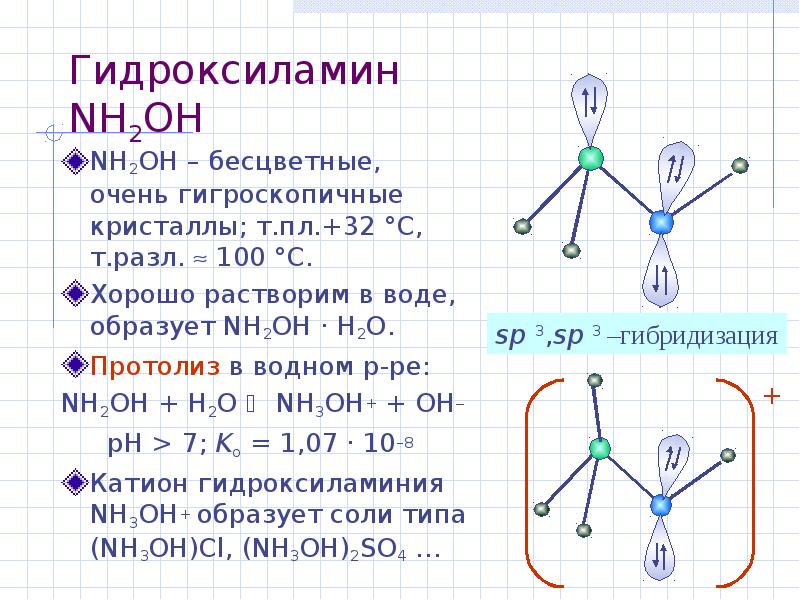
- 27. Гидроксиламин NH2OH NH2OH – бесцветные, очень гигроскопичные кристаллы; т.пл.+32 °С, т.разл.
- 28. Окислительно-восстановительные свойства гидроксиламина Гидроксиламин как восстановитель рН 7: 2(NH2OH·H2O) +
- 29. Азидоводород HN3 HN3 – бесцветная летучая жидкость, неограниченно растворимая в воде
- 30. Окислительно-восстановительные свойства Восстановительные свойства азидоводорода в растворе обусловлены легкостью превращения его
- 31. Скачать презентацию

![Элементы VА-группы
Общая электронная формула:
[…] ns 2 (n–1)d 10np Элементы VА-группы
Общая электронная формула:
[…] ns 2 (n–1)d 10np](/documents_2/5e7cc6c0e7fdc4cd00d2337c77b05001/img2.jpg)
















Слайды и текст этой презентации
Презентация на тему Общая характеристика элементов VA-группы. Азот доступна для скачивания ниже:
Похожие презентации