Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства
Содержание
- 2. Цель урока: 1. на основе положения металлов в ПСХЭ прийти к
- 3. МЕДЬ
- 4. ЖЕЛЕЗО
- 5. Металлы – это группа веществ с общими свойствами.
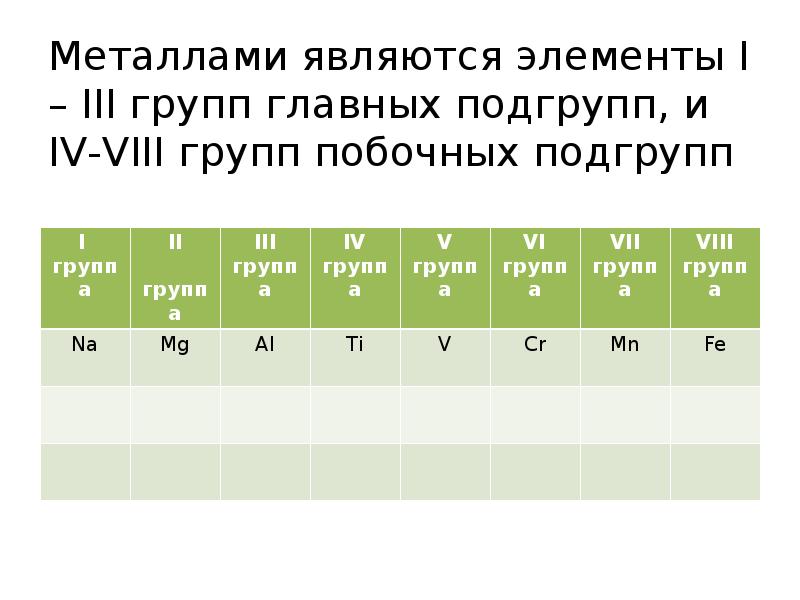
- 6. Металлами являются элементы I – III групп главных подгрупп, и IV-VIII
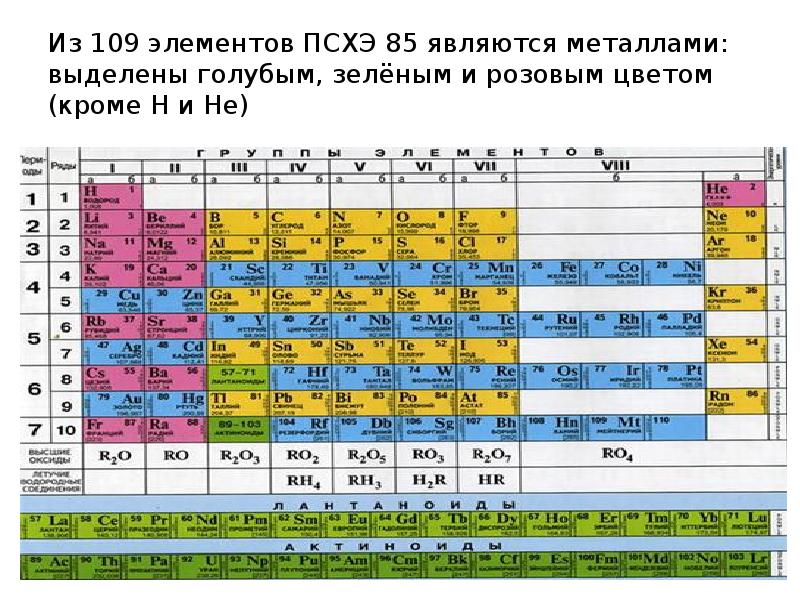
- 7. Из 109 элементов ПСХЭ 85 являются металлами: выделены голубым, зелёным и
- 8. Положение элемента в ПС отражает строение его атомов
- 9. Модель атома натрия
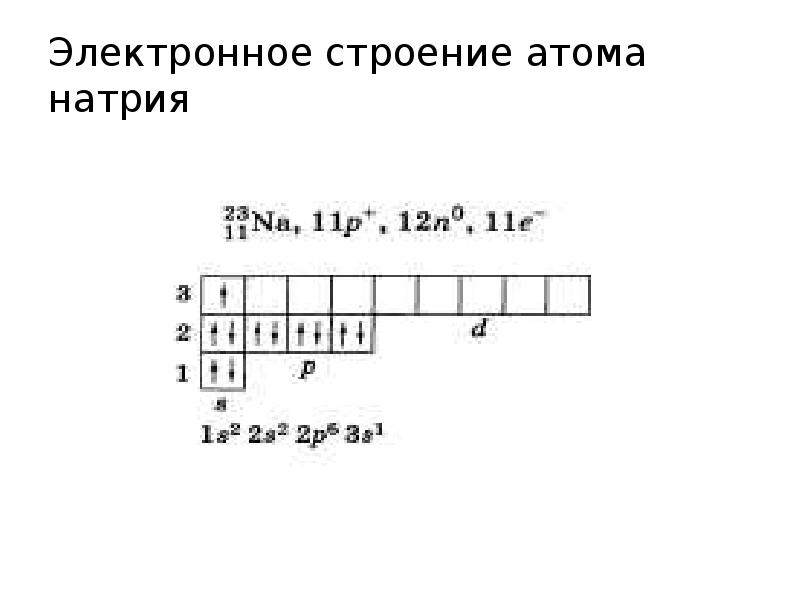
- 10. Электронное строение атома натрия
- 11. Задание 2. Составьте схему электронного строения атома алюминия и кальция в
- 12. Вывод: 1. Металлы– элементы, имеющие на внешнем энергетическом уровне 1-3 электрона,
- 13. Металлическая химическая связь характеризуется: - делокализацией связи, т.к. сравнительно небольшое количество
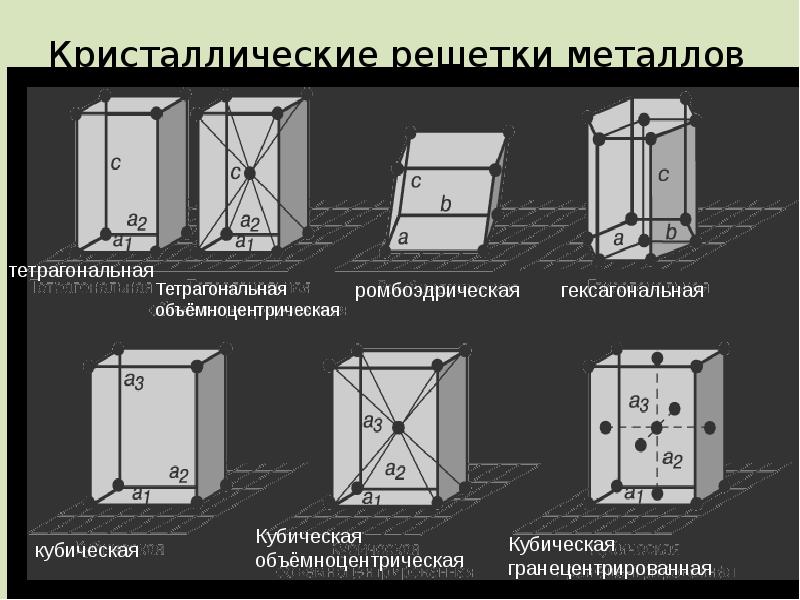
- 14. Кристаллические решетки металлов
- 15. Видеоинформация о кристаллах металлов
- 16. Свойства металлов определяются строением их атомов.
- 17. Проверьте усвоение знаний на уроке тестированием
- 18. Задания теста 2 и 3
- 19. Задания теста 4 и 5
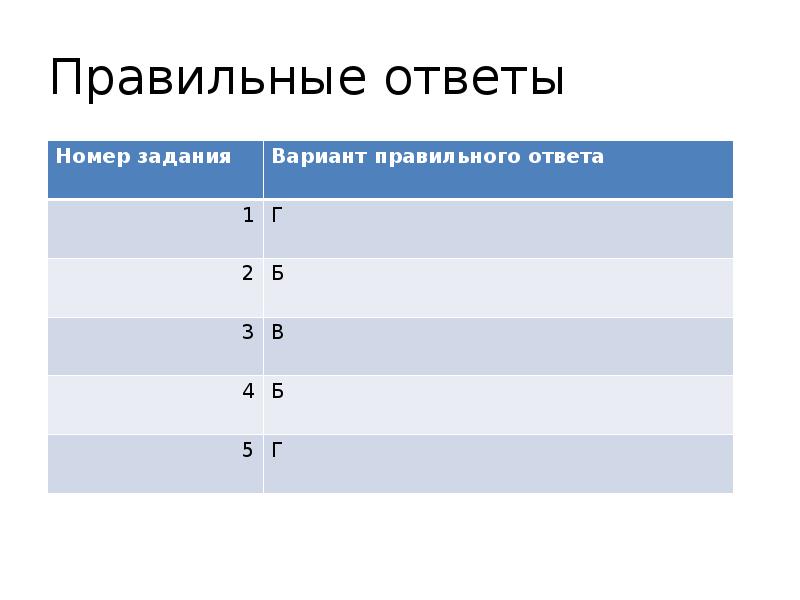
- 20. Правильные ответы
- 21. Скачать презентацию















Слайды и текст этой презентации
Презентация на тему Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства доступна для скачивания ниже:
Похожие презентации





























