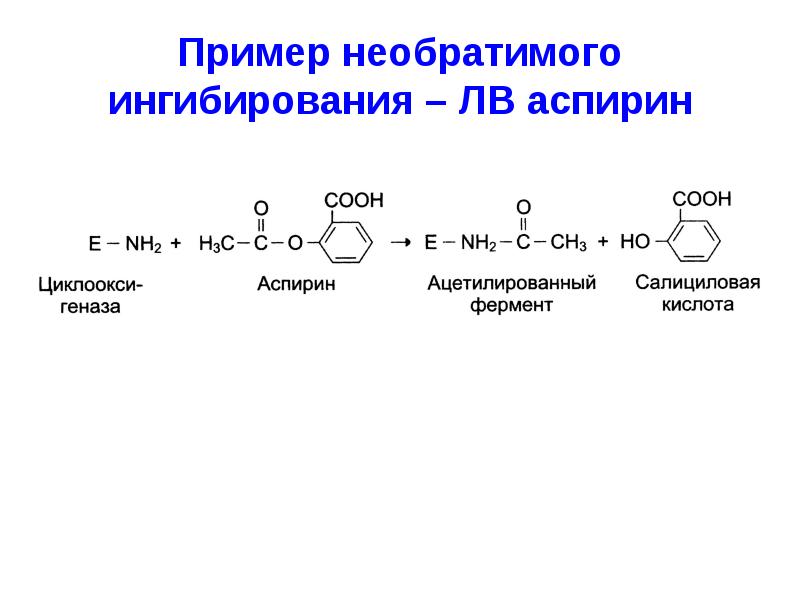
Пример необратимого ингибирования – ЛВ аспирин презентация
Содержание
- 2. Обратимое I связывается с E нековалентными связями → [IE] легко
- 3. Конкурентное (изостерическое) I - структурный аналог S I связывается
- 4. Пример конкурентного ингибирования – торможение сукцинатдегидрогеназы малоновой кислотой
- 5. Для устранения действия конкурентного I необходимо увеличить концентрацию S
- 6. Конкурентное ингибирование (1 – без I, 2 – с I) графически
- 7. Т.о., в присутствии конкурентного I Vmax реакции не меняется, а
- 8. На принципе конкурентного ингибирования основано действие многих ЛВ, например, группа ацетилхолинэстеразных
- 9. Присоединение конкурентного I прозерина в акт.ц. АХЭ
- 10. Необратимо действуют фосфоорганические препараты: армин, нибуфин, хлорофос, зарин, зоман, фосфорилируя каталитический
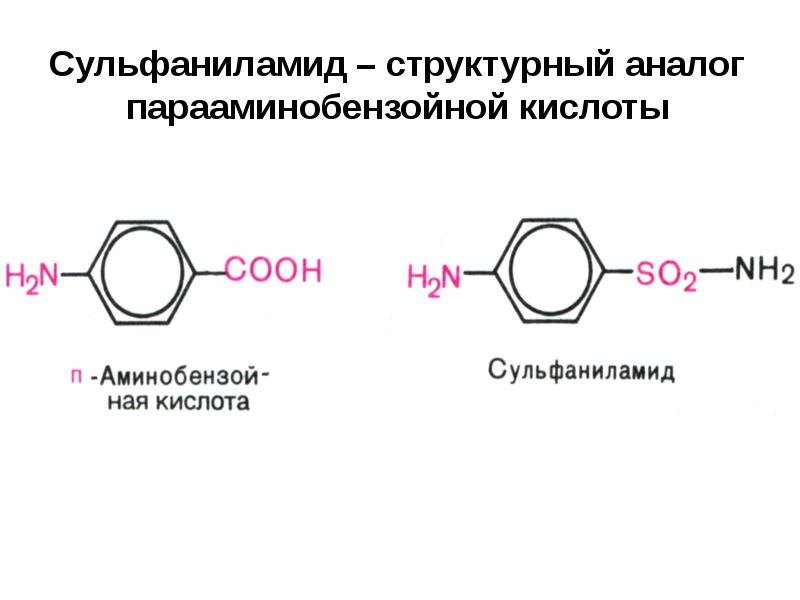
- 11. Сульфаниламид – структурный аналог парааминобензойной кислоты
- 12. Фолиевая кислота образуется в клетках бактерий, если они получают п-аминобензойную кислоту.
- 13. Эти Е могут использовать в качестве S сульфаниламиды → синтезируется не
- 14. → в бактериальных клетках возникает недостаток фолиевой кислоты, нарушаются все реакции,
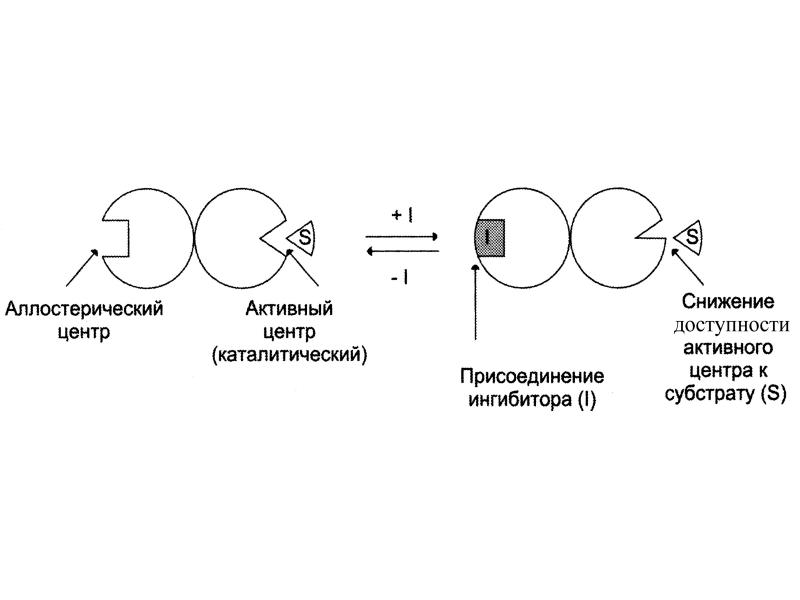
- 15. Неконкурентное (аллостерическое) Это такое ингибирование, при котором I взаимодействует с Е
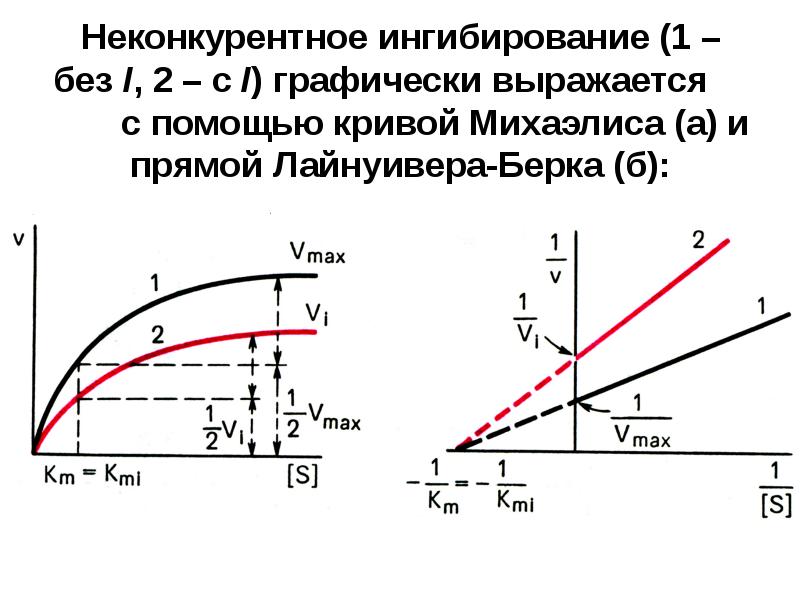
- 17. Неконкурентное ингибирование (1 – без I, 2 – с I) графически
- 18. Т.о. под действием неконкурентного I Vmax уменьшается, а Кm не изменяется
- 19. В роли регуляторов V ферментативных реакций наиболее часто выступают: гормоны, медиаторы,
- 21. Активаторы ферментов 1. Ионы K+, Na+, Mg2+, Mn2+, Co2+,
- 22. 2. Специфические агенты (н-р, HCl) и другие ферменты Регуляция сводится к
- 23. Н-р, пепсиноген превращается в пепсин в результате ограниченного протеолиза: под действием
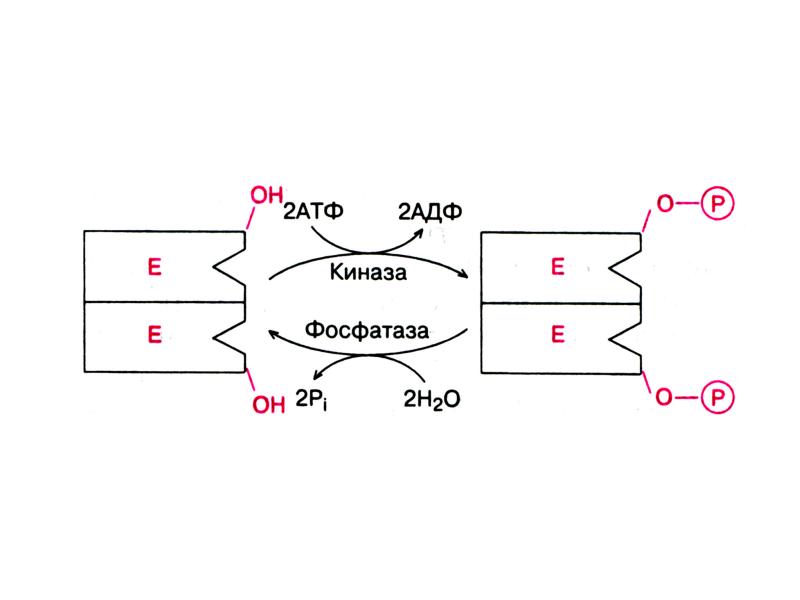
- 24. Активность некоторых Е может регулироваться с помощью химической модификации, н-р, путем
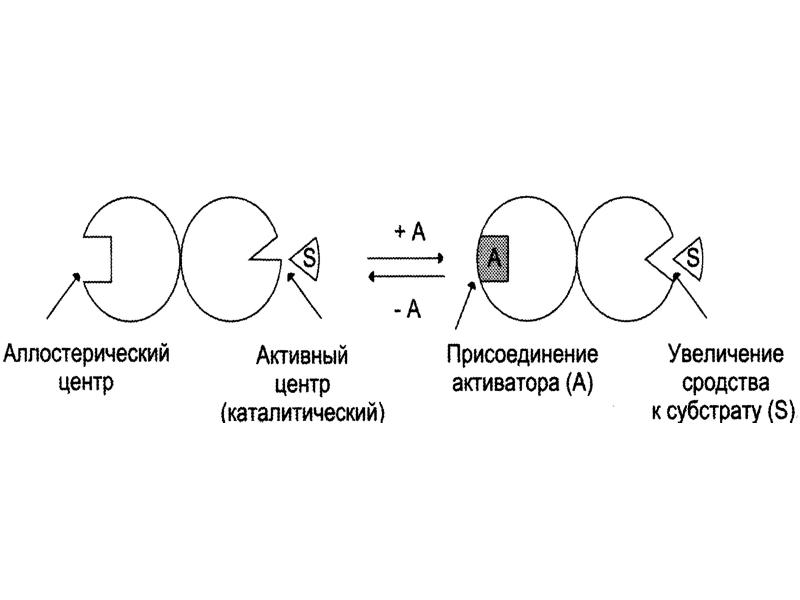
- 26. 3. Аллостерические активаторы Связываются с R, в результате чего конформация
- 28. 4. Активаторы, способствующие объединению неактивных субъединиц E в активный надмолекулярный комплекс,
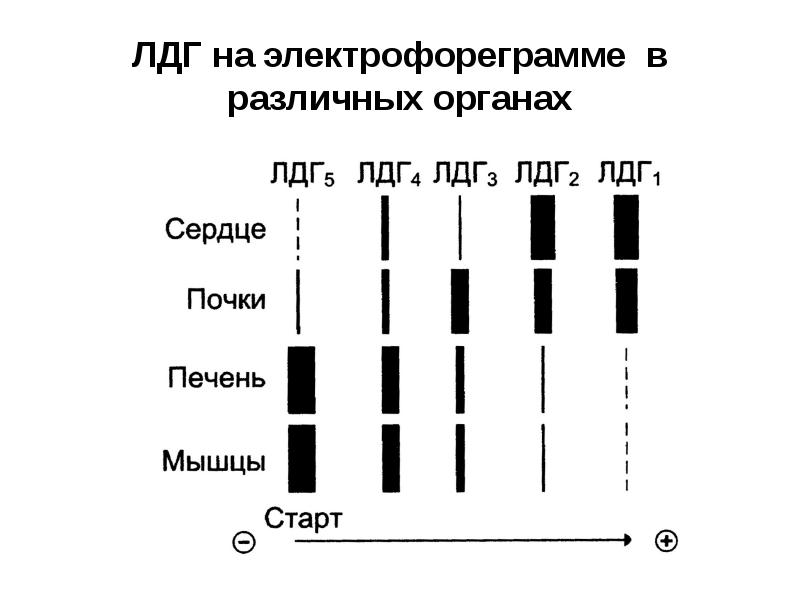
- 29. Изоферменты Это различные молекулярные формы одного и того же фермента,
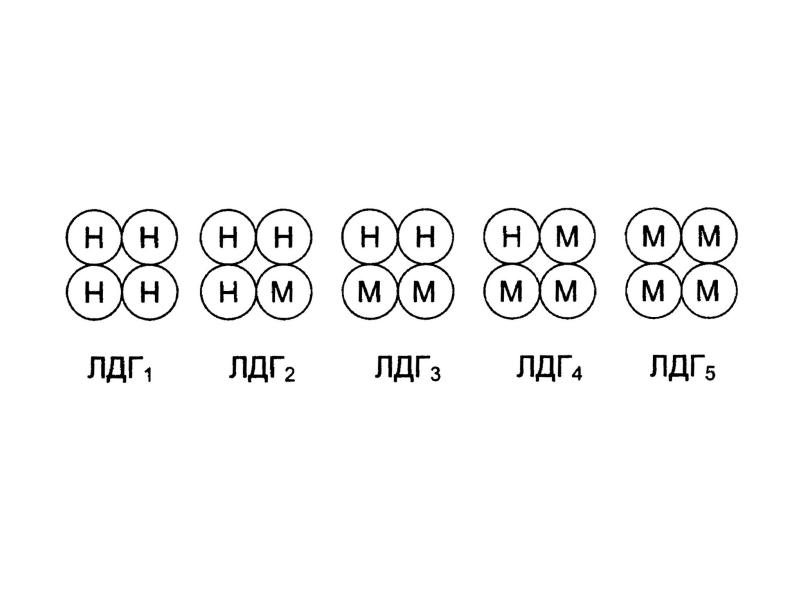
- 30. Например, лактатдегидрогеназа (ЛДГ) имеет четвертичную структуру, содержит 2 типа субъединиц М
- 31. ЛДГ1 – НННН (Н4) ЛДГ2 – НННМ (Н3М) ЛДГ3 – ННММ
- 33. ЛДГ на электрофореграмме в различных органах
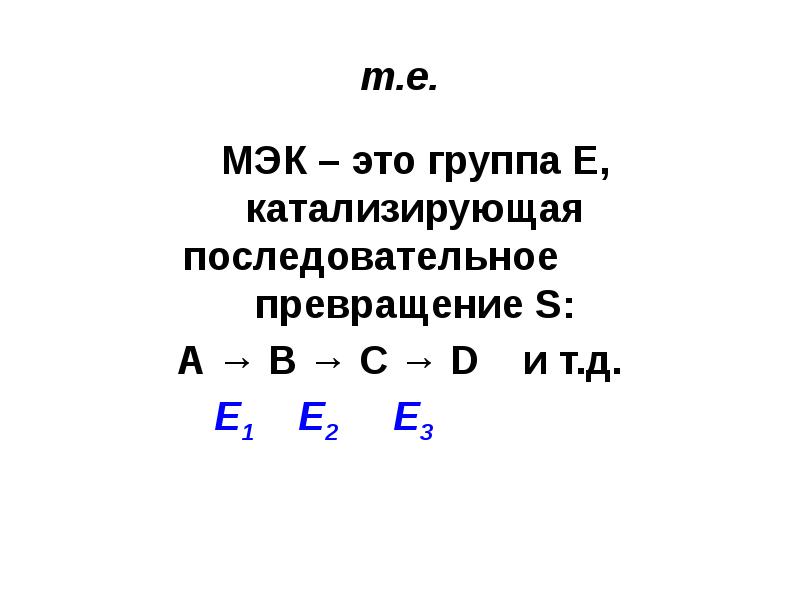
- 34. Мультиэнзимные комплексы (МЭК) - надмолекулярные ферментативные системы, состоящие из различных Е,
- 35. т.е. МЭК – это группа Е, катализирующая последовательное превращение
- 36. Существует несколько видов МЭК, в основе организации которых лежит единство: 1
- 37. 1 Отдельные Е объединены в полиферментную систему. Н-р,
- 38. 2 Е образуют структурные системы с определенной функцией при помощи Е-Е
- 39. Пируватдегидрогеназный комплекс
- 40. синтетаза высших жирных кислот, состоящая из 7 структурно связанных Е, в
- 41. 3 Представляет комбинацию обоих типов организации. Н-р, цикл
- 42. Биологическое значение Образуется «молекулярный конвейер», благодаря которому: значительно сокращается расстояние,
- 43. Медицинская энзимология Энзимопатология Энзимодиагностика Энзимотерапия
- 44. Энзимопатология изучает наследственные
- 45. Н-р, 1: Фенилкетонурия – заболевание, при котором отсутствует Е гидроксилаза, превращающая
- 46. Энзимодиагностика заключается в постановке диагноза заболевания на основе определения
- 47. Например: При инфаркте миокарда увеличивается содержание ферментов ЛДГ1 и ЛДГ2, аспартатаминотрансферазы.
- 48. Энзимотерапия – использование ферментов в качестве лекарственных средств.
- 49. Имеет следующие направления: Заместительная терапия – использование ферментов в качестве лечебных
- 50. Использование в качестве дополнительных терапевтических средств (н-р, различные гидролитические ферменты
- 51. Трудности в использовании ферментов: нестабильность антигенные свойства практически невозможность доставки
- 52. Для увеличения стабильности Е их связывают с различными инертными носителями (целлюлоза,
- 53. Для направленного действия Е на мишень, на поверхности микрокапсулы прикрепляют векторную
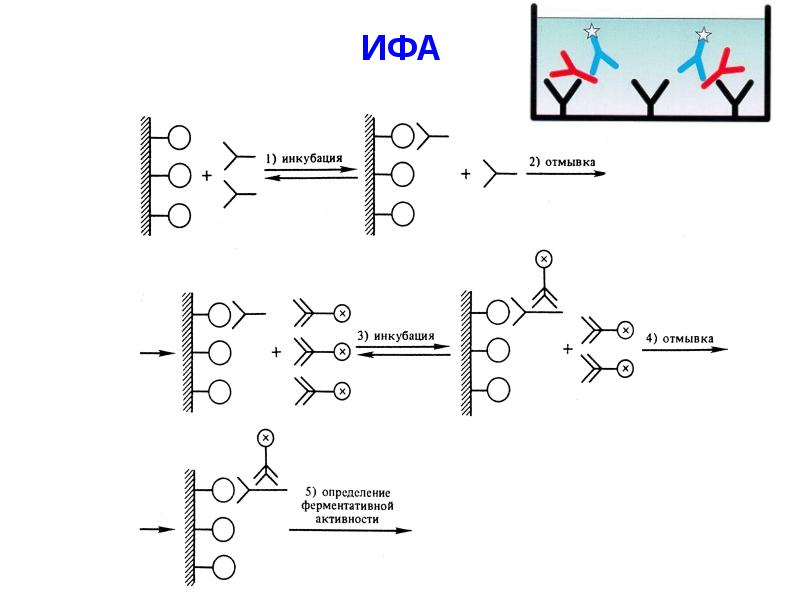
- 54. Ферменты широко используются для определения содержания различных веществ в биологических жидкостях
- 55. ИФА
- 56. Скачать презентацию
![Обратимое
I связывается с E нековалентными связями → [IE] легко Обратимое
I связывается с E нековалентными связями → [IE] легко](/documents_7/fdeac3bd3ef90db7727502636565cf11/img1.jpg)























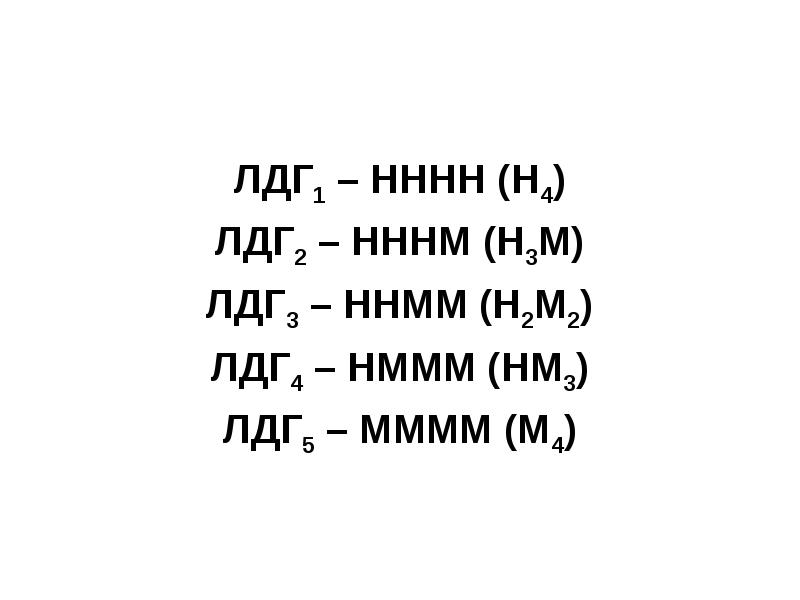




















Слайды и текст этой презентации
Скачать презентацию на тему Пример необратимого ингибирования – ЛВ аспирин можно ниже:
Похожие презентации





























