V и III группы периодической системы элементов Д.И. Менделеева презентация
Содержание
- 2. Натрия гидрокарбонат Natrii hydrocarbonas NaHCO3
- 3. (открыт в 1801 году) (открыт в 1801
- 4. Белый кристаллический порошок без запаха, солено-щелочного вкуса, устойчив в сухом воздухе,
- 5. Хорошо растворяется в воде, нерастворим в 95% спирте. Хорошо растворяется
- 6. 1) Na+ - пирохимическая реакция 1) Na+ - пирохимическая реакция 2)
- 7. - прозрачность и цветность раствора - прозрачность и цветность раствора
- 8. Метод нейтрализации, ацидиметрия Метод нейтрализации, ацидиметрия Рабочий раствор- 0,1н HCl
- 9. в хорошо укупоренной таре в хорошо укупоренной таре
- 10. Кислота борная Acidum boricum H3BO3 М.м. 61,83
- 11. В промышленности борную кислоту получают из борсодержащих минералов (ашарита Mg2OB2O5*H2O) действием
- 12. Жирные на ощупь, бесцветные, прозрачные чешуйчатые кристаллы или мелкий белый кристаллический
- 13. В холодной воде растворяется плохо, в горячей – хорошо. Растворима в
- 14. 1) с этанолом в присутствии конц. H2SO4, при этом образуется борно-этиловый
- 15. 2) с куркумовой бумажкой, одновременно добавляя несколько капель HCl – появляется
- 16. - прозрачность и цветность; - прозрачность и цветность; - допускается присутствие
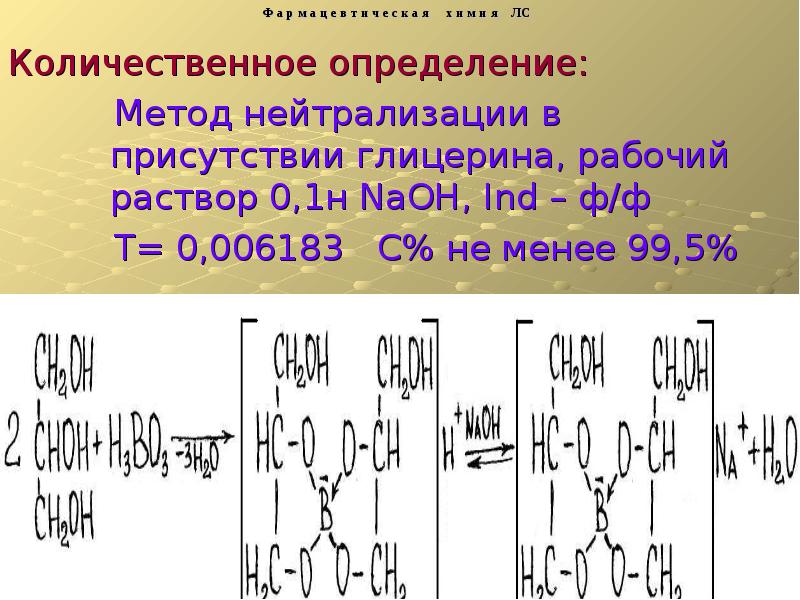
- 17. Метод нейтрализации в присутствии глицерина, рабочий раствор 0,1н NaOH, Ind –
- 18. - как антисептическое средство в виде 2-3% растворов для полоскания горла,
- 19. В хорошо укупоренной таре В хорошо укупоренной таре
- 20. Натрия тетроборат. Бура Natrii tetraboras Borax Na2B4O7*10H2O М.м. 381,37
- 21. В природе встречается в свободном состоянии. В промышленности получают из борной
- 22. бесцветные прозрачные легковыветривающиеся кристаллы или белый кристаллический порошок бесцветные прозрачные легковыветривающиеся
- 23. Хорошо растворяется в воде, лучше в горячей. Легко в глицерине, не
- 24. а) Na+: а) Na+: пирохимическая реакция -окрашивание пламени в желтый цвет
- 25. - не должно быть примесей карбонатов; - не должно быть примесей
- 26. Метод нейтрализации (ацидиметрия) Метод нейтрализации (ацидиметрия) Рабочий раствор – 0,1N HCL
- 28. в хорошо укупоренной таре в прохладном месте в хорошо укупоренной
- 29. Скачать презентацию



























Слайды и текст этой презентации
Скачать презентацию на тему V и III группы периодической системы элементов Д.И. Менделеева можно ниже:
Похожие презентации





























