Аминокислоты. Пептиды. Белки презентация
Содержание
- 2. Структура и физико-химические свойства аминокислот 20 аминокислот входят в состав
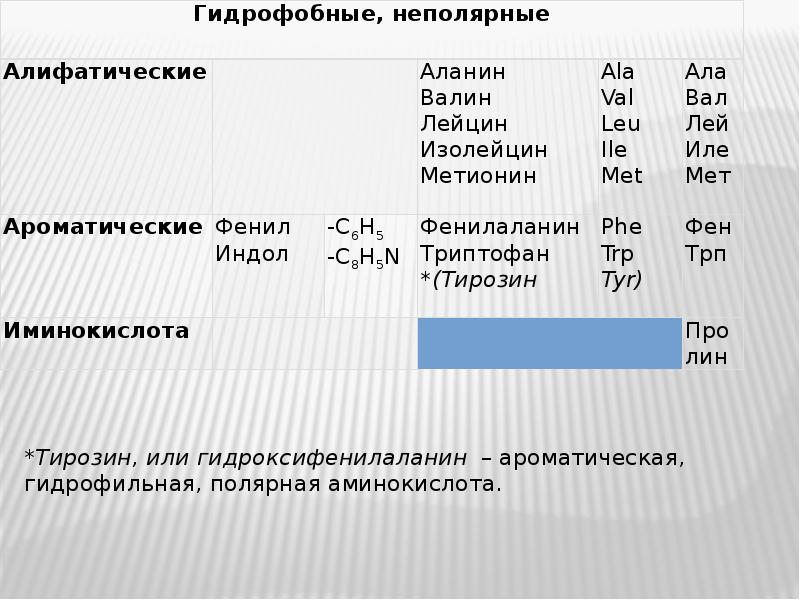
- 3. По структуре боковой группы R аминокислоты подразделяются на: По структуре боковой
- 6. Протеиногенные аминокислоты делятся на: незаменимые – не могут синтезироваться в организме
- 7. -Аминоксилоты (кроме глицина) имеют в структуре хиральные (асимметричные) атомы С. -Аминоксилоты
- 8. Химические свойства аминокислот Химические свойства аминокислот декарбоксилирования (образование аминов) и дезаминирования
- 9. образования амидов и сложных эфиров; образования амидов и сложных эфиров; взаимодействие
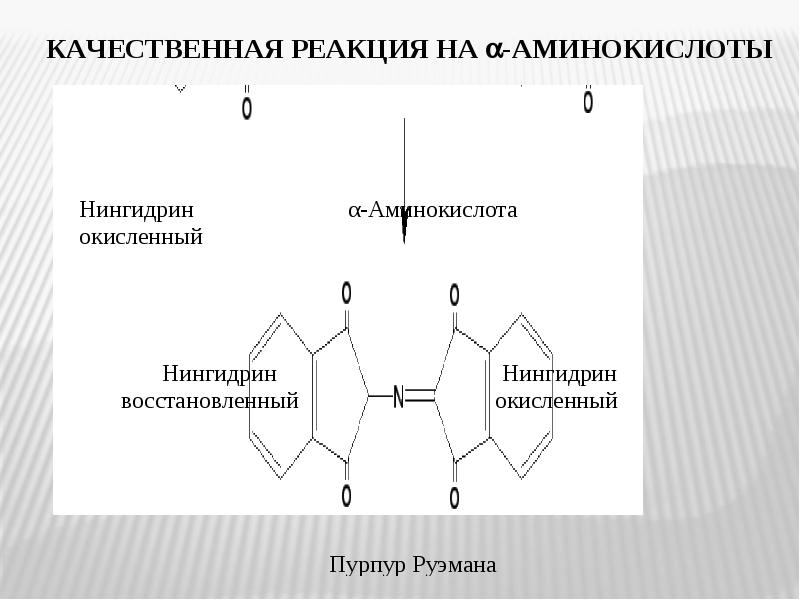
- 10. Универсальной качественной реакцией на α-аминокислоты, является их взаимодействие с нингидрином, сопровождающееся
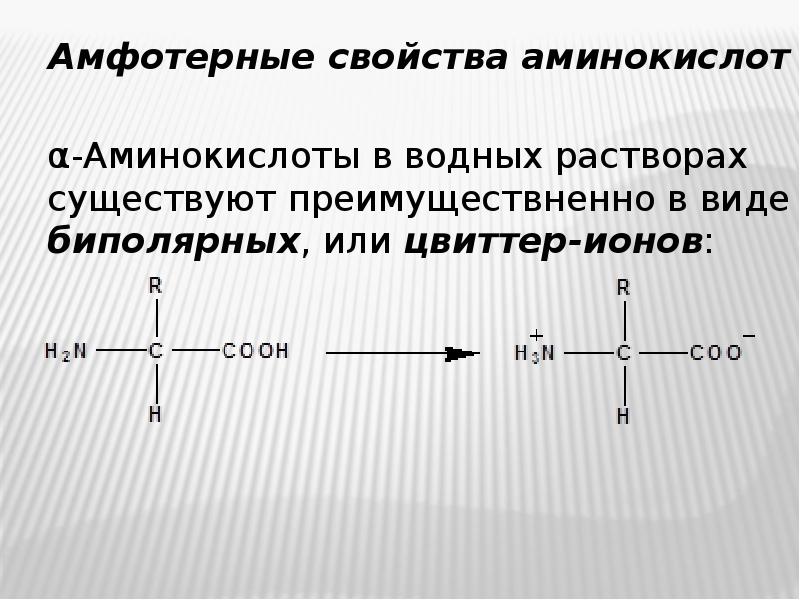
- 12. Амфотерные свойства аминокислот Амфотерные свойства аминокислот α-Аминокислоты в водных растворах существуют
- 13. Степень диссоциации ионогенных групп зависит от рН. Степень диссоциации ионогенных групп
- 14. Значение рН водного раствора химически чистой аминокислоты называется изоионной точкой.
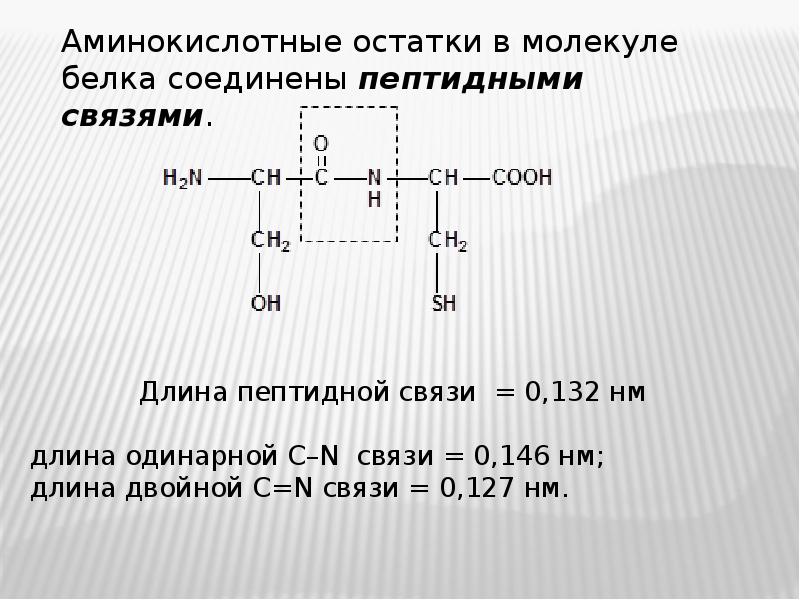
- 17. Свойства пептидной связи: Свойства пептидной связи: пептидная группа жесткая планарная (плоская)
- 18. По числу аминокислотных остатков: По числу аминокислотных остатков: олигопептиды (до 10
- 19. Полипептиды, состоящие более, чем из 50 аминокислотных остатков, относятся к белкам,
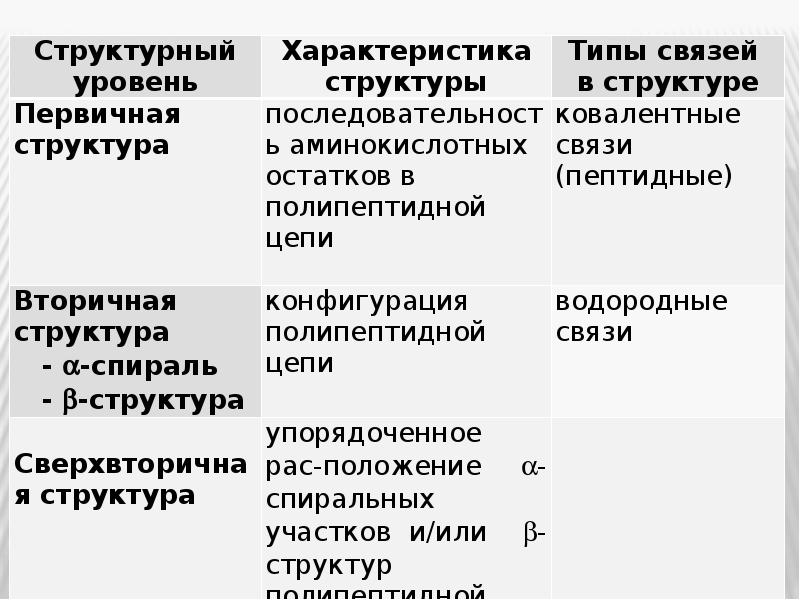
- 22. В зависимости от степени асимметрии молекулы белка, имеющие пространственную структуру (конформацию),
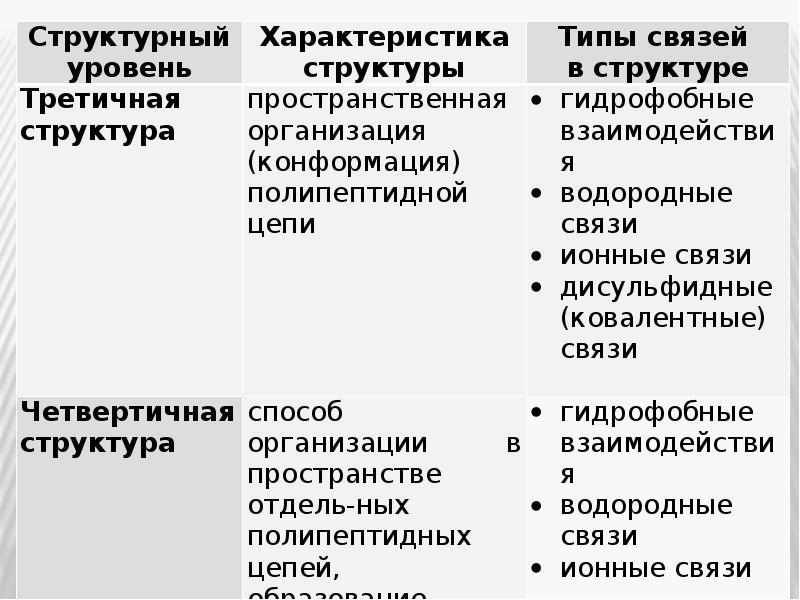
- 23. Формирование третичной структуры приводит к образованию функционально активной, или нативной, белковой
- 24. Физико-химические свойства белков Физико-химические свойства белков Большинство белков – это водорастворимые
- 25. Белки способны взаимодействовать и с катионами, и с анионами. Белки
- 26. Денатурация – изменение пространственной структуры, которая происходит в связи с разрывом
- 27. Классификация белков Классификация белков В зависимости от состава белки делятся на
- 28. Сложные белки кроме белковой части имеют структуры небелковой природы. Сложные
- 29. Функции белков Функции белков Каталитическая функция. Структурная функция. Транспортная
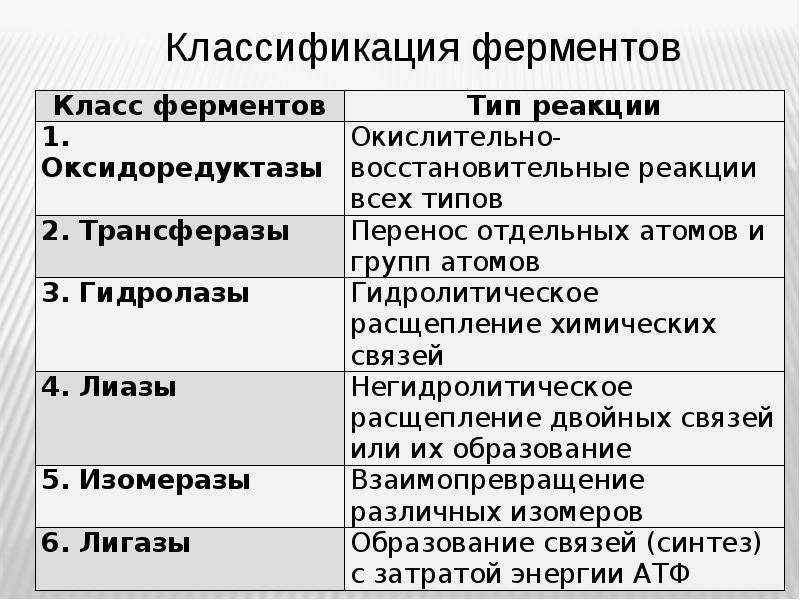
- 30. ферменты Ферменты - природные биокатализаторы белковой природы.
- 31. СВОЙСТВА ФЕРМЕНТОВ СВОЙСТВА ФЕРМЕНТОВ Общие со всеми катализаторами: 1. способность катализировать
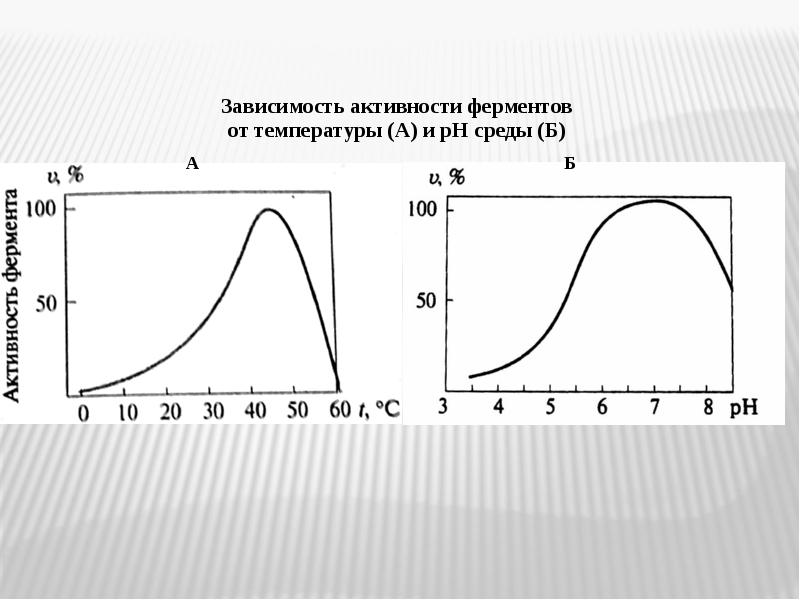
- 32. Специфические свойства: Специфические свойства: 1. более высокая активность ферментов по сравнению
- 33. Структура ФЕРМЕНТОВ Простые ферменты – однокомпонентные, состоят только из полипептидной части;
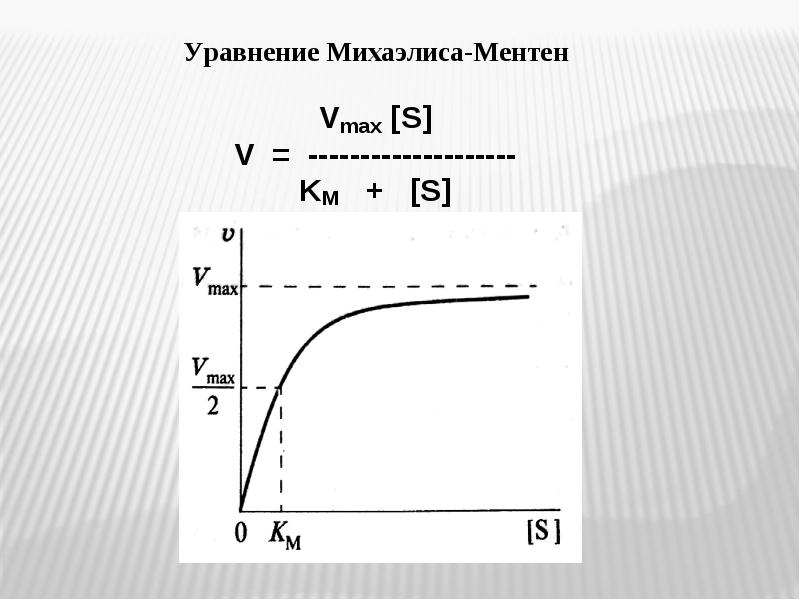
- 35. Единицы и формы выражения активности ферментов Единицы и формы выражения активности
- 38. Скачать презентацию




























Слайды и текст этой презентации
Похожие презентации





























