Ароматические углеводороды презентация
Содержание
- 2. Аренами (ароматическими углеводородами) называют углеводороды, содержащие в молекуле циклогексатриеновый, бензольный цикл.
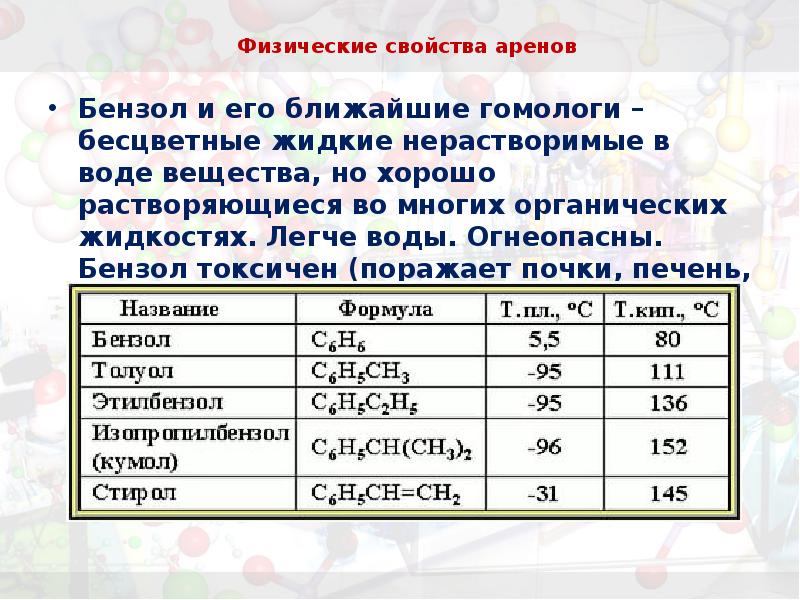
- 4. Физические свойства аренов Бензол и его ближайшие гомологи – бесцветные
- 5. История открытия Аренов Бензол был открыт еще в 1649 г.
- 6. История открытия Аренов
- 7. История открытия Аренов
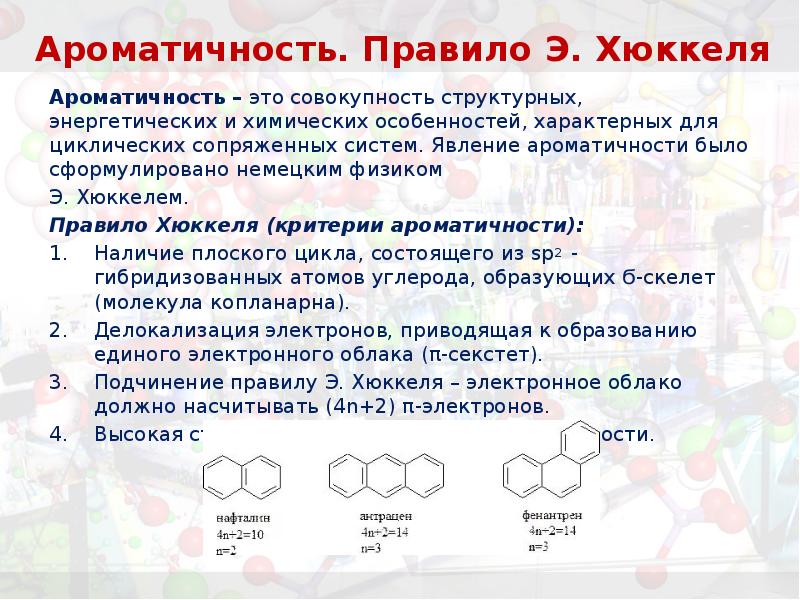
- 8. Ароматичность. Правило Э. Хюккеля
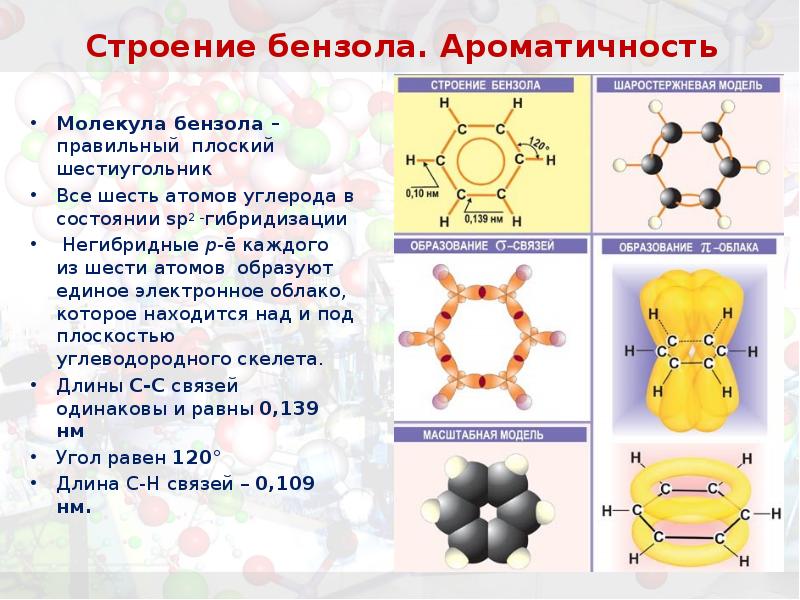
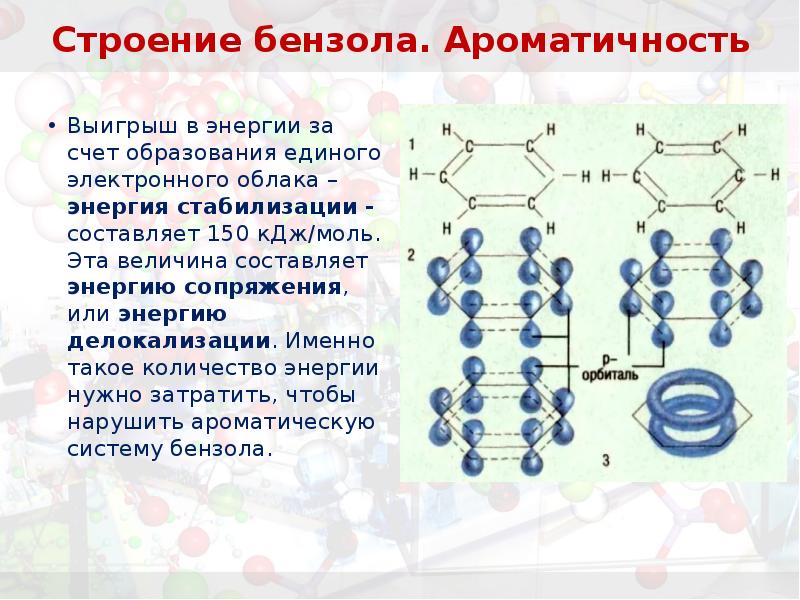
- 9. Строение бензола. Ароматичность
- 10. Строение бензола. Ароматичность
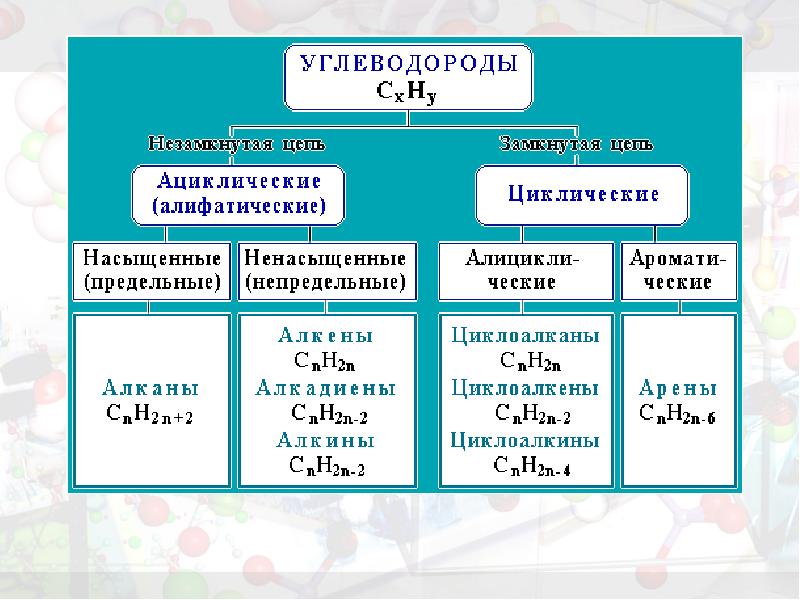
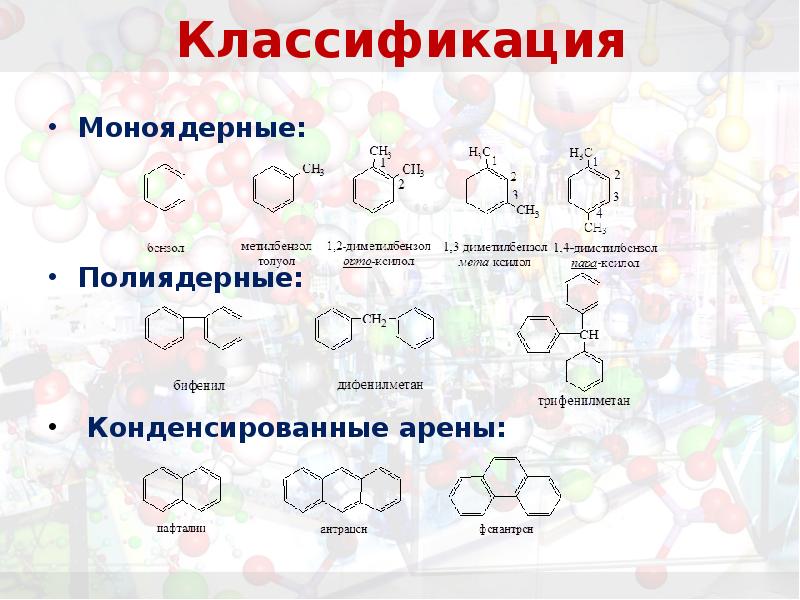
- 11. Классификация
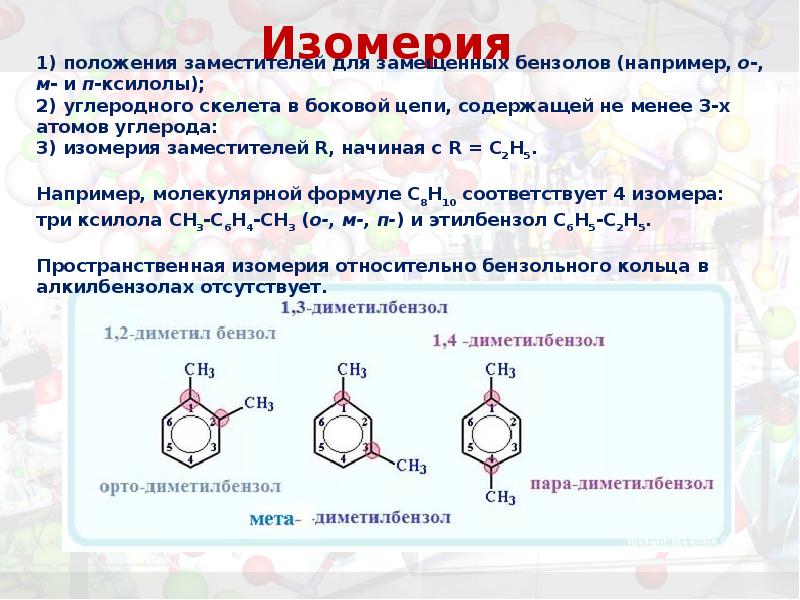
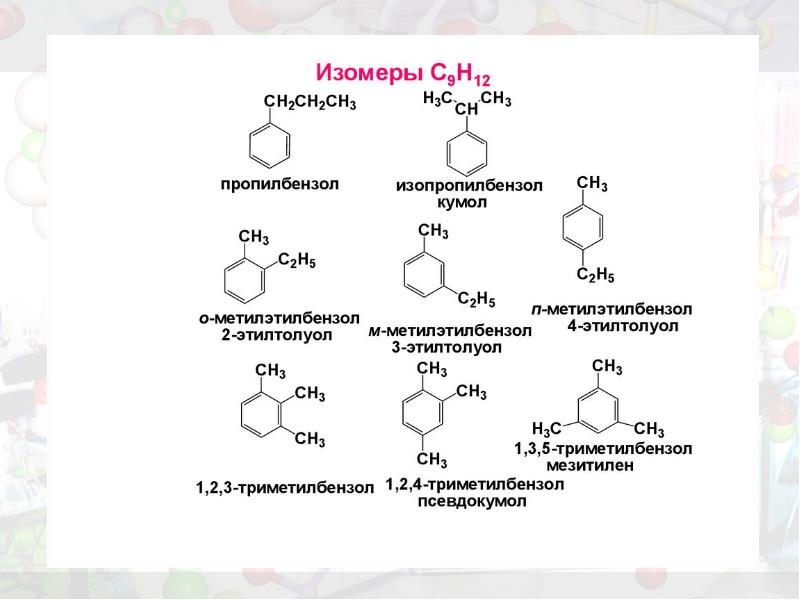
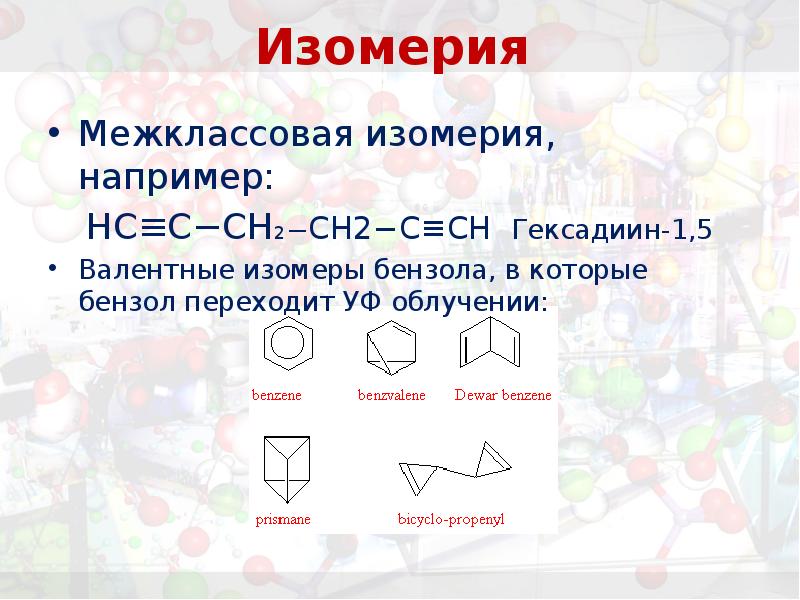
- 12. Изомерия
- 14. Изомерия
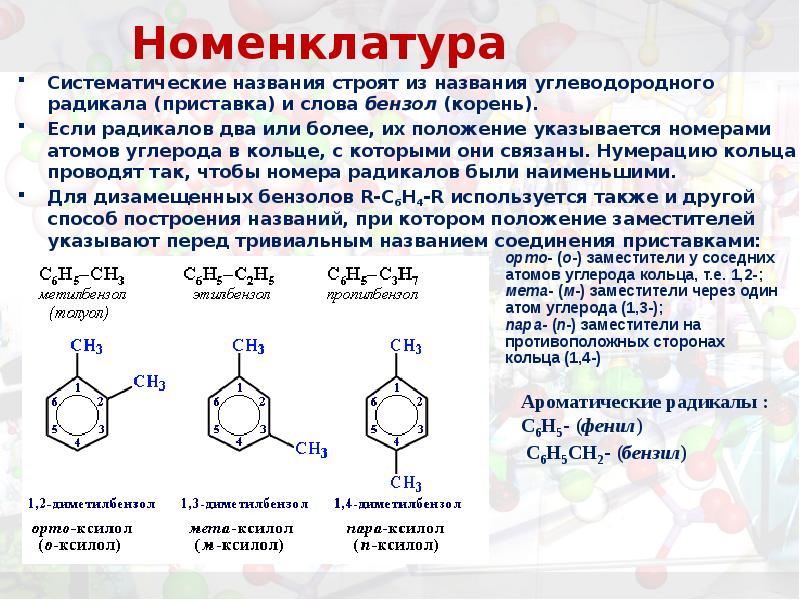
- 15. Номенклатура Систематические названия строят из названия углеводородного радикала (приставка) и слова
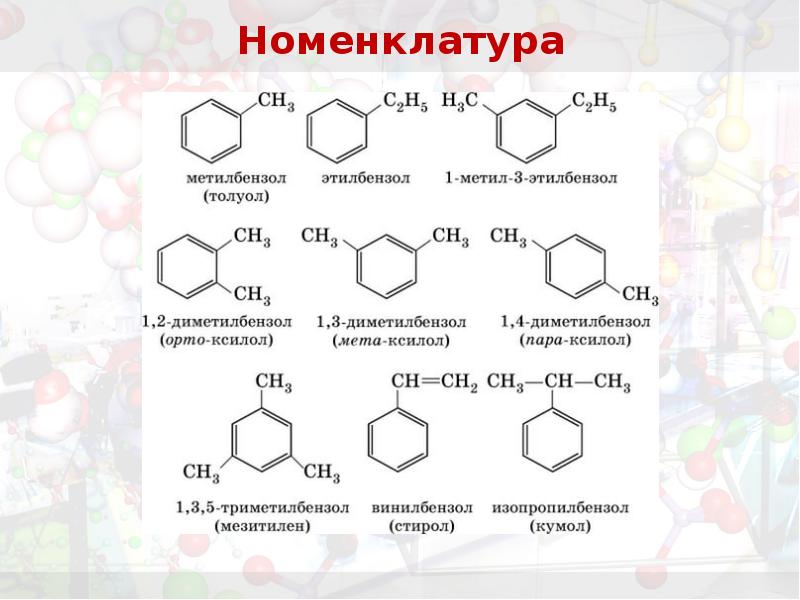
- 16. Номенклатура
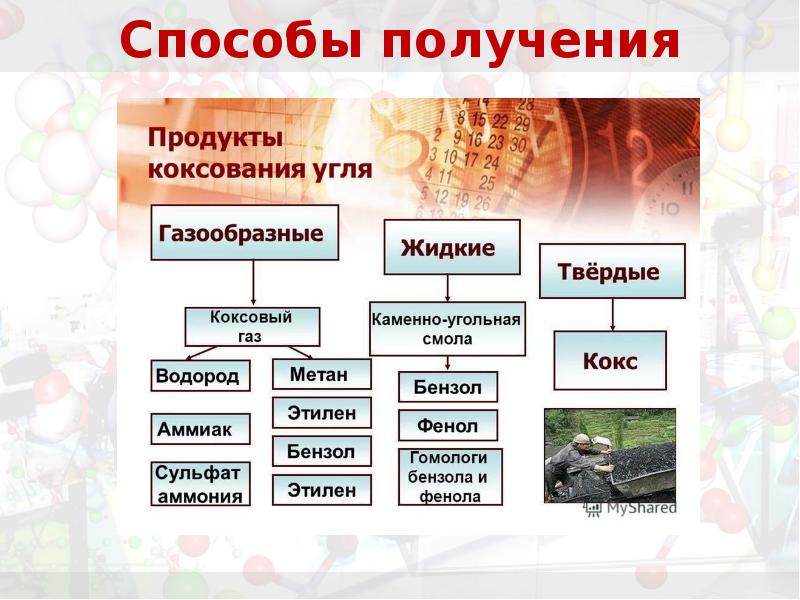
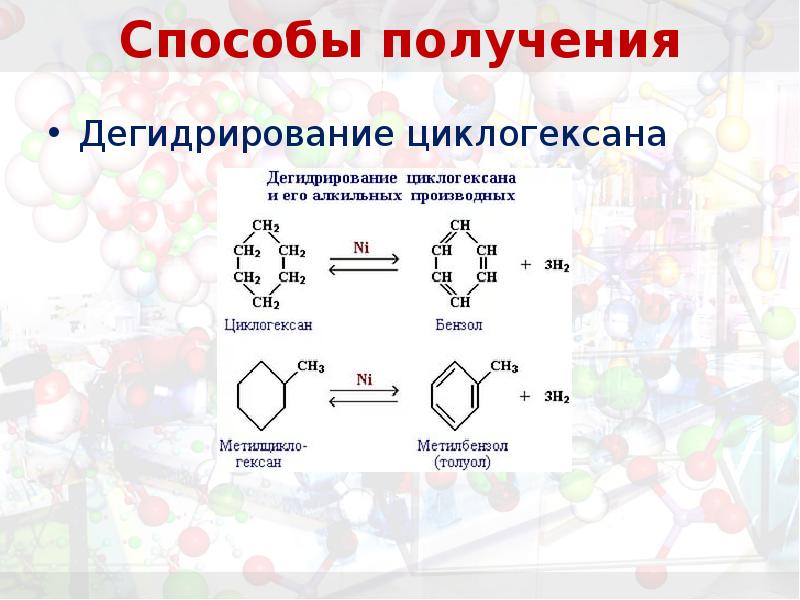
- 17. Способы получения
- 18. Способы получения Приведите уравнения реакций: 1. дегидрирования циклогексана; 2. дегидроциклизации гексана
- 19. Способы получения
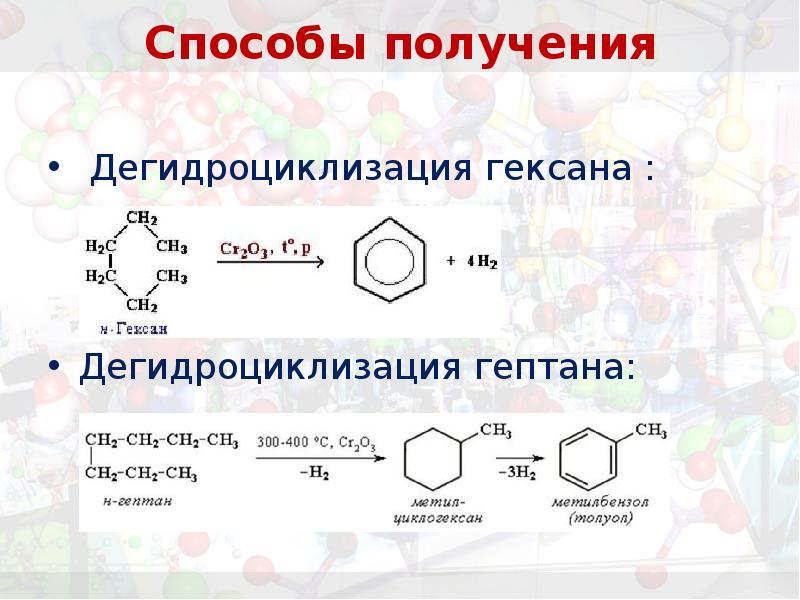
- 20. Способы получения Дегидроциклизация гексана : Дегидроциклизация гептана:
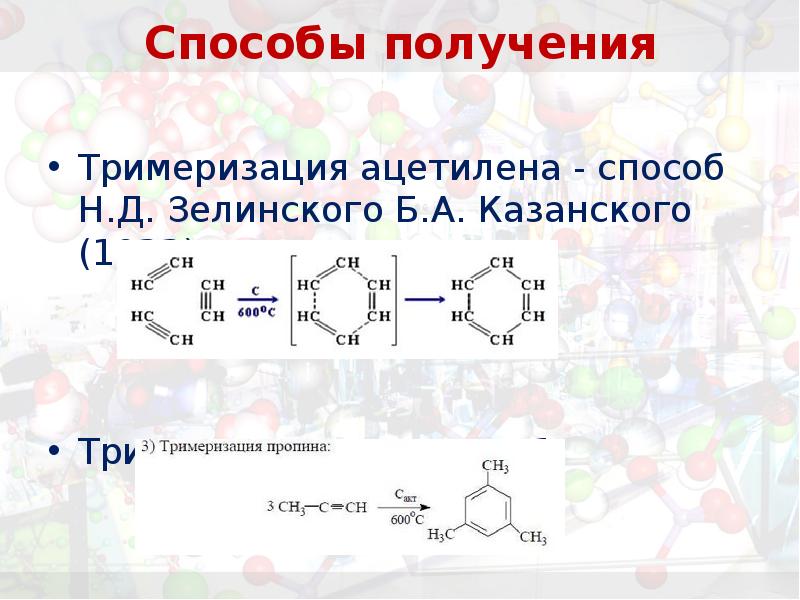
- 21. Способы получения Тримеризация ацетилена - способ Н.Д. Зелинского Б.А. Казанского (1922)
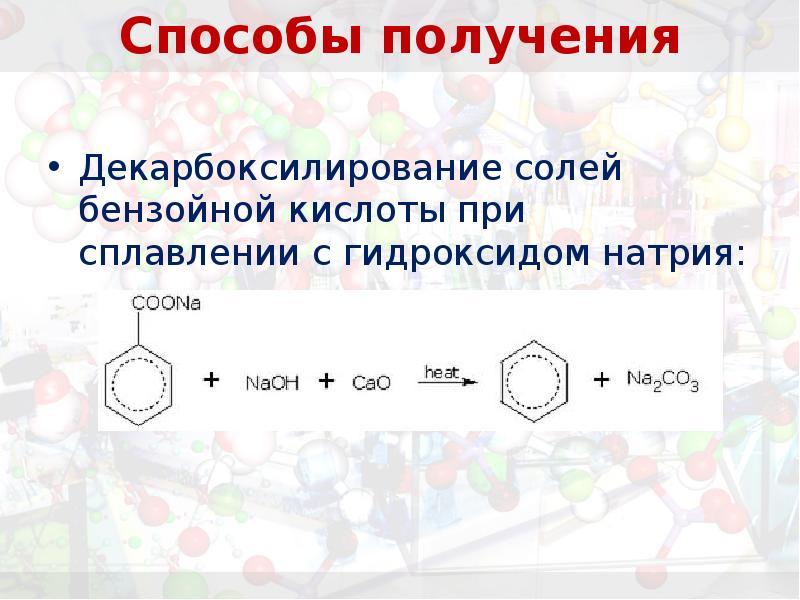
- 22. Способы получения Декарбоксилирование солей бензойной кислоты при сплавлении с гидроксидом натрия:
- 23. Химические свойства аренов По химическим свойствам арены отличаются от предельных и
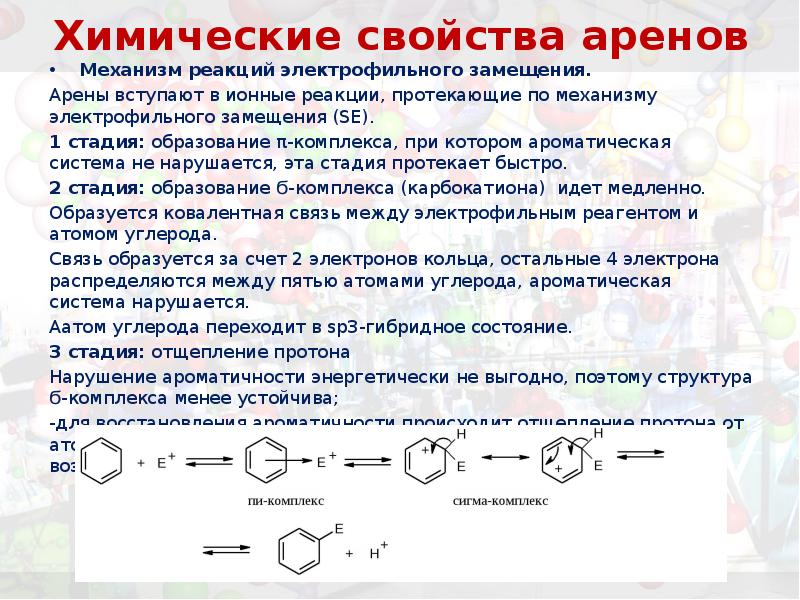
- 24. Химические свойства аренов Механизм реакций электрофильного замещения. Арены вступают в ионные
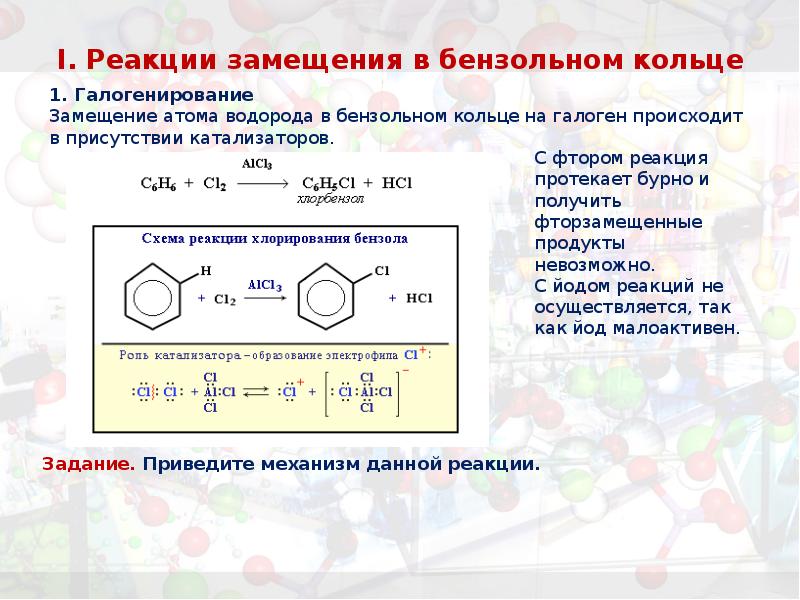
- 25. I. Реакции замещения в бензольном кольце
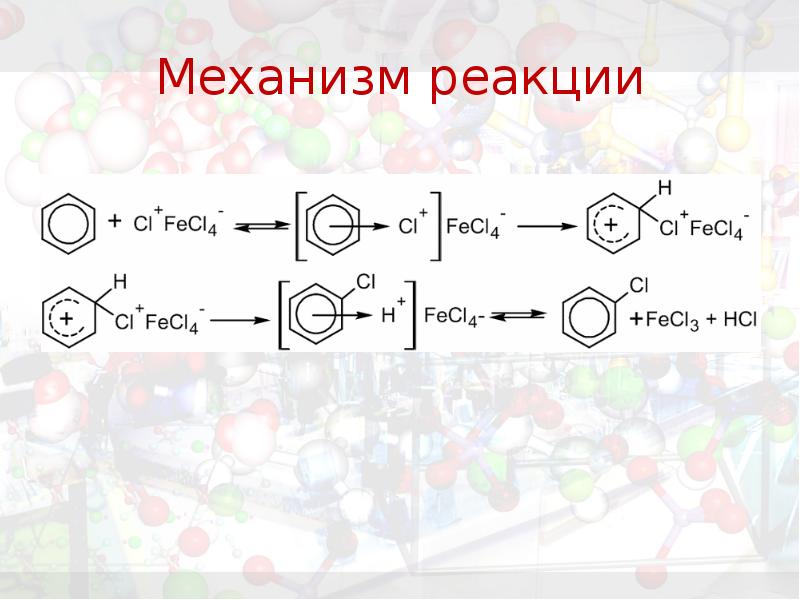
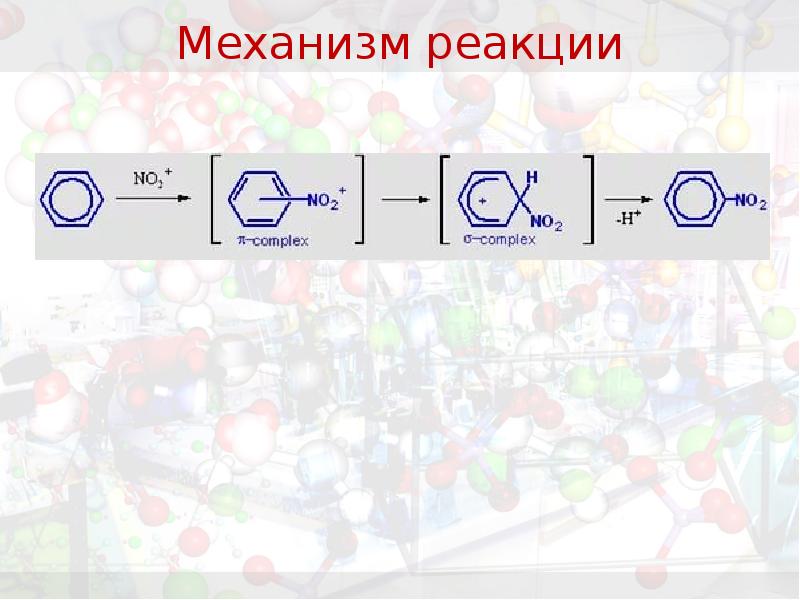
- 26. Механизм реакции
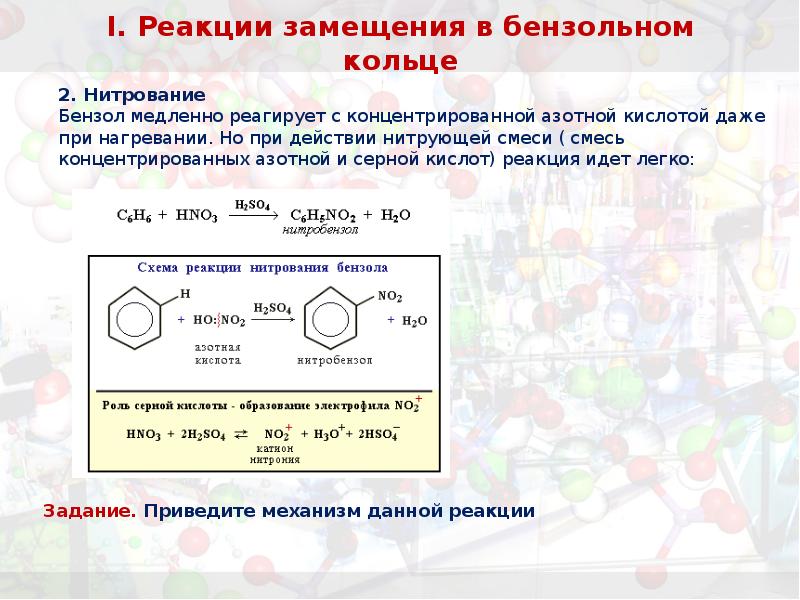
- 27. I. Реакции замещения в бензольном кольце
- 28. Механизм реакции
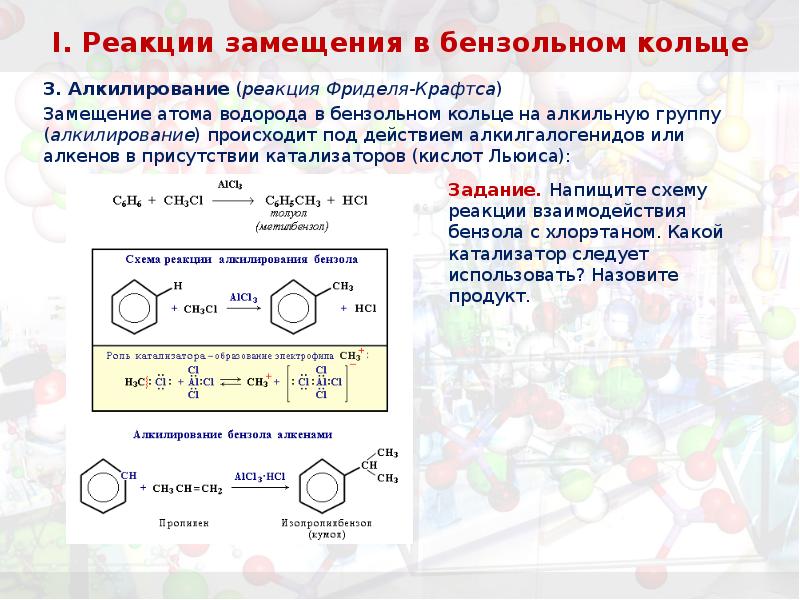
- 29. I. Реакции замещения в бензольном кольце 3. Алкилирование (реакция Фриделя-Крафтса) Замещение
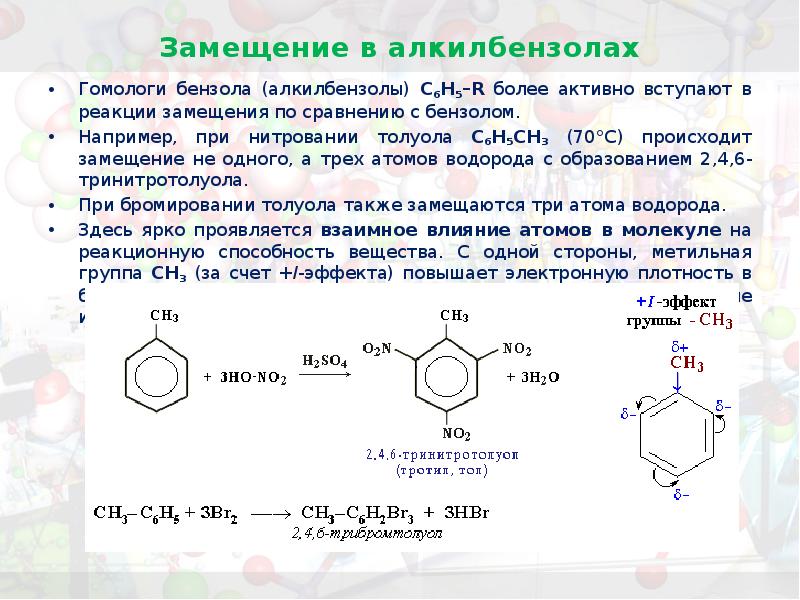
- 30. Замещение в алкилбензолах Гомологи бензола (алкилбензолы) С6Н5–R более активно вступают в
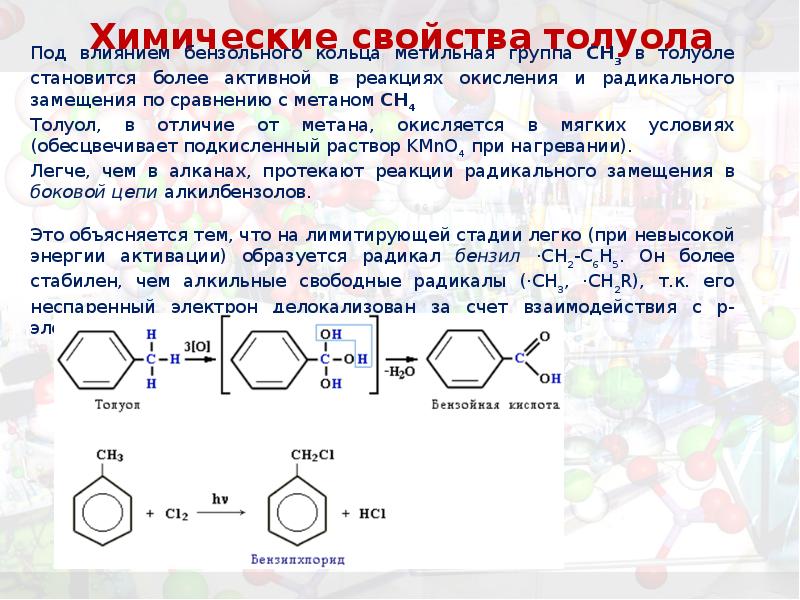
- 31. Химические свойства толуола Под влиянием бензольного кольца метильная группа СH3 в
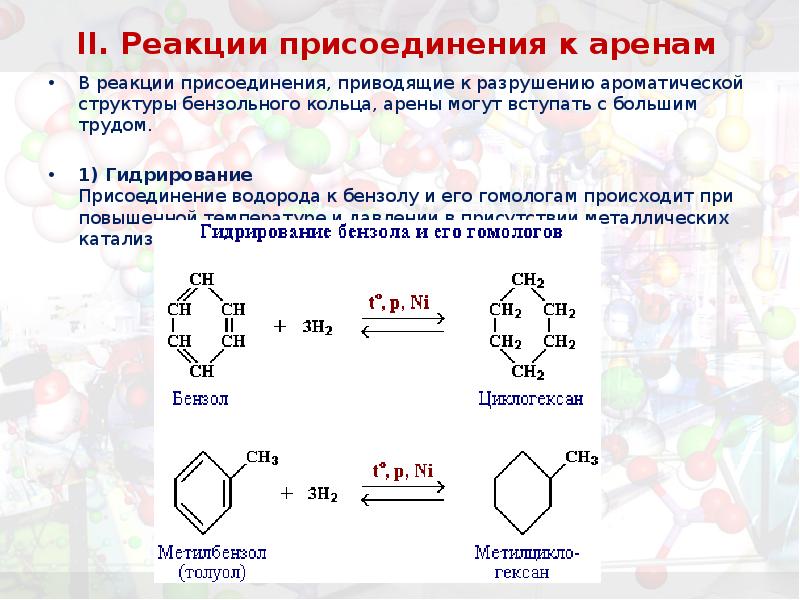
- 32. II. Реакции присоединения к аренам В реакции присоединения, приводящие к
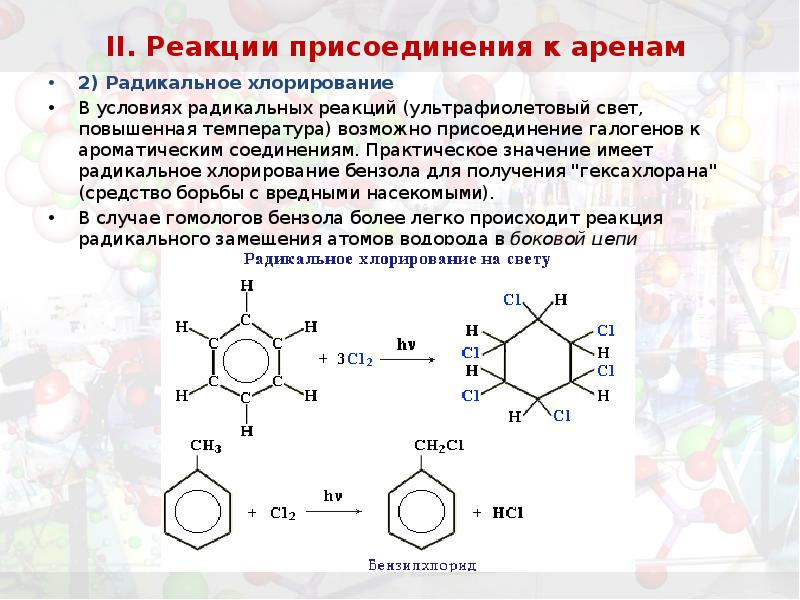
- 33. II. Реакции присоединения к аренам 2) Радикальное хлорирование В условиях
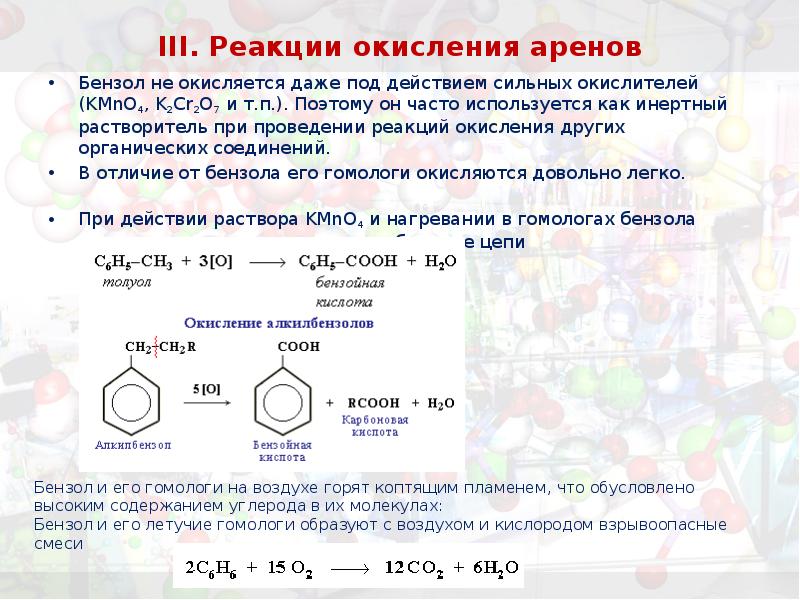
- 34. III. Реакции окисления аренов Бензол не окисляется даже под действием
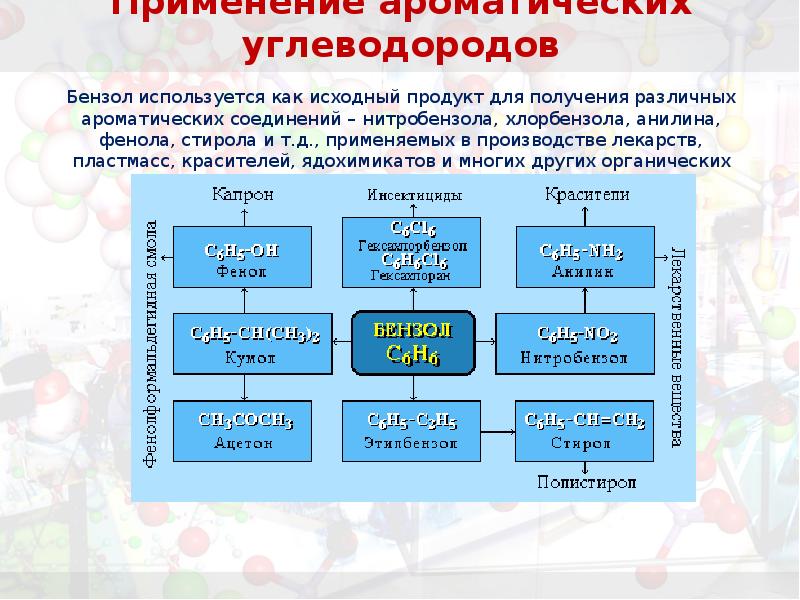
- 35. Применение ароматических углеводородов Бензол используется как исходный продукт для получения различных
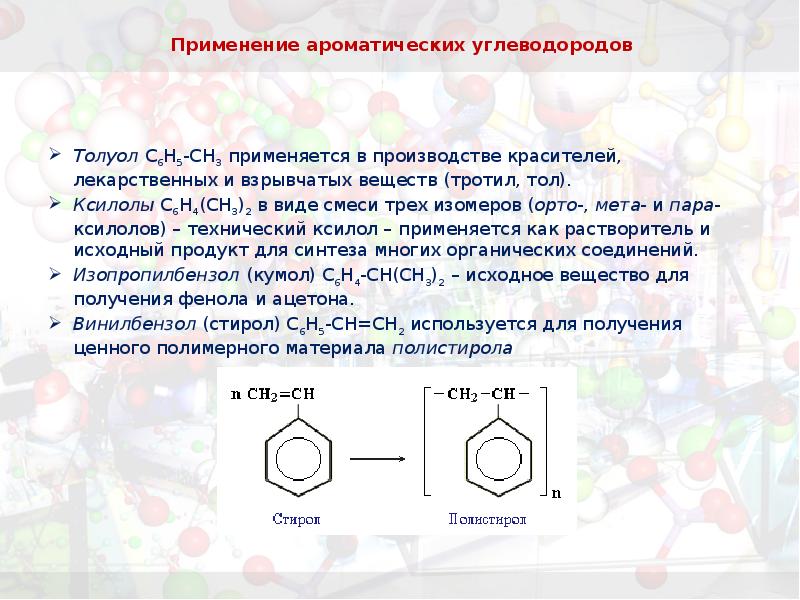
- 36. Применение ароматических углеводородов Толуол С6Н5-СН3 применяется в производстве красителей, лекарственных
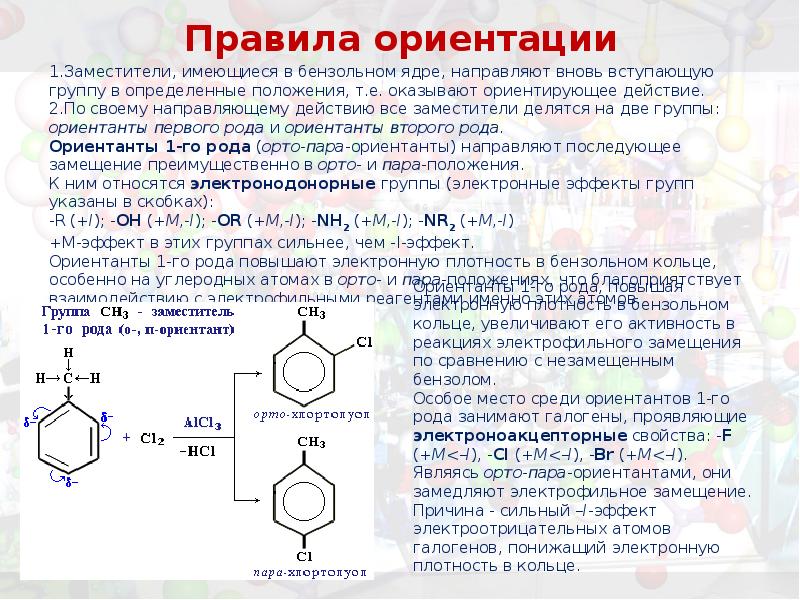
- 37. Правила ориентации Заместители, имеющиеся в бензольном ядре, направляют вновь вступающую группу
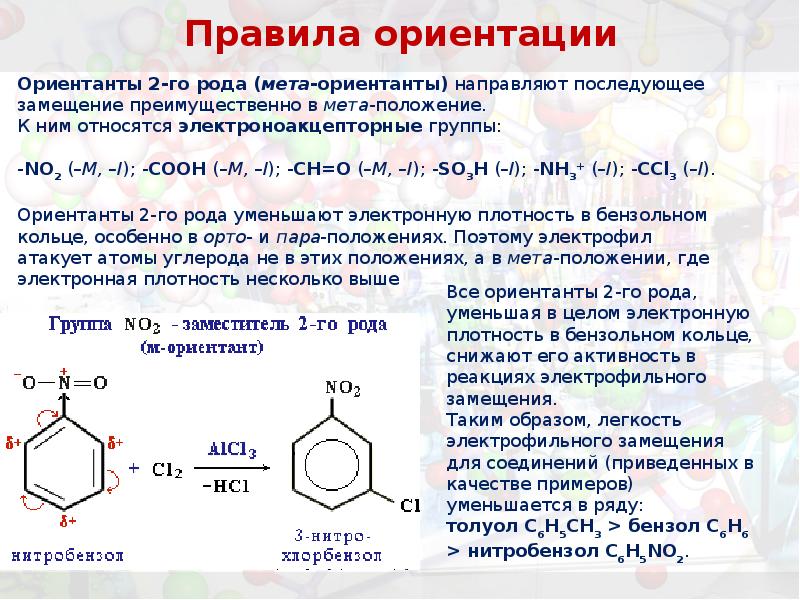
- 38. Правила ориентации Ориентанты 2-го рода (мета-ориентанты) направляют последующее замещение преимущественно в
- 39. Отдельные представители Бензол – бесцветная жидкость с характерным запахом, не растворяется
- 40. Отдельные представители Толуол – бесцветная жидкость, не растворяется в воде, проявляет
- 41. Кумол (изопропил бензол) используется для получения фенола и ацетона. N-Цимол
- 42. Нафталин – бесцветные пластинки (t пл. 80 градусов), легко возгоняется, не
- 43. Антрацен и фенантрен (t пл. 217 и 100), выделяют из каменноугольной
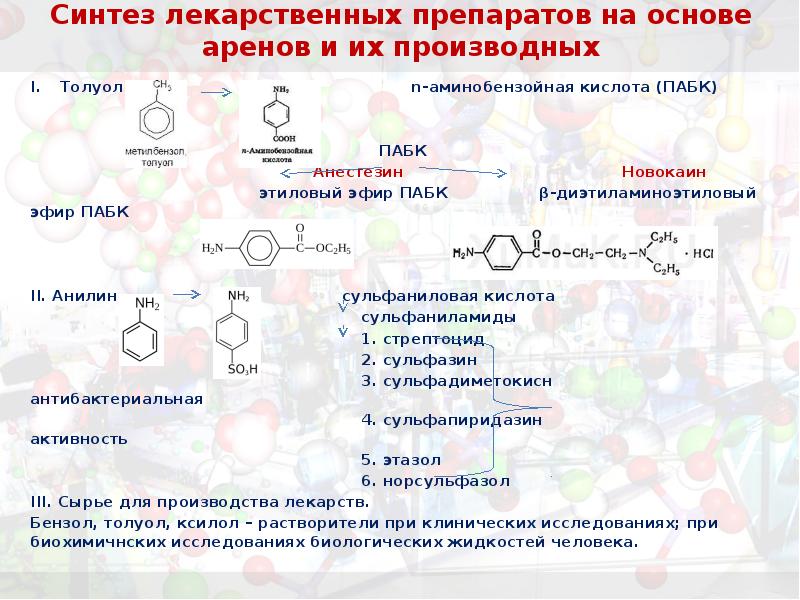
- 44. Синтез лекарственных препаратов на основе аренов и их производных Толуол
- 45. Скачать презентацию












Слайды и текст этой презентации
Похожие презентации





























