Бериллий (Beryllium) Be презентация
Содержание
- 3. БЕРИЛЛИЙ (Beryllium) Be – химический элемент II группы периодической системы Менделеева,
- 4. *Прежде всего несколько (их может быть гораздо больше!) ответов на вопрос:
- 5. Бериллиесодержащие минералы известны с древности. Некоторые из них добывались на Синайском
- 6. Бериллий был открыт в 1798. Французский кристаллограф и минералог Рене Жюст
- 7. Рене Жюст предложил французскому химику Никола Луи Воклену (1763–1829) проанализировать берилл
- 8. В виде простого вещества элемент, открытый Вокленом, впервые получил немецкий химик
- 9. Бериллий легко растворяется в разбавленных водных растворах кислот (соляной, серной, азотной),
- 10. При проведении реакции с расплавом щелочи при 400–500° С образуются диоксобериллаты:
- 11. Металлический бериллий быстро растворяется в водном растворе NH4HF2. Эта реакция имеет технологическое
- 12. Для выделения металлического бериллия его оксид или гидроксид сначала переводят в
- 13. Смесь соединений радия и бериллия долгое время использовалась как удобный лабораторный
- 14. С помощью бериллия улучшают качество поверхности деталей машин и механизмов. Для
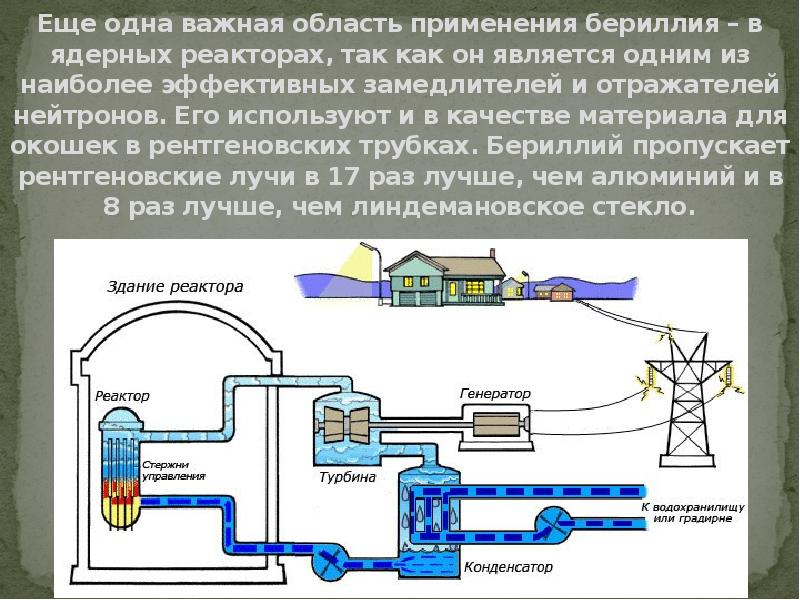
- 15. Еще одна важная область применения бериллия – в ядерных реакторах, так
- 17. Бериллий не относится к биологически важным химическим элементам. В то же
- 19. АЛЮМИНИЙ AL
- 20. ЧТО ТАКОЕ АЛЮМИНИЙ? Лёгкий, прочный, стойкий к коррозии и функциональный –
- 21. Алюминий – серебристо-белый металл, 13-й элемент периодической таблицы Менделеева. Невероятно, но факт:
- 22. Но каким бы распространенным ни был алюминий, его открытие стало возможным
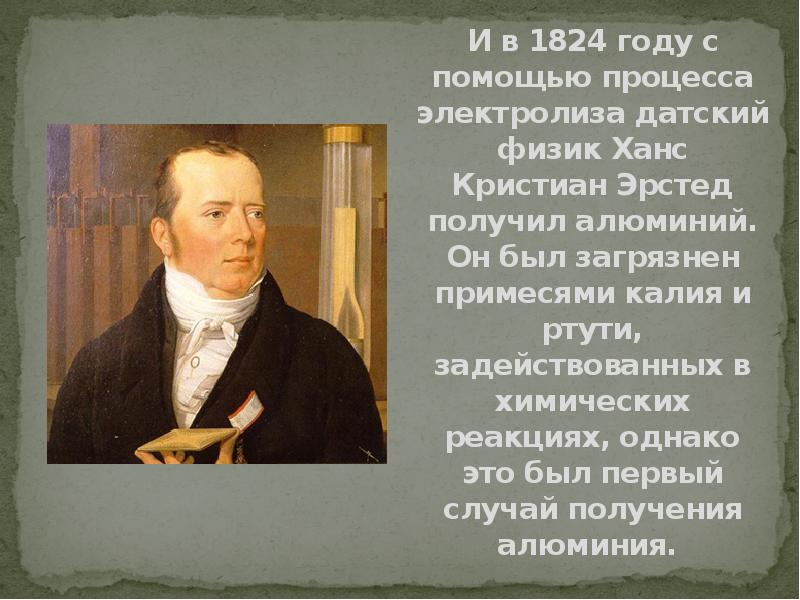
- 23. И в 1824 году с помощью процесса электролиза датский физик Ханс
- 24. Алюминий имеет редкое сочетание ценных свойств. Это один из самых легких
- 25. Самый известный пример – термитная смесь, при горении которой выделяется так
- 26. Вытеснение алюминием из растворов солей менее активных металлов часто затруднено защитной
- 27. В крепких растворах щелочей алюминий легко растворяется с выделением водорода: 2Al
- 28. При сплавлении со щелочами образуются безводные алюминаты: Al2O3 + 2NaOH = 2NaAlO2 + H2O
- 29. Галогениды алюминия в водных растворах имеют кислую реакцию из-за гидролиза: AlCl3
- 30. Устойчивый в отсутствие влаги при комнатной температуре гидрид AlH3 получают в растворе
- 31. Спасибо за внимание ! 9А класс Белоглазова Наталья Каленюк Анастасия
- 32. Скачать презентацию




























Слайды и текст этой презентации
Похожие презентации