Дисперсные системы в атмосфере презентация
Содержание
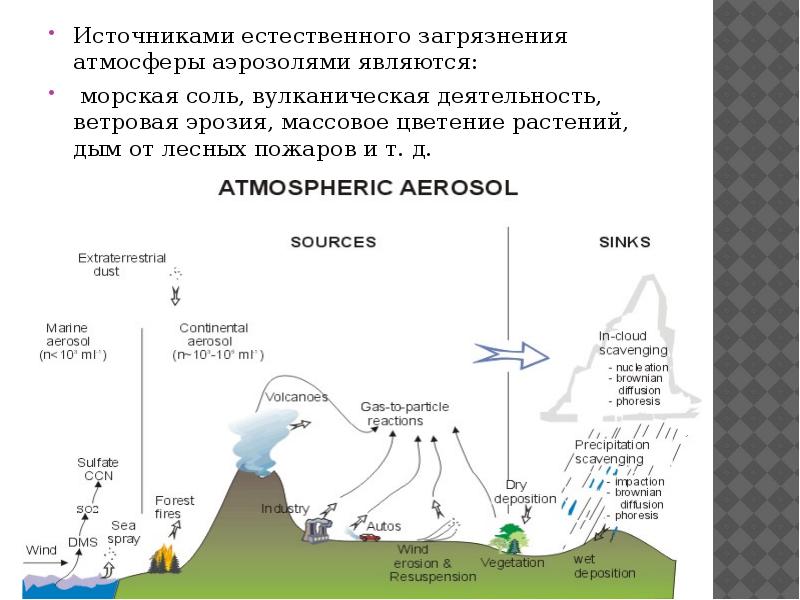
- 2. Источниками естественного загрязнения атмосферы аэрозолями являются: Источниками естественного загрязнения атмосферы аэрозолями
- 3. Морская соль. Источником неорганических солей в атмосфере являются морские брызги, переносимые
- 4. Объемы поступления в атмосферу морской соли в виде аэрозольных частиц составляют
- 5. Вулканические выбросы. Источник — действующие вулканы.
- 6. Вредное действие вулканических выбросов обусловлено наличием различных газов, а также вулканической
- 7. Пыль. Источником пыли являются почвы аридных зон — полупустынь и пустынь.
- 8. Лесные пожары. Крупными источниками аэрозольных частиц (сажи) являются лесные пожары, за
- 9. Метеоритная пыль. В верхние слои атмосферы поступает 1 Гт/год метеоритной пыли.
- 11. Основные критерии устойчивости аэрозолей Для существования устойчивого аэрозоля необходимо выполнение
- 12. Первый критерий. Первый критерий. Согласно уравнению Стокса, скорость седиментации Wg прямо
- 13. Второй критерий связан с броуновским движением аэрозольных частиц. Броуновское движение наблюдается
- 14. Важным следствием броуновского движения является столкновение частиц и их последующая коагуляция.
- 15. Скорость коагуляции пропорциональна коэффициенту диффузии частиц и квадрату концентрации частиц. Поэтому
- 16. Третий критерий выполняется, если в численном выражении площадь поверхности частицы превосходит
- 17. Четвертый критерий. Выполнимость этого критерия определяется величиной гидродинамического критерия Рейнольдса: W
- 18. Область масштабов размеров дисперсных частиц в аэрозолях достигает 6–7 порядков. Размер
- 19. Размер 102 см (100 мкм) — это размер капель измороси (скорость
- 20. Частицы размером 103 см (10 мкм) формируют важную группу атмосферных аэрозолей,
- 21. Частицы размером 104 см (1 мкм) на жаргоне специалистов по атмосферным
- 22. Нижним пределом размера аэрозольной частицы считается величина порядка 1 нм =
- 23. Выводы Для существования аэрозоля необходимо выполнение ряда критериев Устойчивые дисперсные
- 24. Химия окружающей среды 10 февраля 2010 г. ООС-337
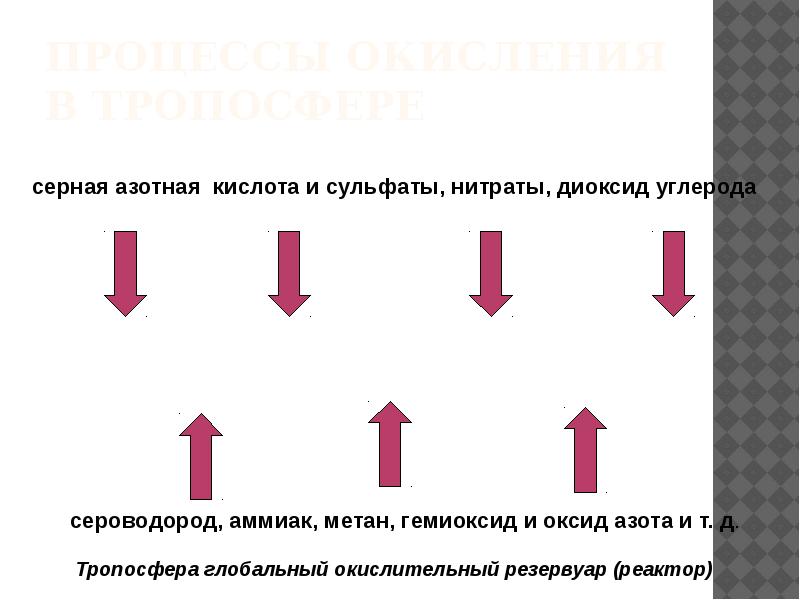
- 25. Процессы окисления в тропосфере
- 26. Процессы окисления примесей в тропосфере Непосредственно в газовой фазе; В
- 27. Механизм образования радикалов в атмосфере В тропосфере свободные радикалы образуются при
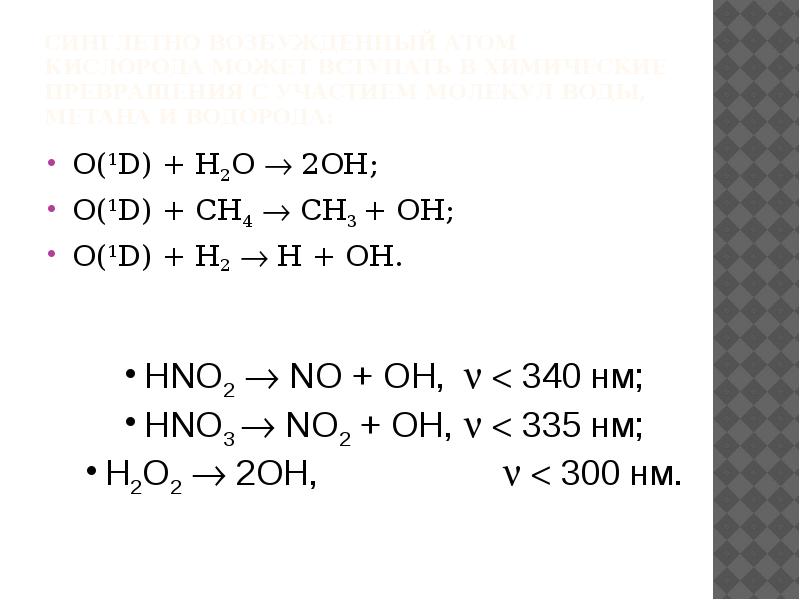
- 28. Синглетно возбужденный атом кислорода может вступать в химические превращения с участием
- 29. Основные реакции гидроксидного радикала и образование гидропероксидного радикала CO +
- 30. Регенерация гидроксидного радикала В результате реакции гидроксидного радикала с оксидом
- 32. Реакции с участием метилпероксидного радикала 2CH3OO O2 + 2CH3O.
- 33. Устойчивые продукты окисления метана- оксид углерода и диоксид углерода формальдегид Формильный
- 34. Выводы Тропосфера играет на планете роль глобального окислительного резервуара. Процессы окисления
- 35. Скачать презентацию































Слайды и текст этой презентации
Похожие презентации





























