Эквиваленты веществ. Жидкое состояние, растворы презентация
Содержание
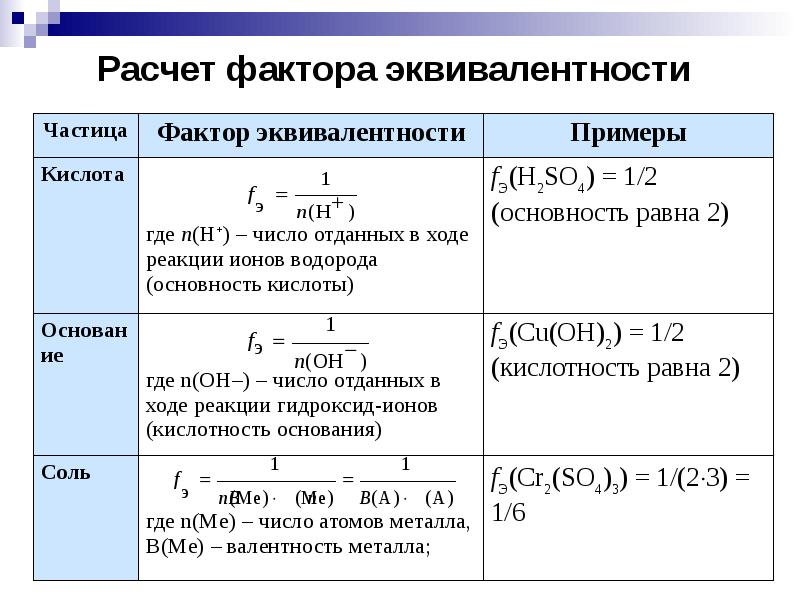
- 2. Расчет фактора эквивалентности
- 3. Эквивалент одного и того же вещества может меняться в зависимости от
- 4. Закон эквивалентов Закон эквивалентов был открыт в 1792 г. И. Рихтером.
- 5. Жидкое состояние. Растворы.
- 6. Жидкое состояние. 1. В жидкостях наблюдается ближний порядок – упорядоченное расположение
- 7. Жидкое состояние. 2. Жидкое состояние по свойствам ближе к твердому. Эти
- 8. Жидкое состояние 3. Жидкости изотропны, тогда как кристаллы
- 9. Растворы Растворы – это гомогенные фазы переменного состава, состоящие из двух
- 10. Раствор состоит из одного или нескольких растворенных веществ и растворителя. Раствор
- 11. Насыщенный раствор – это раствор, содержащий максимально возможное (для данных условий)
- 12. Концентрированный раствор —раствор с высоким содержанием растворённого вещества. Концентрированные растворы
- 13. Способы выражения концентрации Массовая доля - это отношение массы растворенного вещества
- 14. Способы выражения концентрации Молярная концентрация (молярность) c(Х) - отношение количества вещества
- 15. Способы выражения концентрации Моляльность (b) - отношение количества вещества Х к
- 16. Коллигативные свойства растворов Некоторые физико-химические свойства разбавленных растворов определяются только количеством
- 17. Коллигативные свойства растворов В случае электролитов в эти формулы вводится поправочный
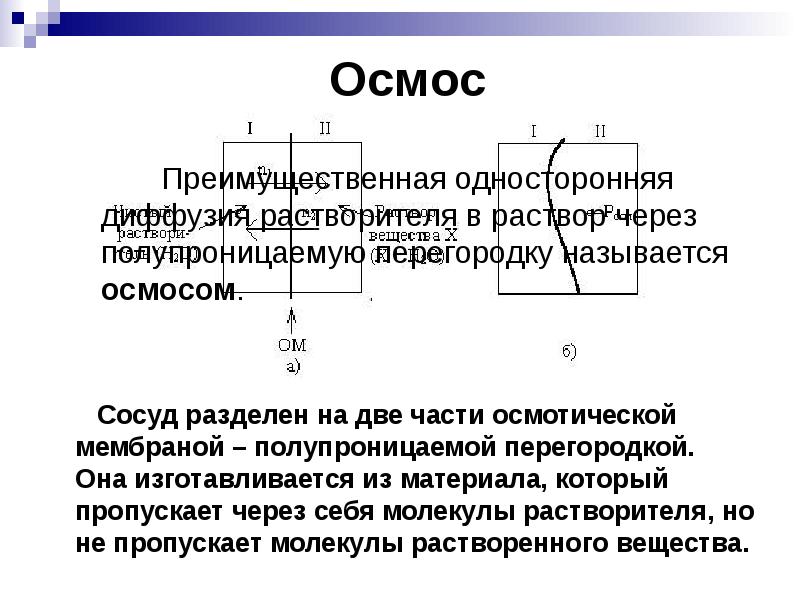
- 18. Осмос
- 19. n1>n2 n1>n2 Объем I будет уменьшаться, а объем II
- 20. Закон осмотического давления Осмотическое давление равно тому давлению, которое производило бы
- 21. Закон Рауля Если жидкий летучий растворитель (например, воду) поместить в замкнутый
- 22. Величина называется относительным понижением давления пара над раствором. Величина
- 23. Первое следствие из закона Рауля Раствор нелетучего вещества имеет температуру кипения
- 24. Второе следствие из закона Рауля Раствор нелетучего вещества имеет температуру замерзания
- 26. Скачать презентацию























Слайды и текст этой презентации
Скачать презентацию на тему Эквиваленты веществ. Жидкое состояние, растворы можно ниже:
Похожие презентации





























