Электродитическая диссоциация презентация
Содержание
- 2. 1) Электролитическая диссоциация – распад молекулы веществ на ионы пол действием полярных
- 4. Сила притяжения зарядов в вакууме Сила притяжения зарядов в среде,
- 5. 3) Степень электролитической диссоциации (α) – это отношение числа молекул распавшихся к
- 6. По величине (альфа) различают :
- 9. Средние электролиты ( в порядке убывания силы) H2SO3 > HSO4 >
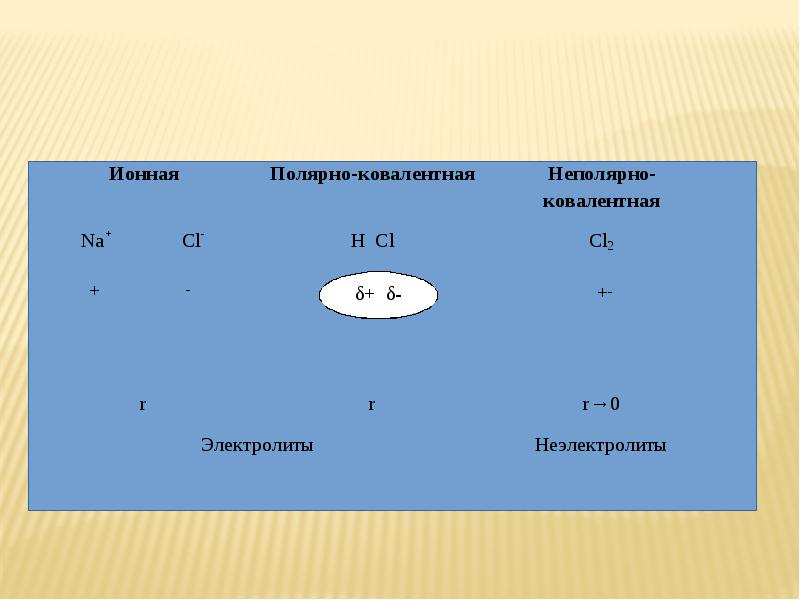
- 11. 4) Классы веществ с точки зрения диссоциации
- 14. 5) Условия необратимости реакций обмена в растворах. Продукт реакции должен выделяться из
- 15. А) ОСАДОК NaCl р + AgNO3 р → AgCl ↓+ NaNO3
- 17. В) СЛАБЫЙ ЭЛЕКТРОЛИТ CH3COONa +HCl→ CH3COOH+NaCl CH3COO- +Na ++H+ + Cl-→
- 18. Скачать презентацию
















Слайды и текст этой презентации
Похожие презентации





























