Электродные потенциалы презентация
Содержание
- 2. План лекции Процессы на границе металл / вода, металл / раствор
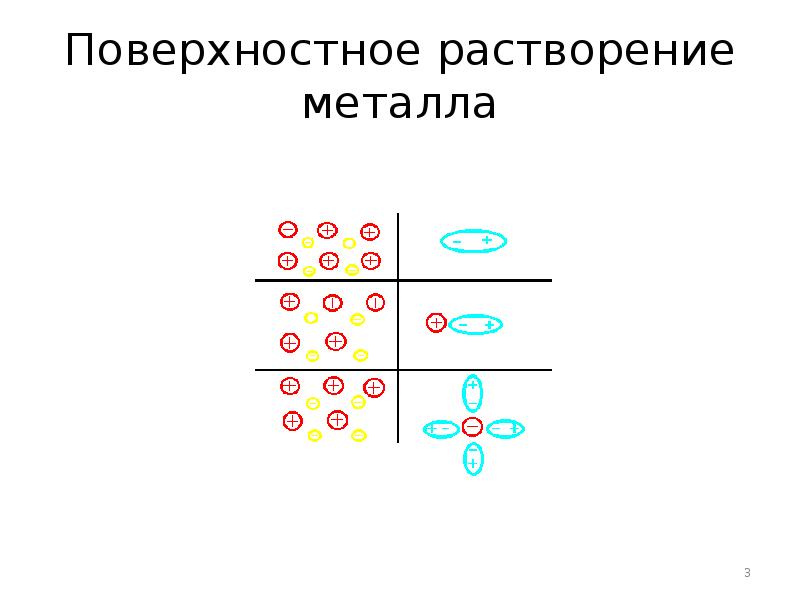
- 3. Поверхностное растворение металла
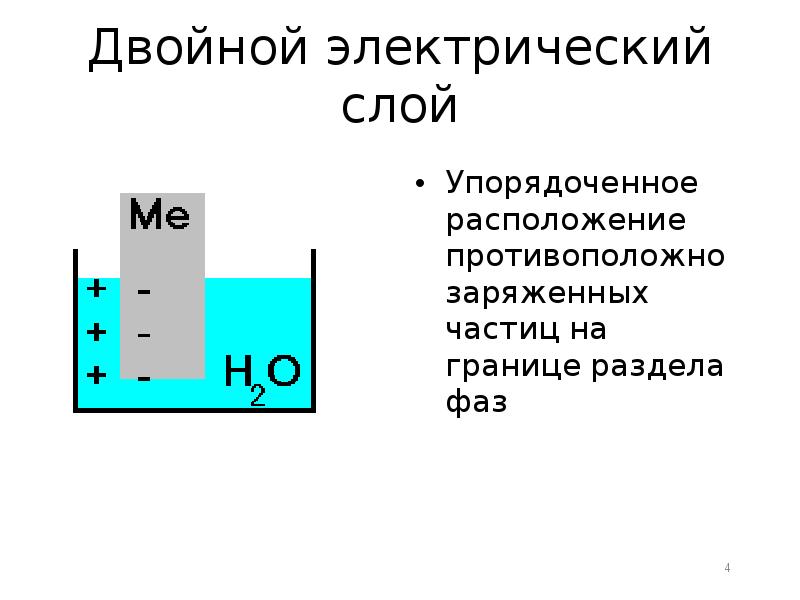
- 4. Двойной электрический слой Упорядоченное расположение противоположно заряженных частиц на границе раздела
- 5. Устанавливается подвижное равновесие (скорость растворения = скорости осаждения) Устанавливается подвижное равновесие
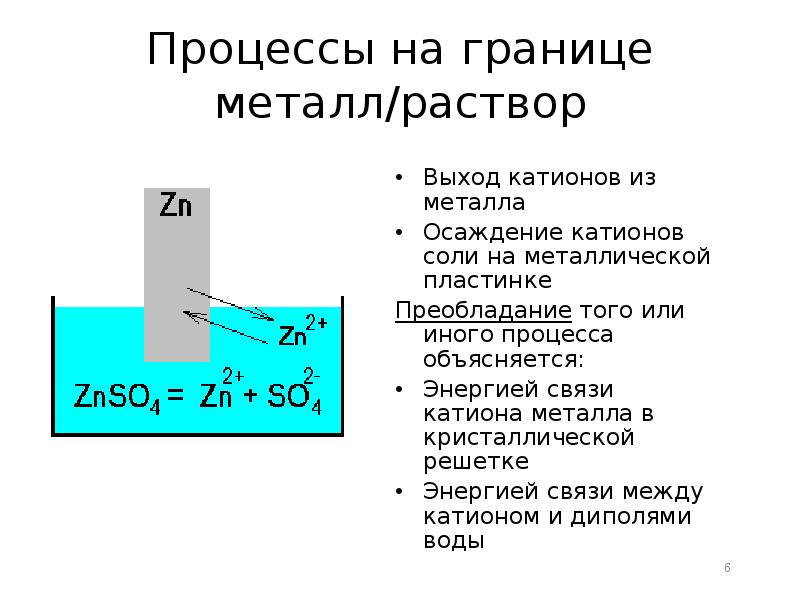
- 6. Процессы на границе металл/раствор Выход катионов из металла Осаждение катионов соли
- 7. Химически активные металлы (Zn, Mg, Al, Fe) характеризуются большими величинами растворимости.
- 8. Уравнение Нернста 2,3RT 2,3RT E = -----------
- 9. Стандартный электродный потенциал (Е°) Потенциал, возникающий на границе металл / раствор
- 10. Ряд напряжений Расположение металлов в порядке возрастания их стандартных электродных потенциалов
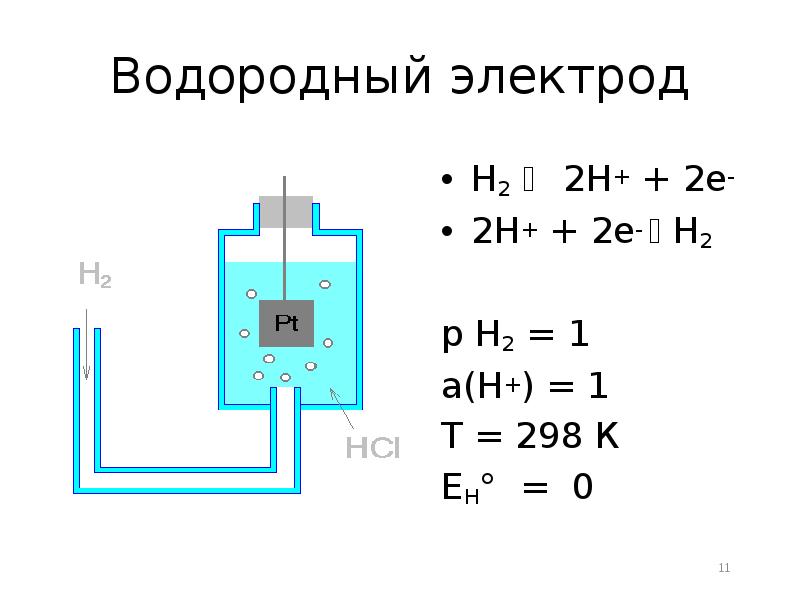
- 11. Водородный электрод H2 2H+ + 2e- 2H+ + 2e-
- 12. Недостатки стандартного водородного электрода Трудно изготавливать, сохранять и поддерживать в рабочем
- 13. Названия электродов Анод – электрод, на котором протекает реакция окисления, т.е.
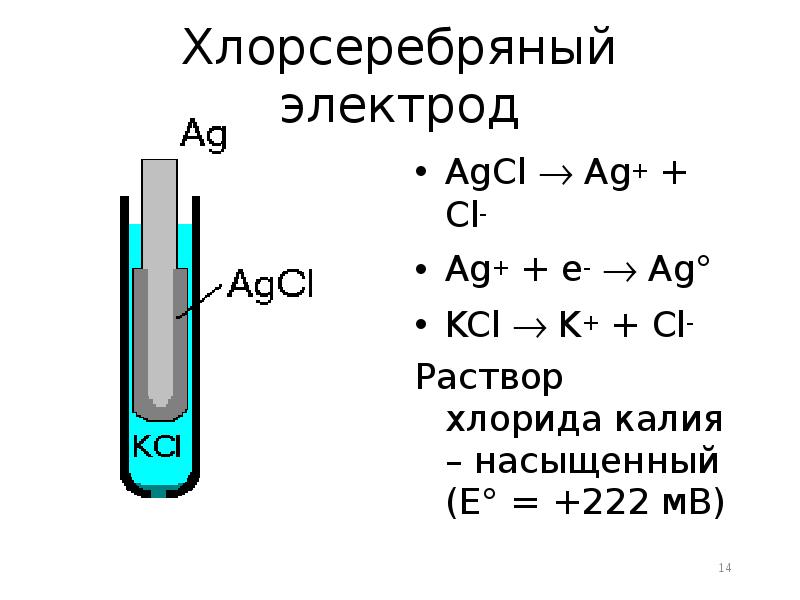
- 14. Хлорсеребряный электрод AgCl Ag+ + Cl- Ag+ + е-
- 15. Классификация электродов Электроды I типа Электродный потенциал создается на границе металл
- 16. Ионометаллические электроды 1-го рода: электроды, обратимые относительно или катиона или аниона
- 17. Окислительно-восстановительные электроды Электроды, в которых материал электрода в окислительно-восстановительном процессе не
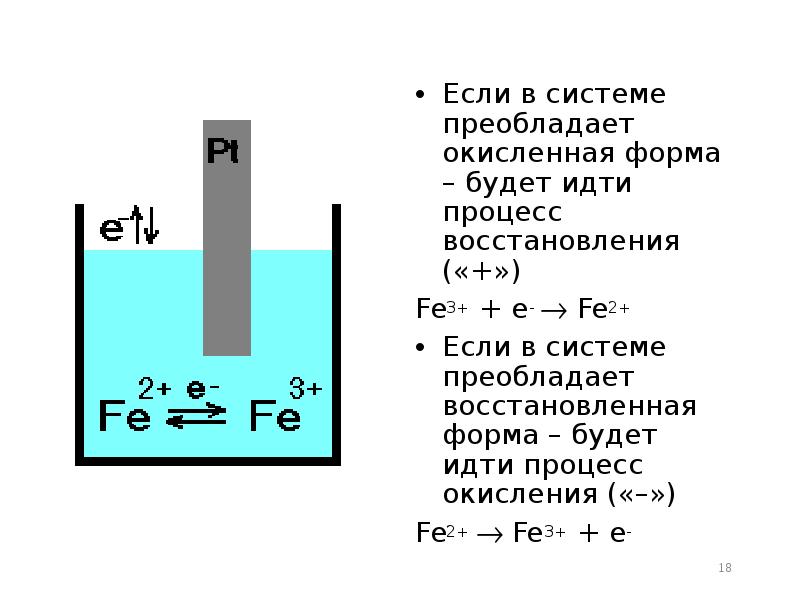
- 18. Если в системе преобладает окисленная форма – будет идти процесс восстановления
- 19. Уравнение Нернста-Петерса 0,2Т [OX] Eо-в = Е°о-в
- 20. I вида: ОХ +zе- Red I вида: ОХ +zе-
- 21. Электроды II типа Электродный потенциал возникает на границе раздела двух растворов,
- 22. Стандартные О-В потенциалы Характеризуют способность системы функционировать в качестве окислителя или
- 23. О-В системы в живых организмах 0,2Т [пируват][H+]2 Ео-в =
- 24. Весь путь биологического окисления характеризуется изменением потенциала от –0,42 до +0,81
- 25. Скачать презентацию












![Уравнение Нернста-Петерса
0,2Т [OX]
Уравнение Нернста-Петерса
0,2Т [OX]](/documents_3/319b55fb42305ad174b7aed769ee1d4c/img18.jpg)



![О-В системы в живых организмах
0,2Т [пируват][H+]2
О-В системы в живых организмах
0,2Т [пируват][H+]2](/documents_3/319b55fb42305ad174b7aed769ee1d4c/img22.jpg)

Слайды и текст этой презентации
Похожие презентации





























