Электрохимическая система презентация
Содержание
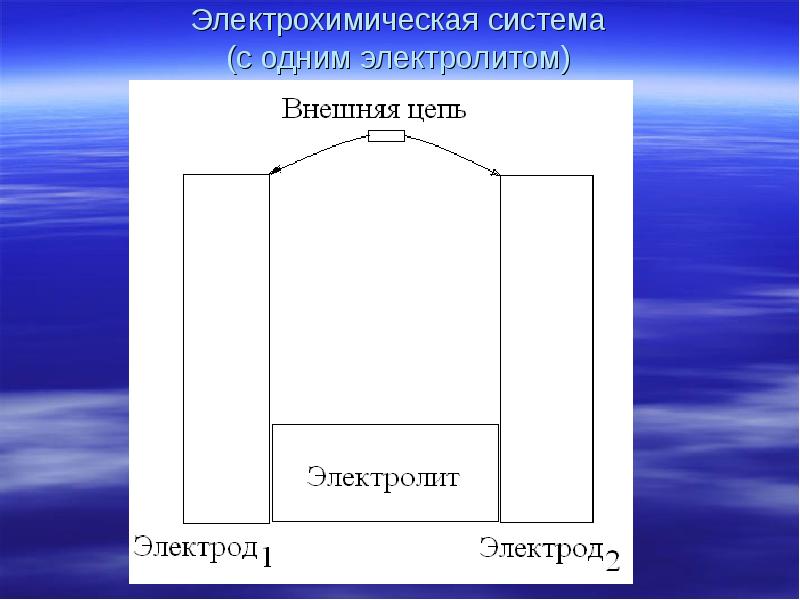
- 3. Электрохимическая система (с одним электролитом)
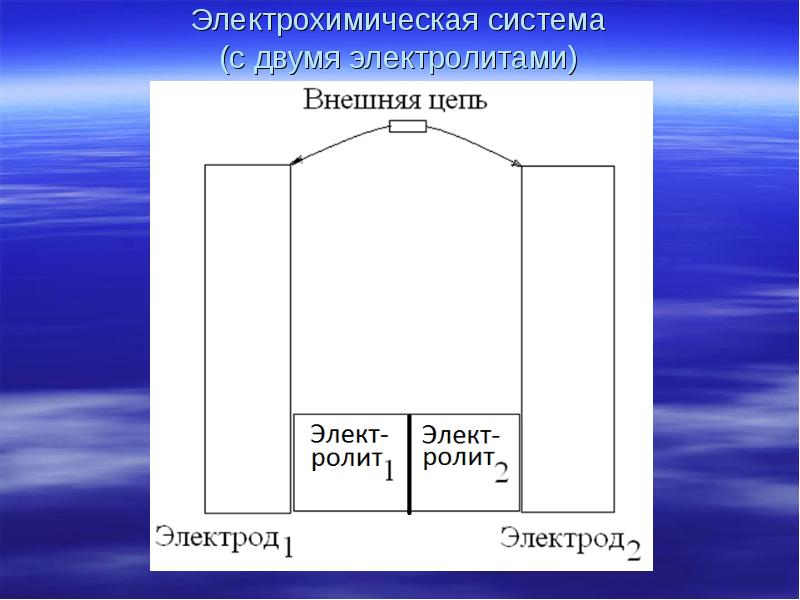
- 4. Электрохимическая система (с двумя электролитами)
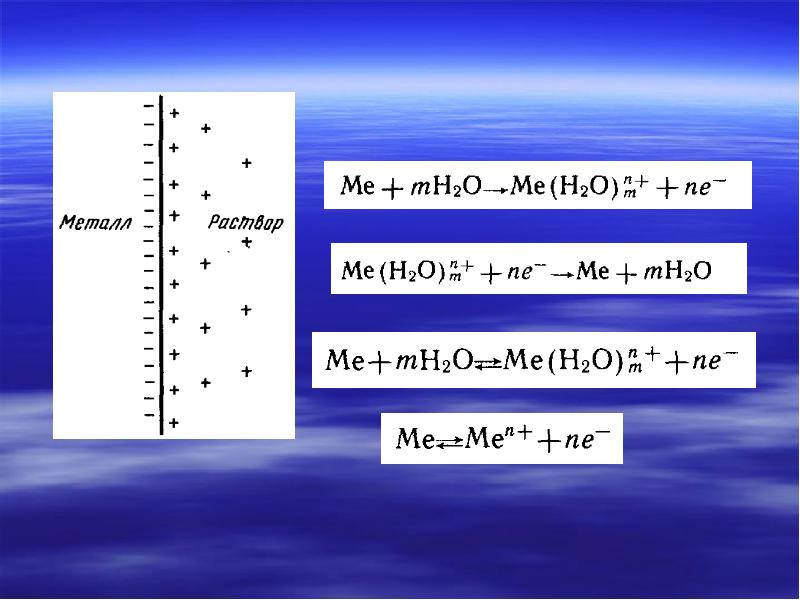
- 5. Электрохимическая схема Система с одним электролитом –
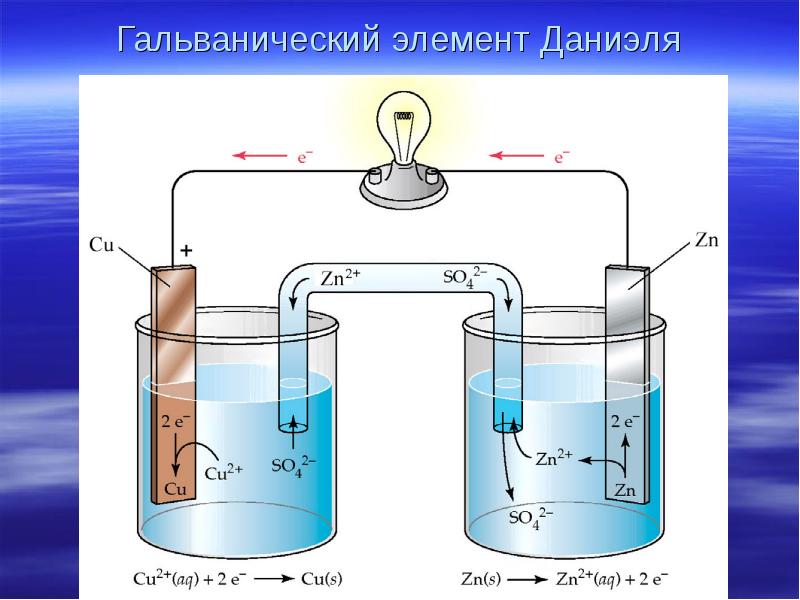
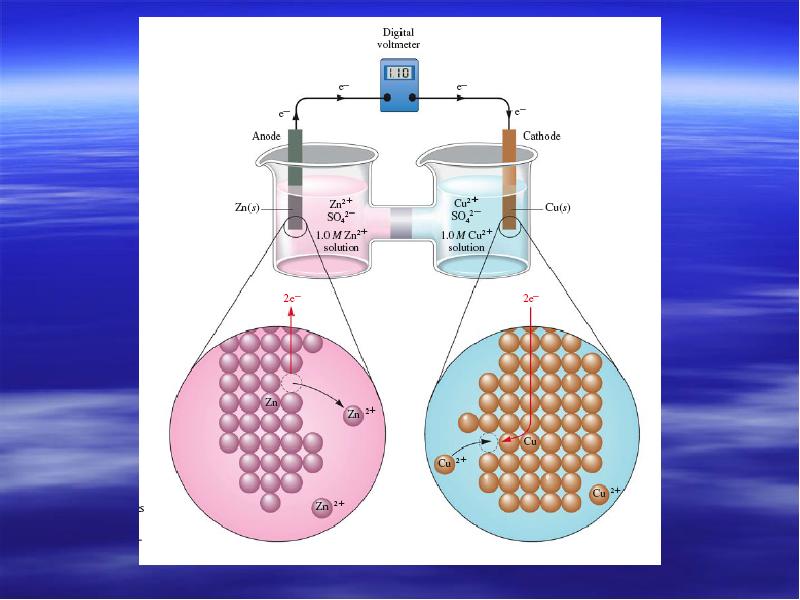
- 6. Гальванический элемент Даниэля
- 7. Электрохимические термины и процессы в гальваническом элементе Анод –
- 8. Схема: анод| электролит1 ¦¦ электролит2 | катод Полная:
- 9. Электродвижущая сила (ЭДС) – разность потенциалов (напряжение) между электродами: E =
- 10. Измерения электродных потенциалов E = φкатода –
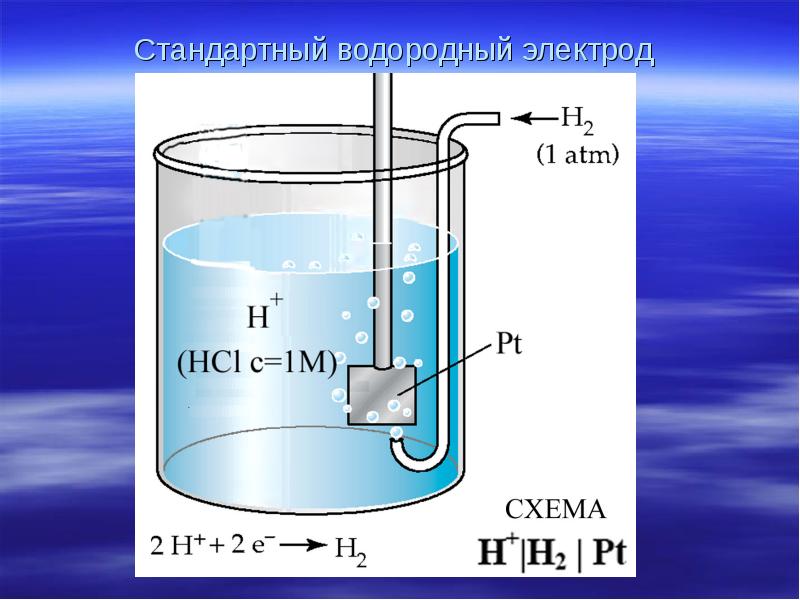
- 11. Стандартный водородный электрод
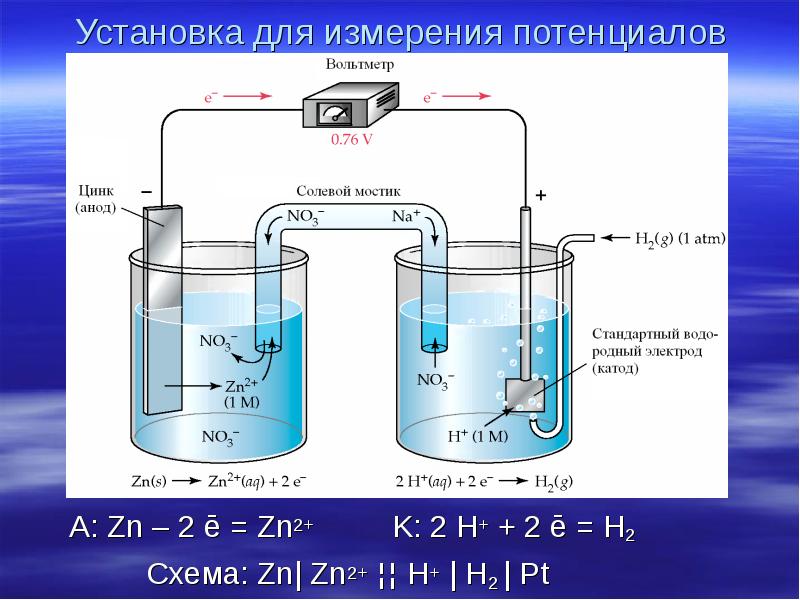
- 12. Установка для измерения потенциалов A: Zn – 2 ē =
- 13. Стандартный электродный потенциал Измеряется Е = φэлектрод – φСВЭ =
- 15. Ряд напряжений металлов
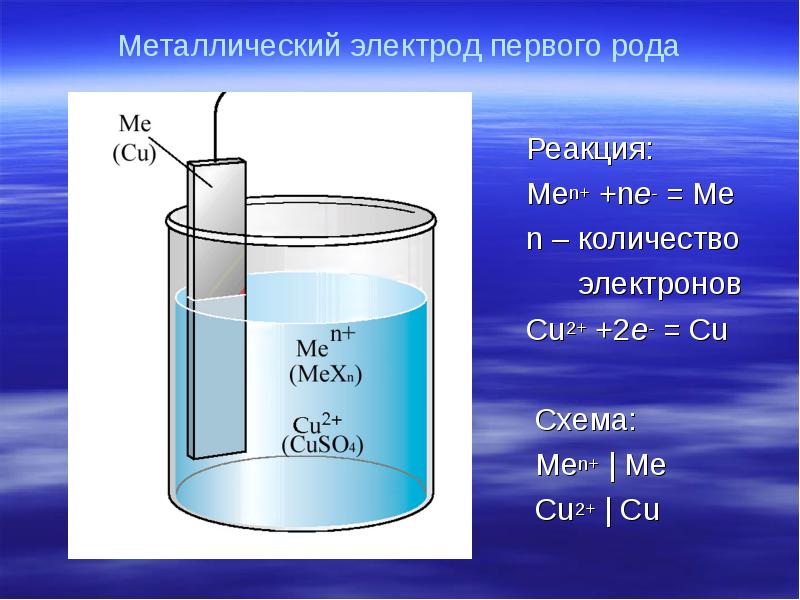
- 17. Металлический электрод первого рода Реакция: Men+ +ne- = Me n –
- 18. Зависимость Е от с - уравнение Нернста F – число Фарадея
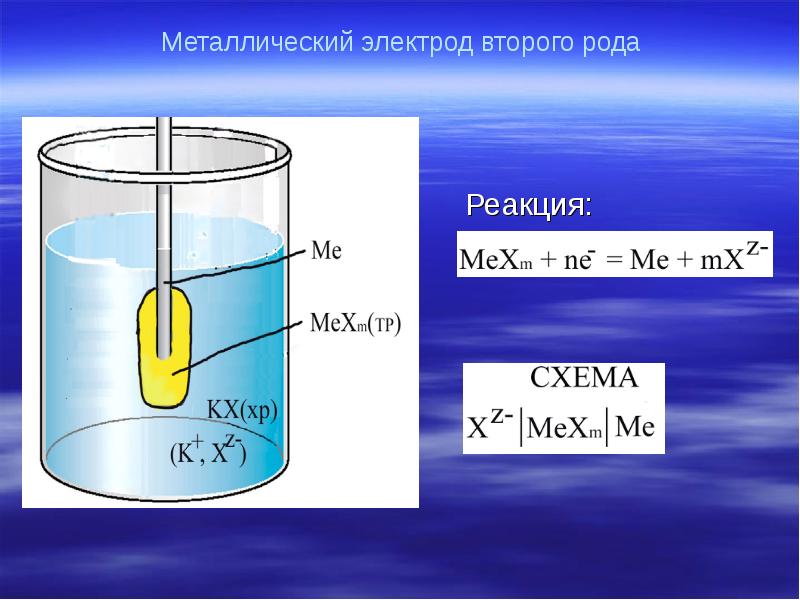
- 19. Металлический электрод второго рода
- 20. Уравнение потенциала:
- 21. хлорсеребряный электрод Ag AgCl Cl- AgCl +
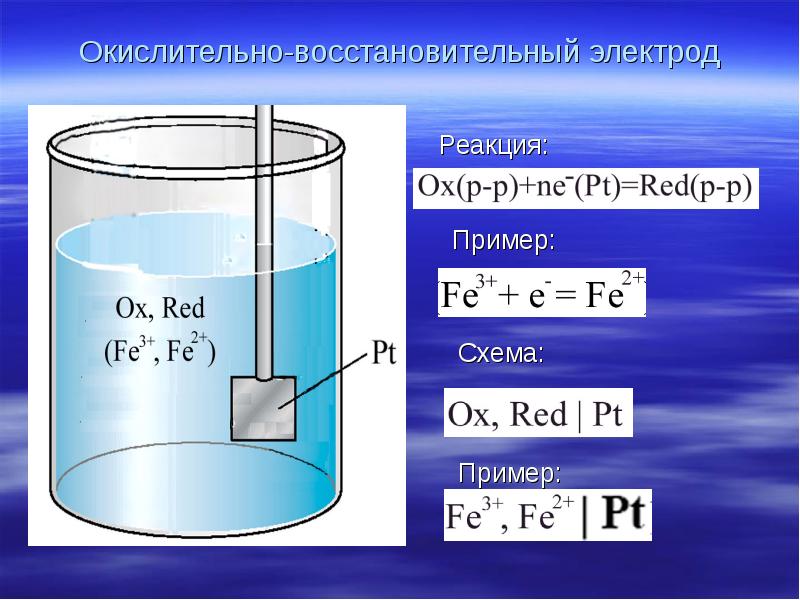
- 22. Окислительно-восстановительный электрод
- 23. Уравнение потенциала
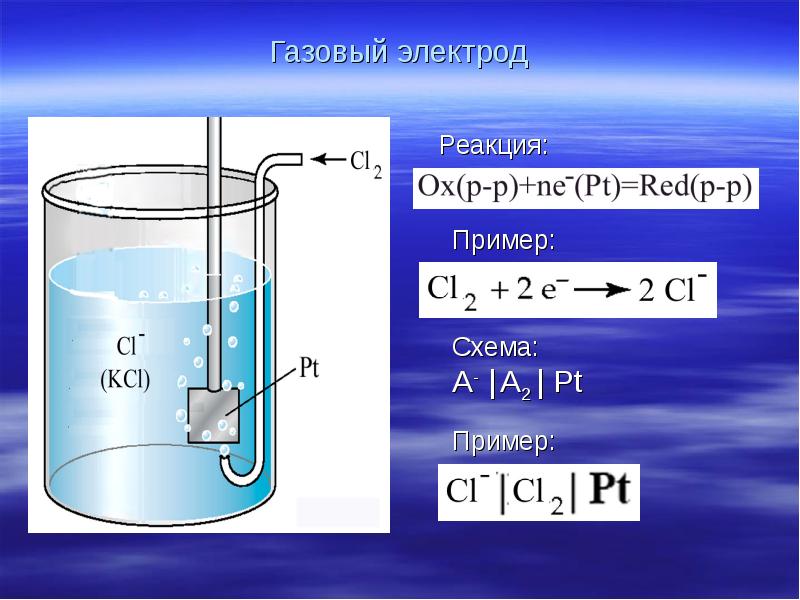
- 24. Газовый электрод
- 25. Уравнение потенциала
- 28. каломельный электрод Hg Hg2Cl2 Cl- Hg2Cl2 + 2 ē
- 29. Скачать презентацию

















Слайды и текст этой презентации
Похожие презентации





























