Электрохимия. Гальванические цепи. (Лекция 6.2) презентация
Содержание
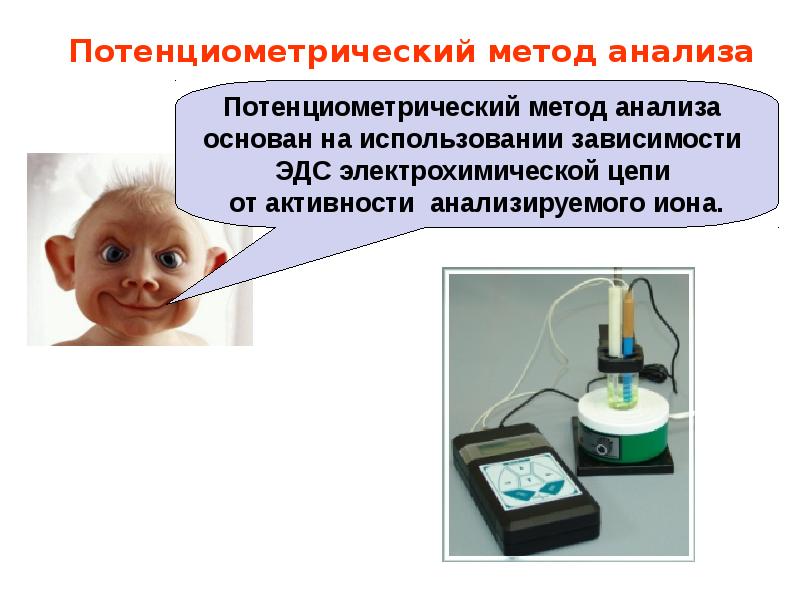
- 3. Потенциометрический метод анализа
- 4. Потенциометрический метод анализа
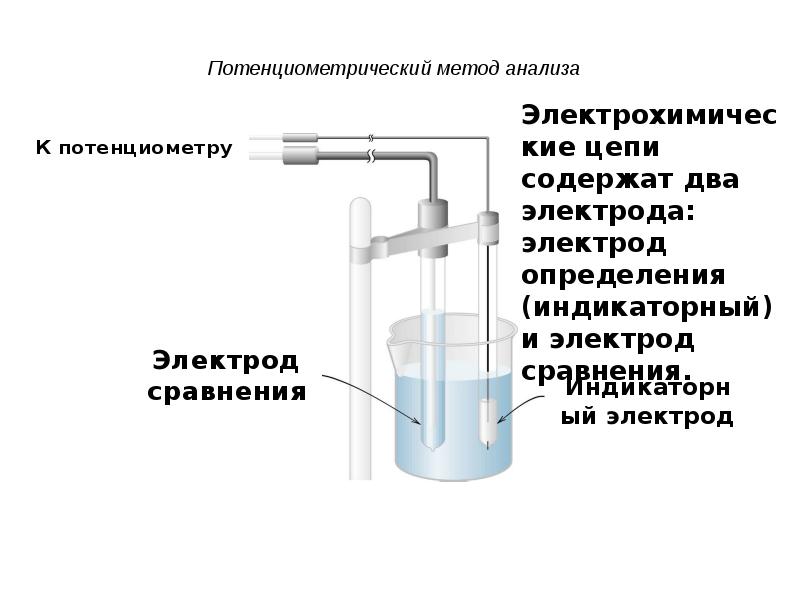
- 7. Потенциометрический метод анализа
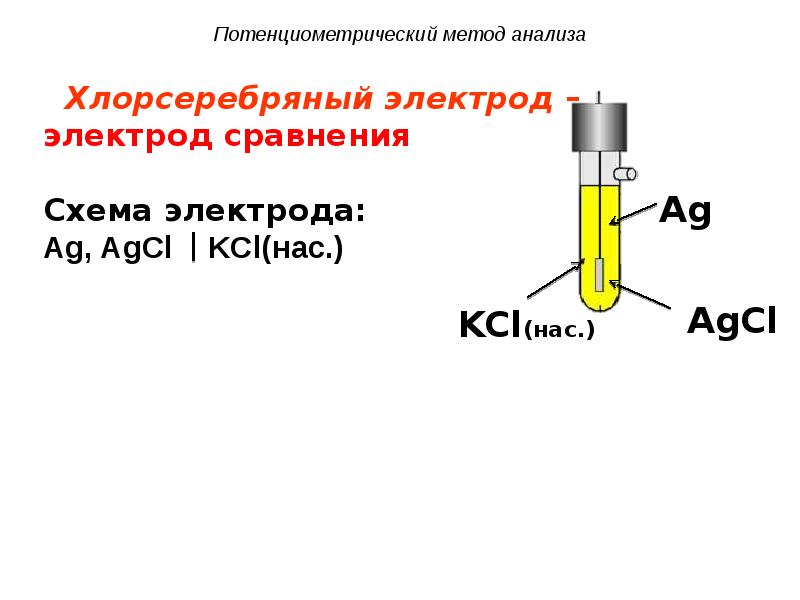
- 8. Потенциометрический метод анализа
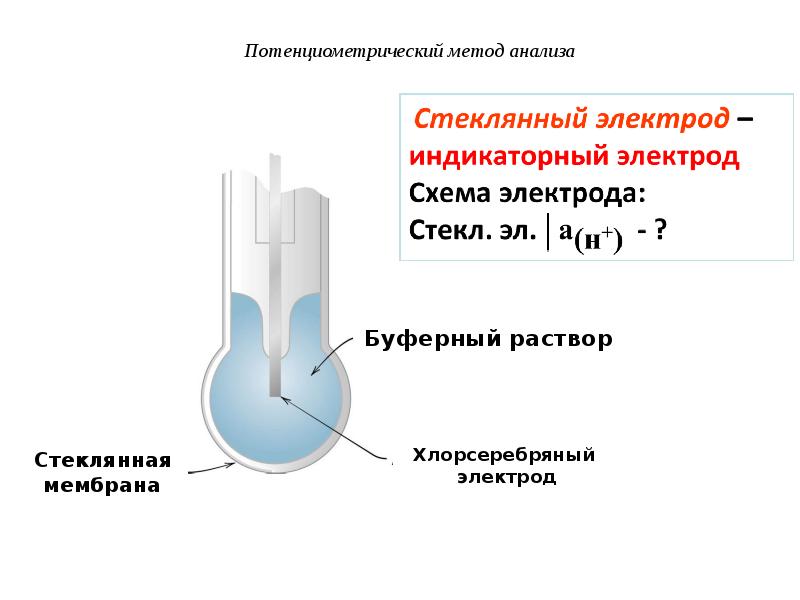
- 9. Потенциометрический метод анализа
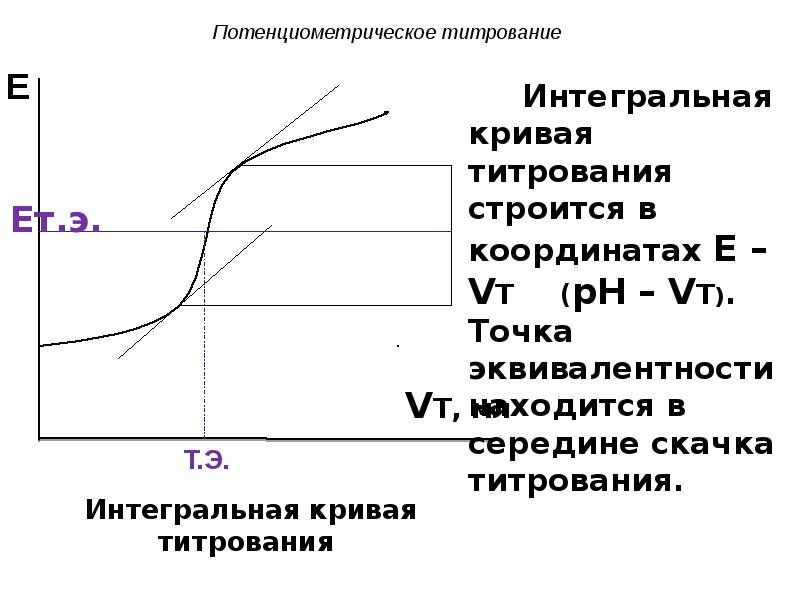
- 10. Потенциометрическое титрование
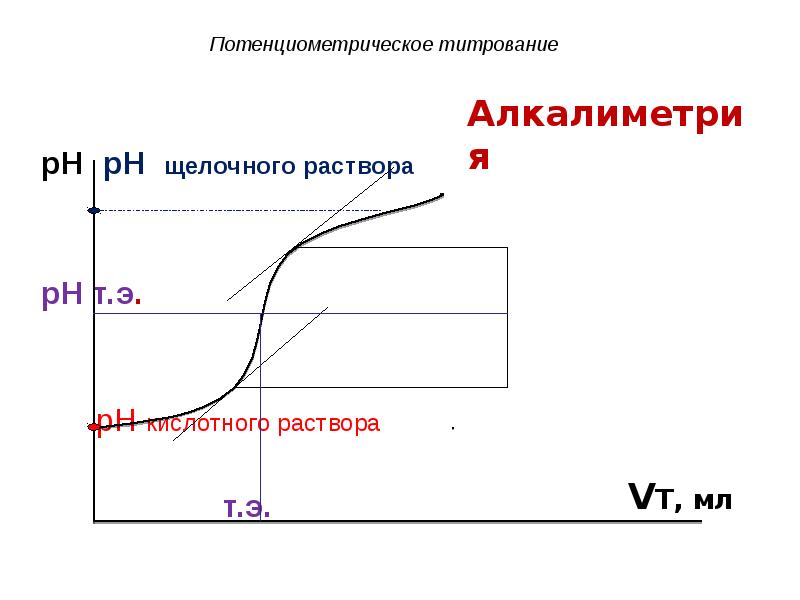
- 11. Потенциометрическое титрование pH pH щелочного раствора pH т.э. pH кислотного
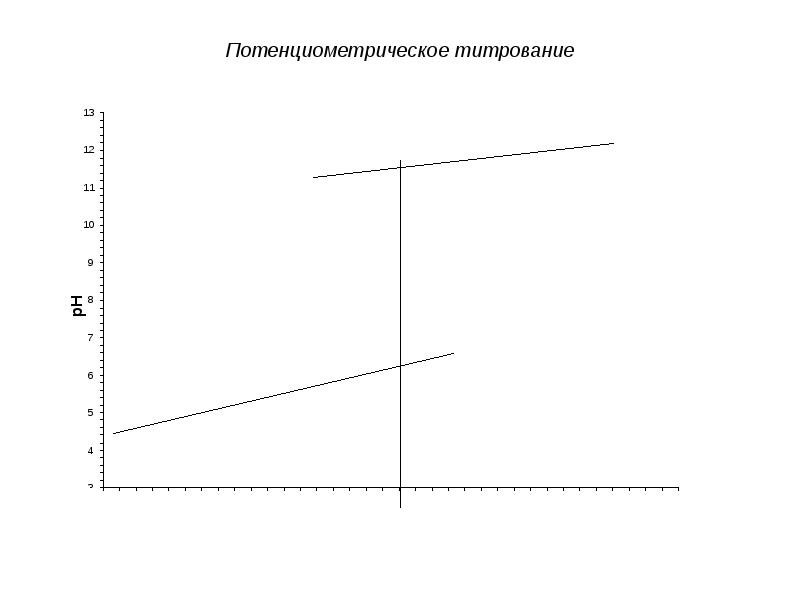
- 12. Потенциометрическое титрование
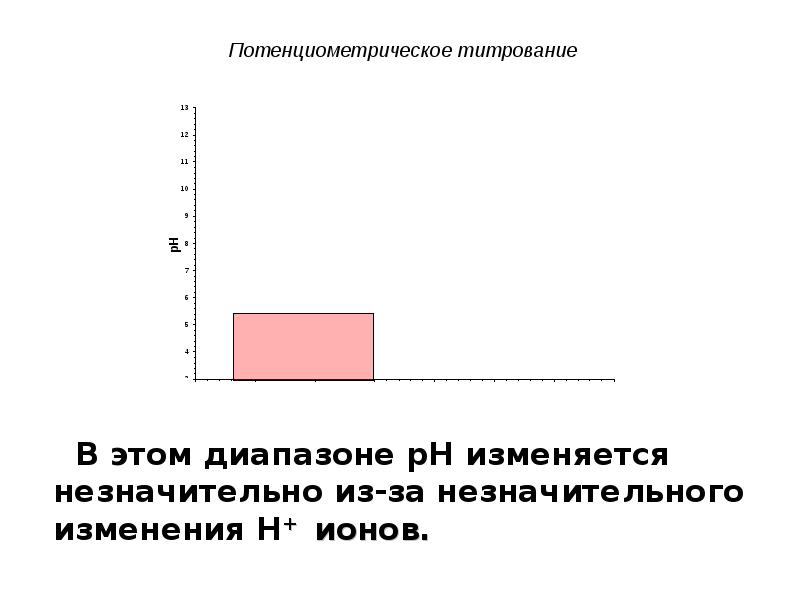
- 13. Потенциометрическое титрование
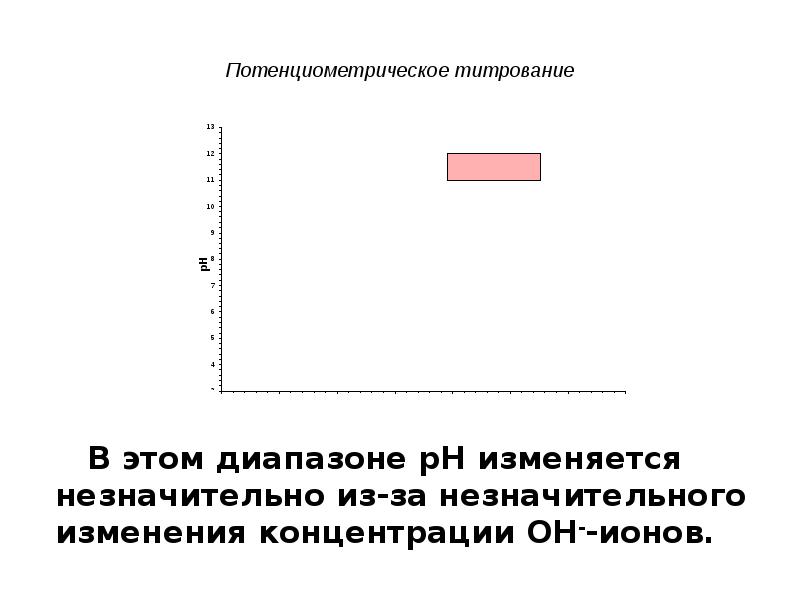
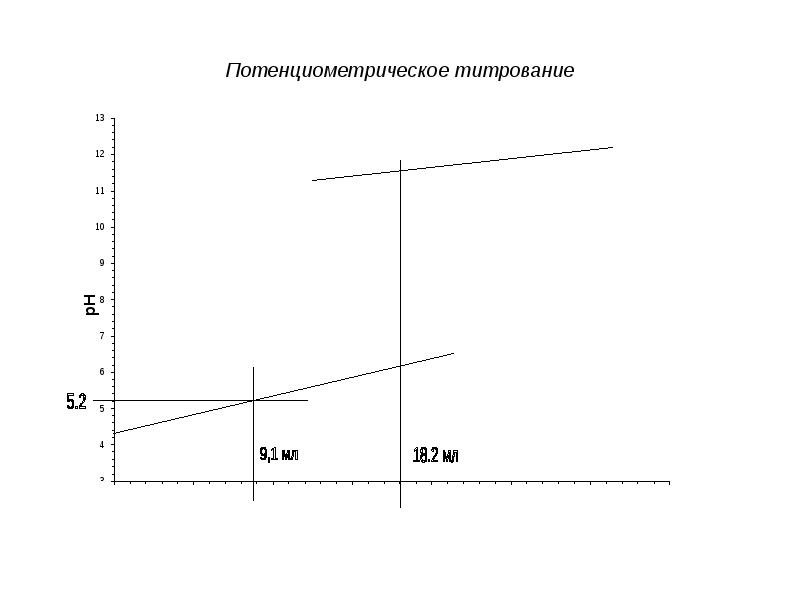
- 14. Потенциометрическое титрование
- 15. Потенциометрическое титрование
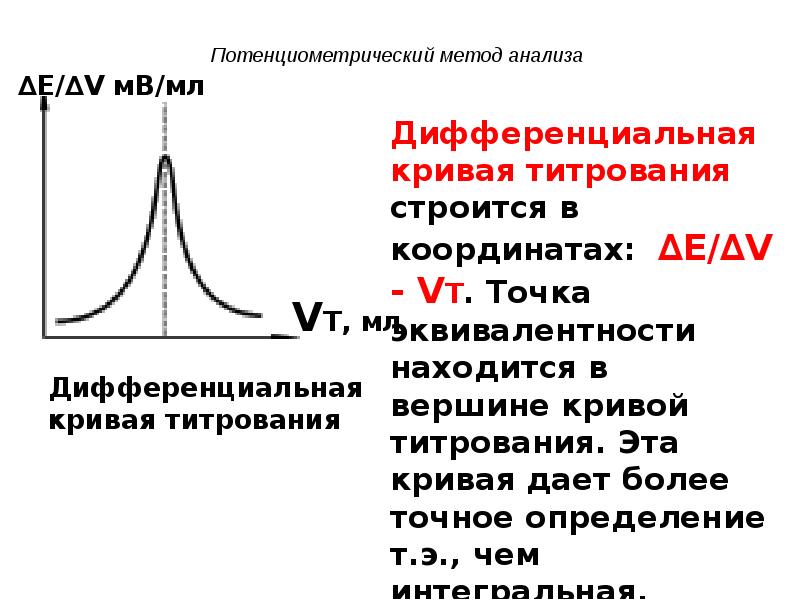
- 16. Потенциометрическое титрование
- 17. Потенциометрическое титрование
- 18. Потенциометрический метод анализа
- 19. Потенциометрический метод анализа
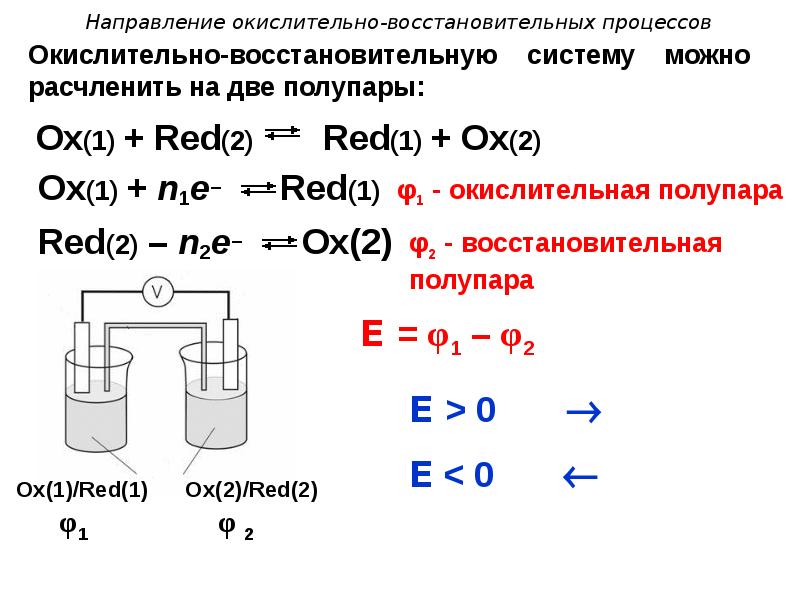
- 20. Направление окислительно-восстановительных процессов
- 21. Направление окислительно-восстановительных процессов Оx(1) + Red(2) Red(1) + Оx(2)
- 22. Направление окислительно-восстановительных процессов Часто вместо таких полупар рассматривают две полуреакции,
- 23. Направление окислительно-восстановительных процессов
- 24. Направление окислительно-восстановительных процессов Оx + Н2 Red + 2Н+
- 25. Направление окислительно-восстановительных процессов
- 26. Направление окислительно-восстановительных процессов
- 27. Ряд red-ox потенциалов: Ряд red-ox потенциалов: Полуреакция
- 28. Направление окислительно-восстановительных процессов Например: Сd2+ + 2e- Cd0,
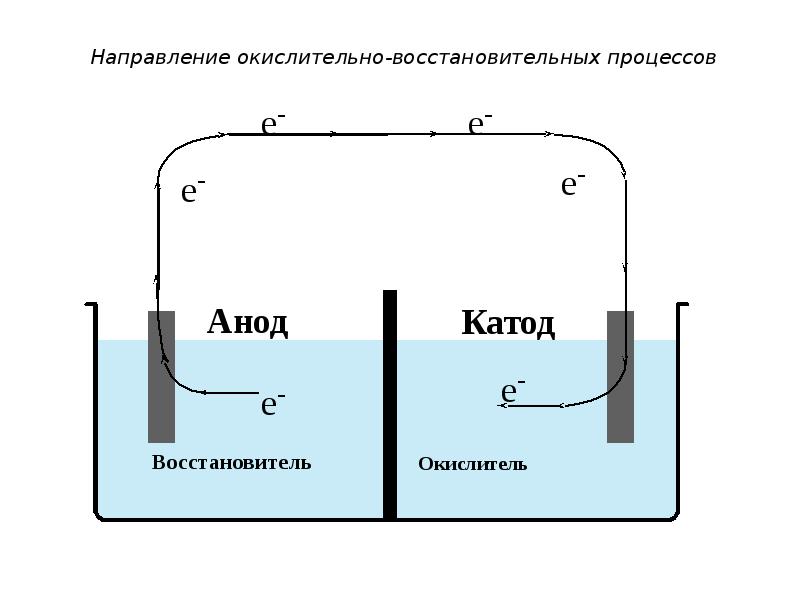
- 29. Направление окислительно-восстановительных процессов Первая система является системой восстановителя. На этом электроде
- 30. Направление окислительно-восстановительных процессов Суммарное уравнение реакции: Cd0 - 2e-
- 31. Направление окислительно-восстановительных процессов Гальваническая цепь: Cd0 Сd2+ IO3-, H+ Pt
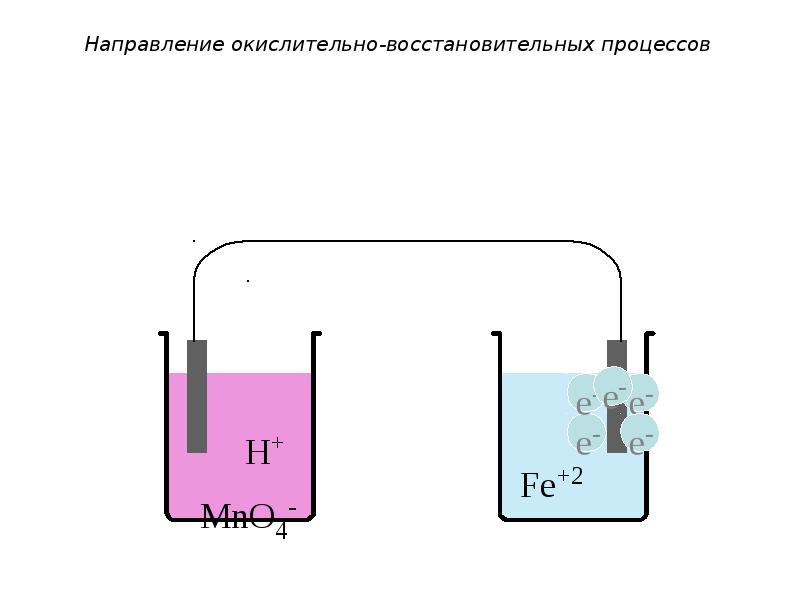
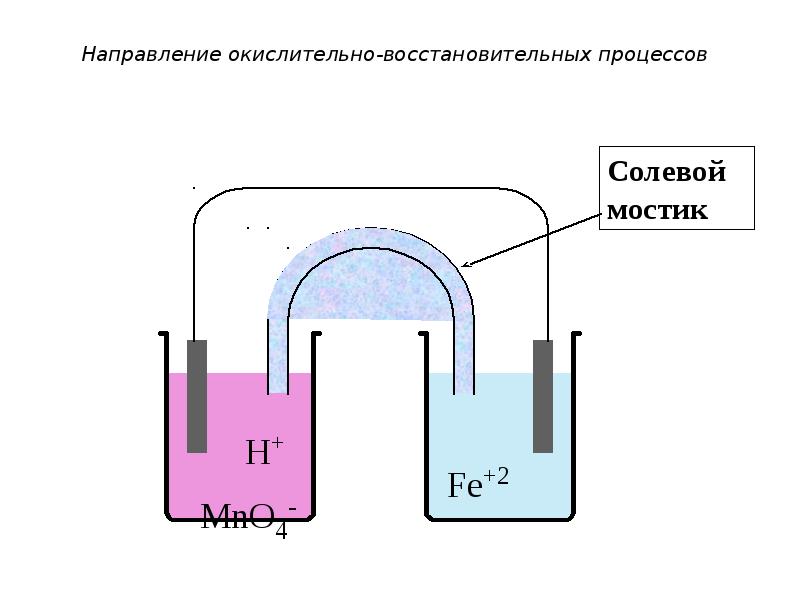
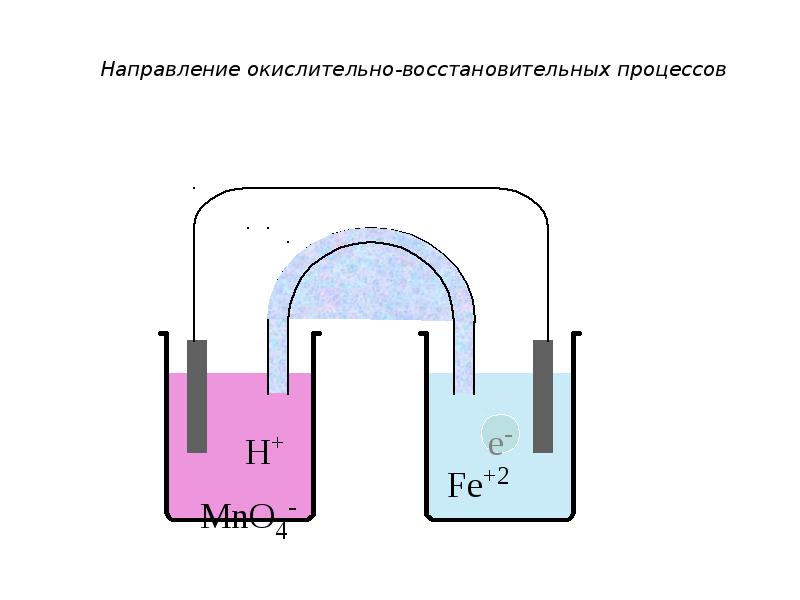
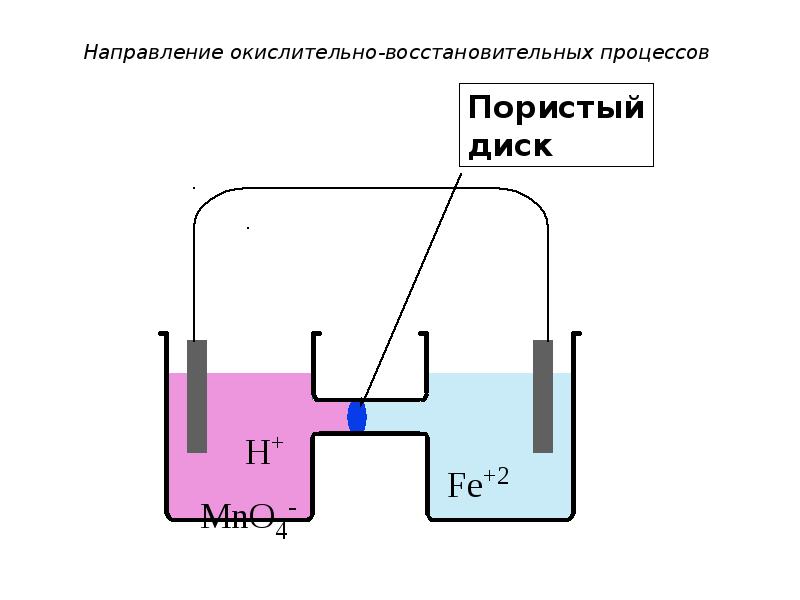
- 33. Направление окислительно-восстановительных процессов Например: MnO4- + 8H+ + 5e-
- 35. Направление окислительно-восстановительных процессов
- 39. Направление окислительно-восстановительных процессов Первая система является системой окислителя. На этом электроде
- 40. Направление окислительно-восстановительных процессов Суммарное уравнение реакции: MnO4- + 8H+ +
- 41. Направление окислительно-восстановительных процессов
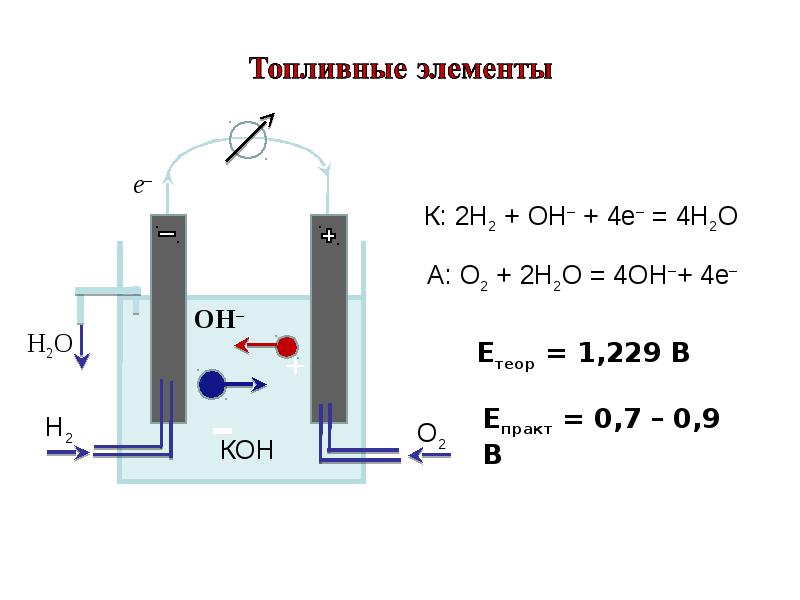
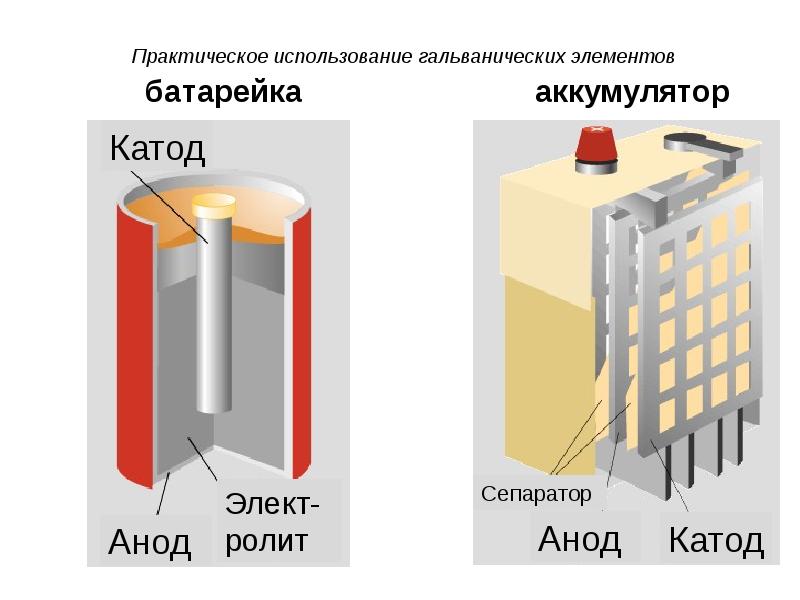
- 44. Практическое использование гальванических элементов
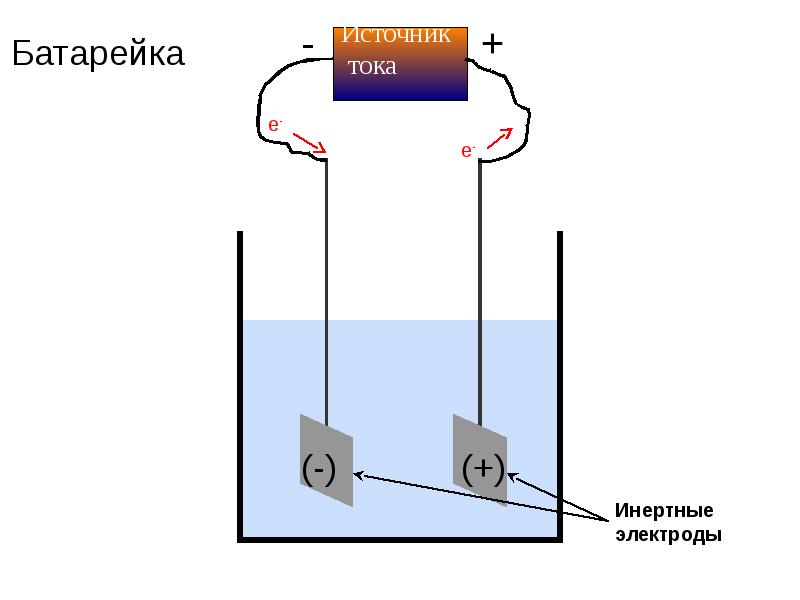
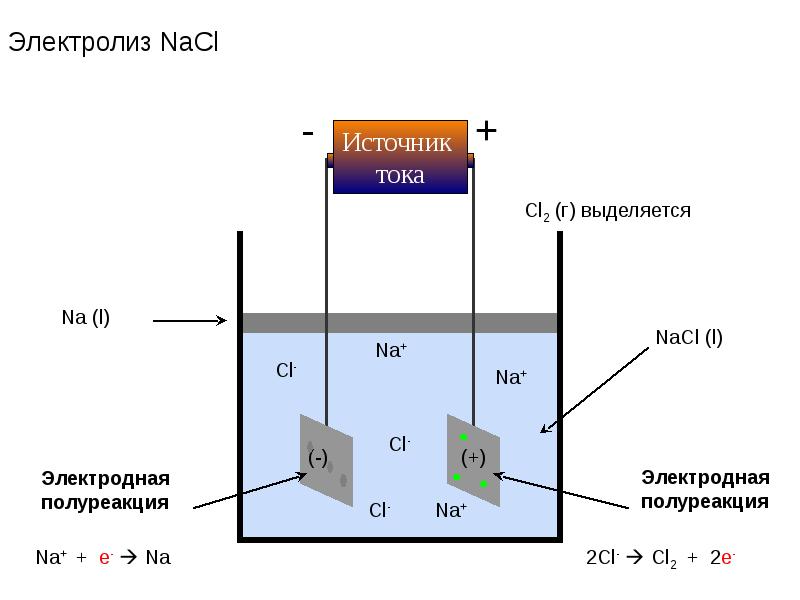
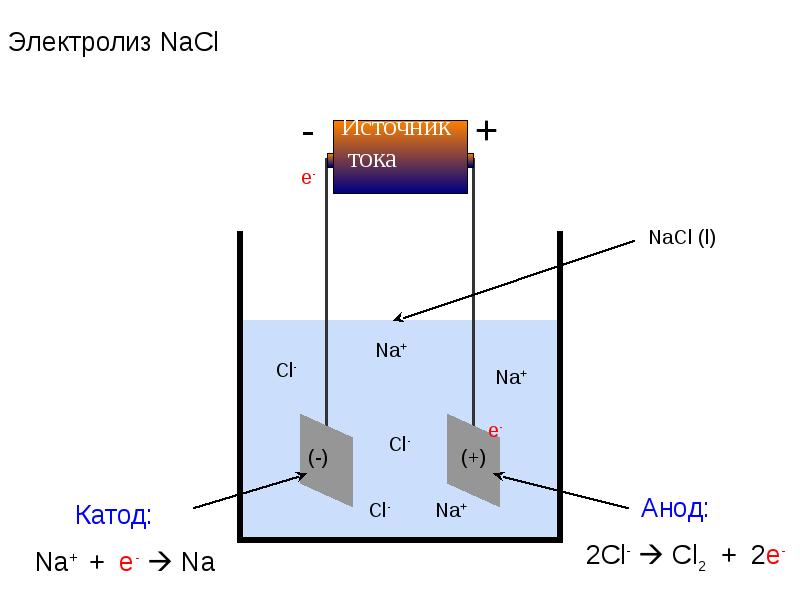
- 46. Химические процессы при электролизе расплава хлорида натрия, NaCl?
- 49. Электродные процессы Катод (-) ВОССТАНОВЛЕНИЕ Na+ + e- Na
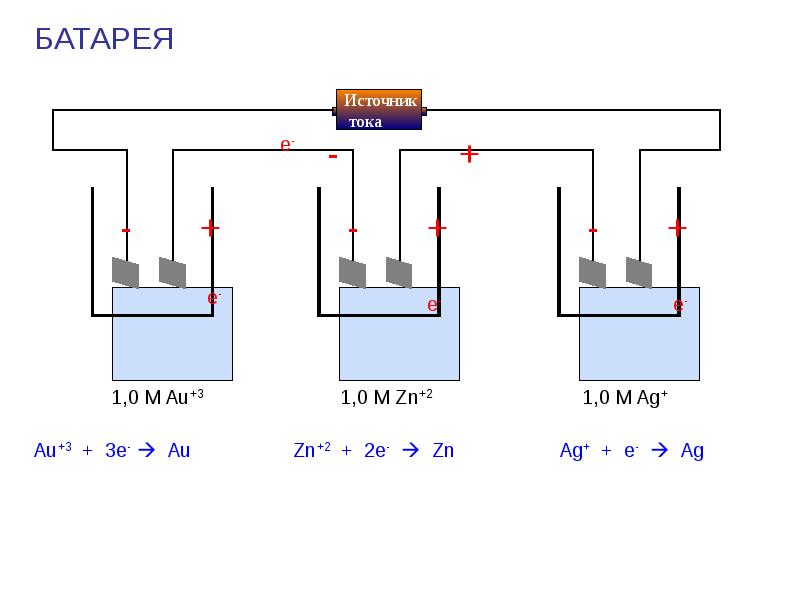
- 50. БАТАРЕЯ БАТАРЕЯ
- 51. Вопросы для самоконтроля
- 52. БЛАГОДАРЮ ЗА ВАШЕ ВНИМАНИЕ!
- 53. Скачать презентацию



























Слайды и текст этой презентации
Скачать презентацию на тему Электрохимия. Гальванические цепи. (Лекция 6.2) можно ниже:
Похожие презентации