Электрохимия. Понятие электрохимии. Электроды. Гальванические цепи. Окислительно-восстановительные электроды. (Лекция 6.1) презентация
Содержание
- 2. ЦЕЛИ ЛЕКЦИИ ЦЕЛИ ЛЕКЦИИ ОБУЧАЮЩАЯ: сформировать знания об основах электрохимии,
- 5. Электродный потенциал
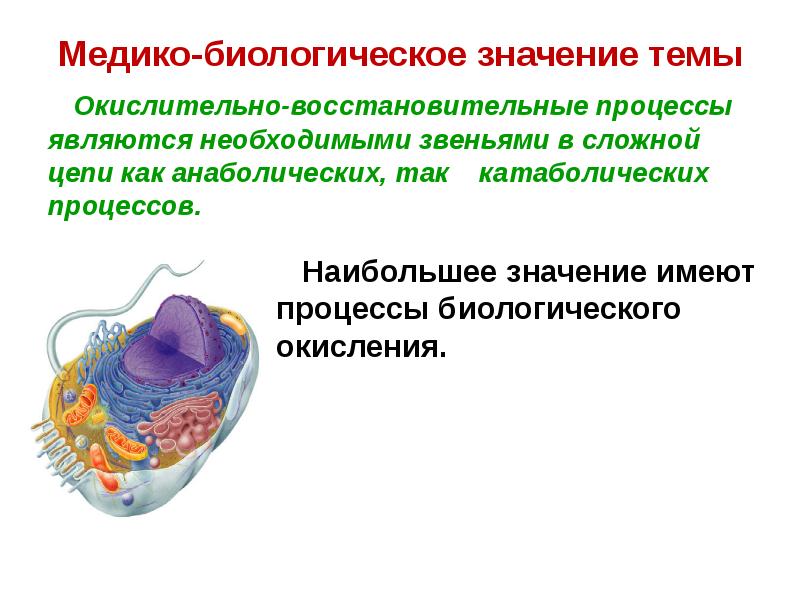
- 6. Медико-биологическое значение темы Окислительно-восстановительные процессы являются необходимыми звеньями в
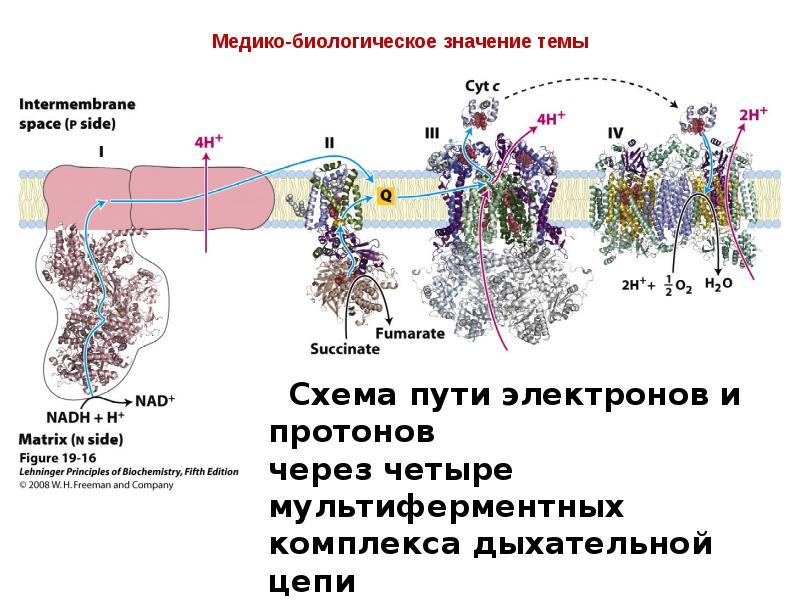
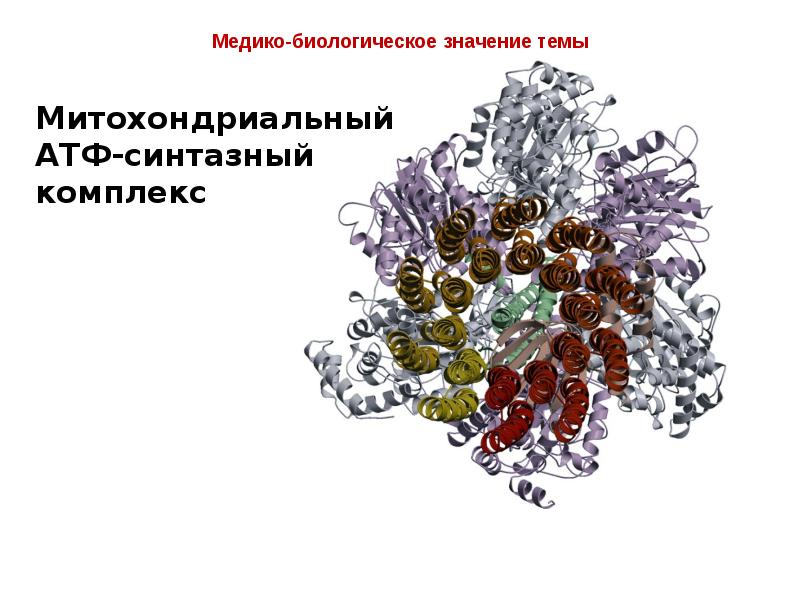
- 7. Медико-биологическое значение темы В митохондриях окисление происходит в результате
- 8. Медико-биологическое значение темы На трех таких стадиях разность потенциалов
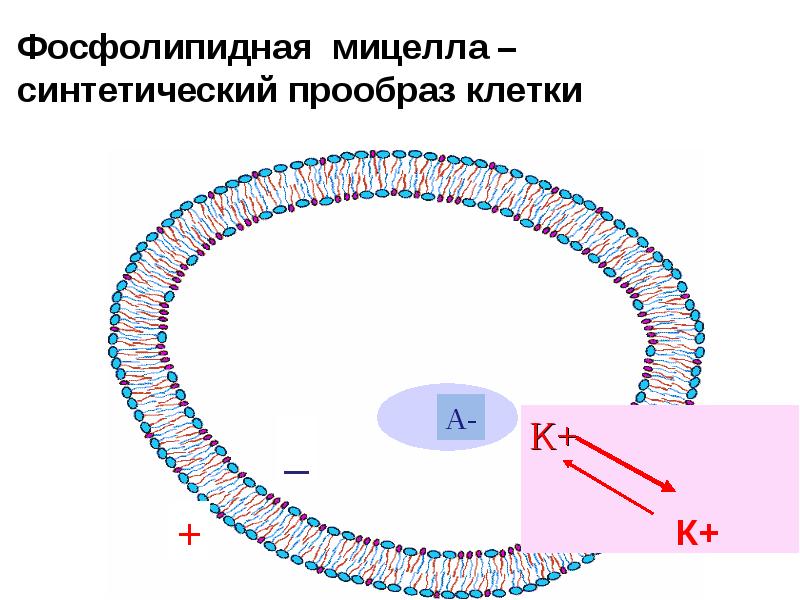
- 15. Фосфолипидная мицелла – синтетический прообраз клетки
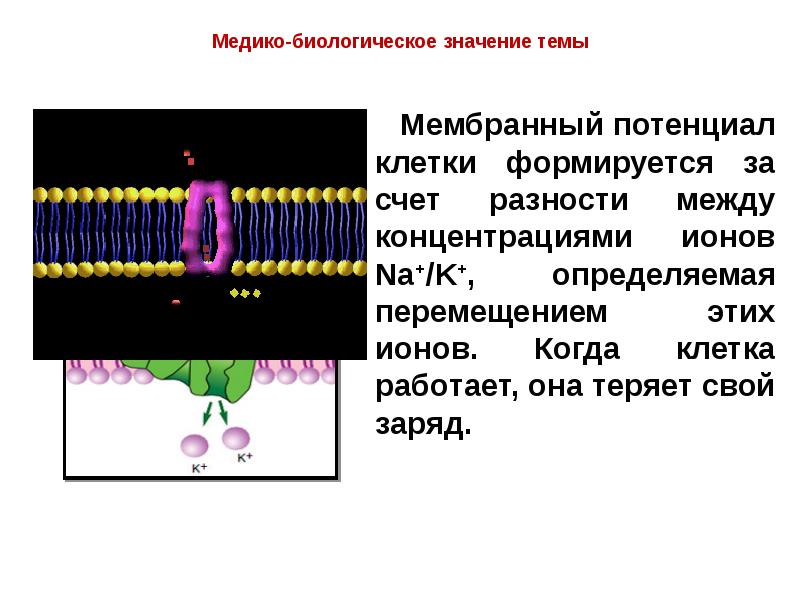
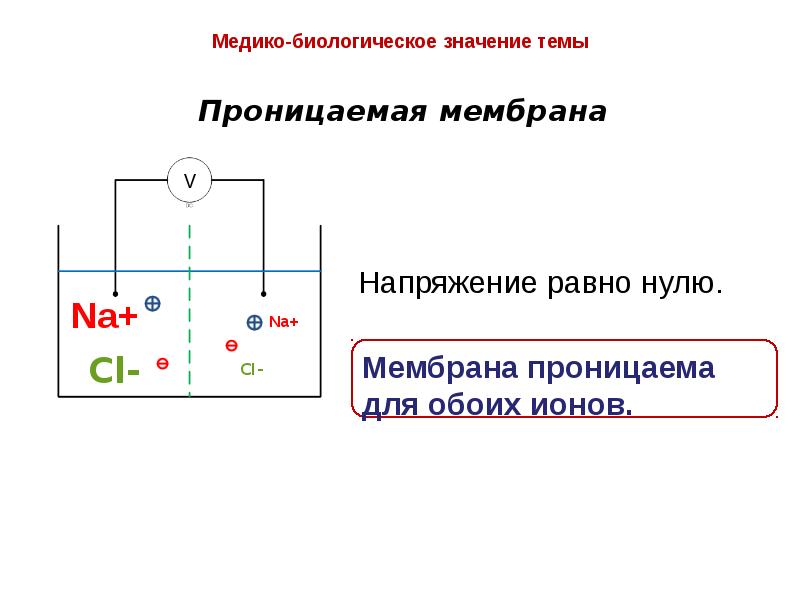
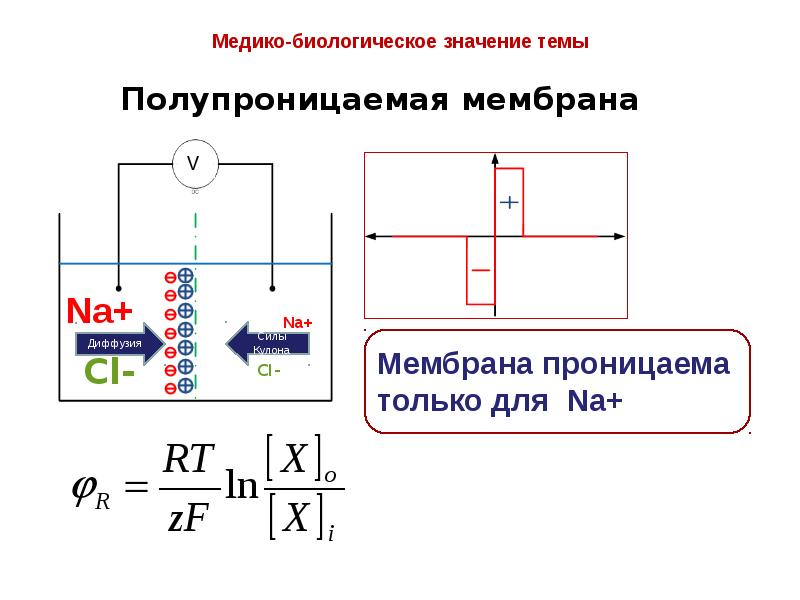
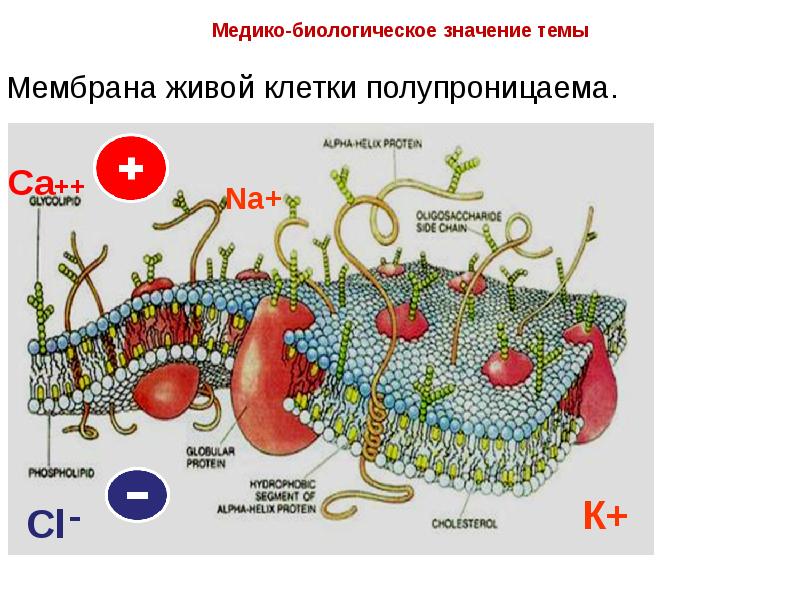
- 16. Мембрана живой клетки полупроницаема.
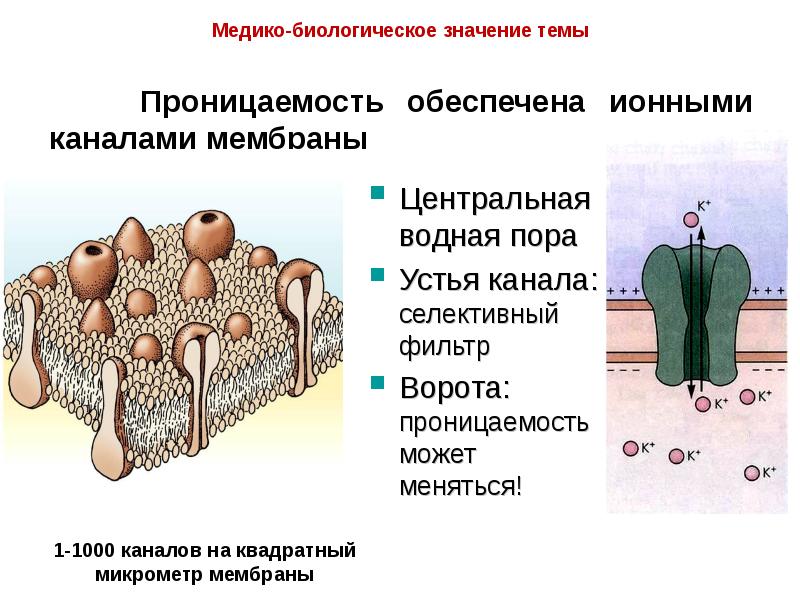
- 17. Проницаемость обеспечена ионными каналами мембраны
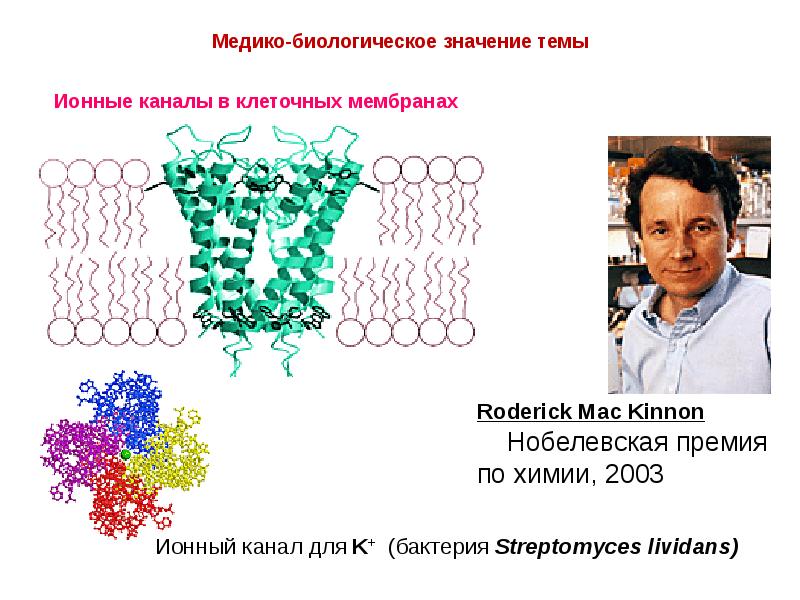
- 18. Нобелевская премия 1991 г. в области физиологии и медицины
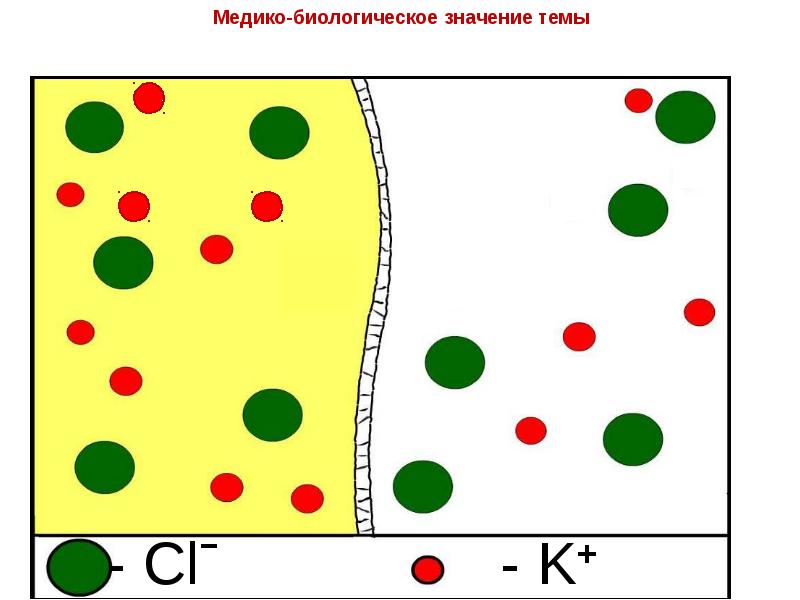
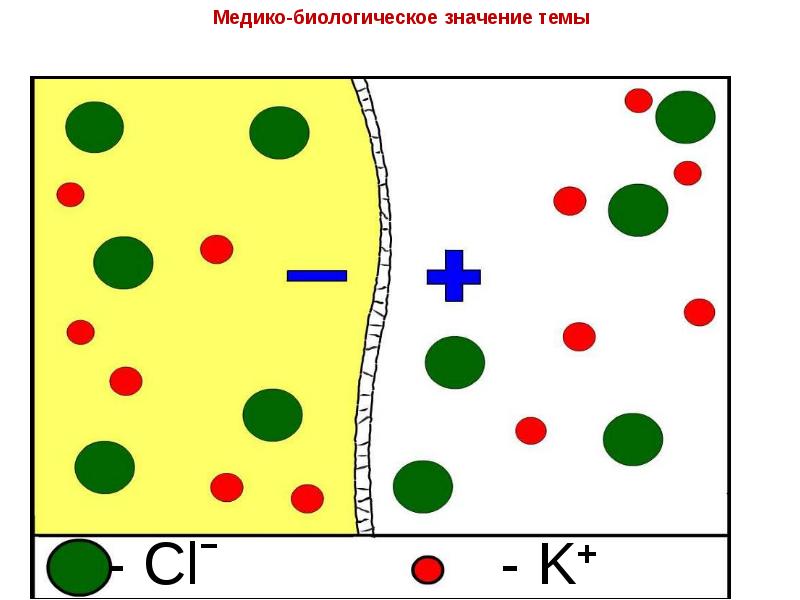
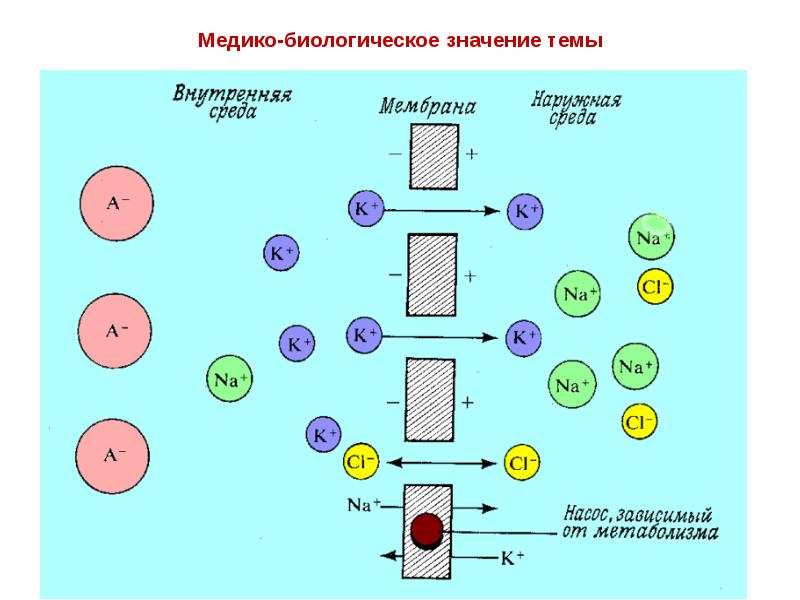
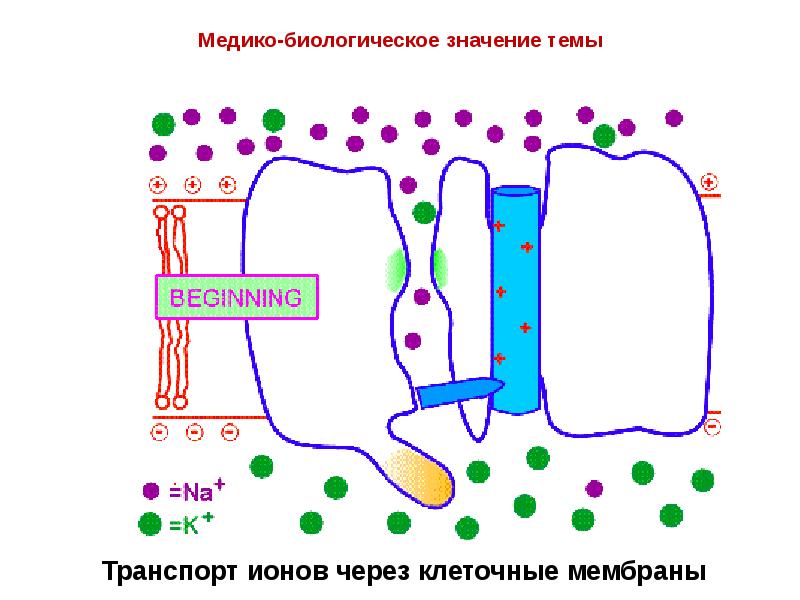
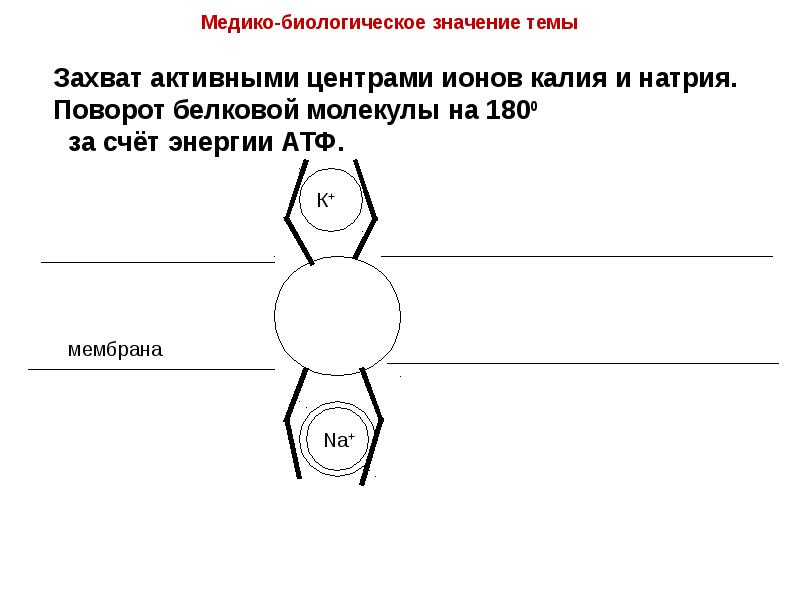
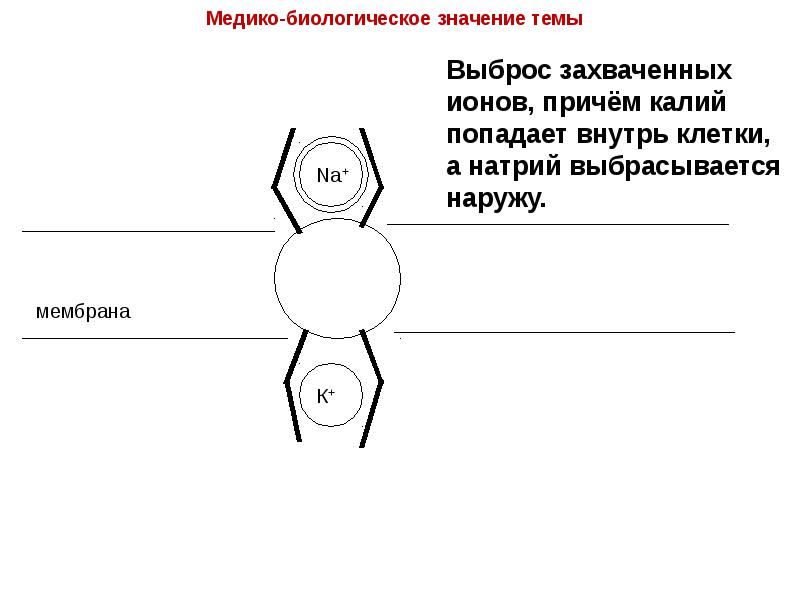
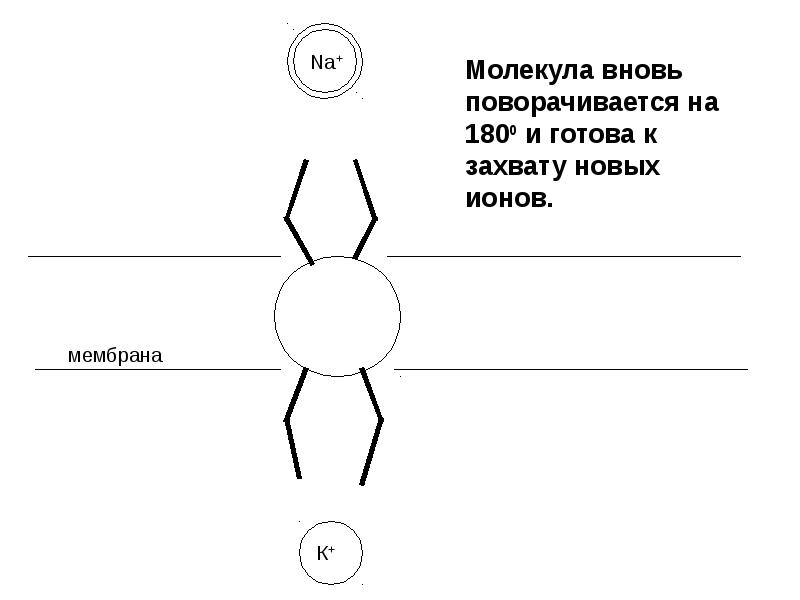
- 23. Транспорт ионов через клеточные мембраны
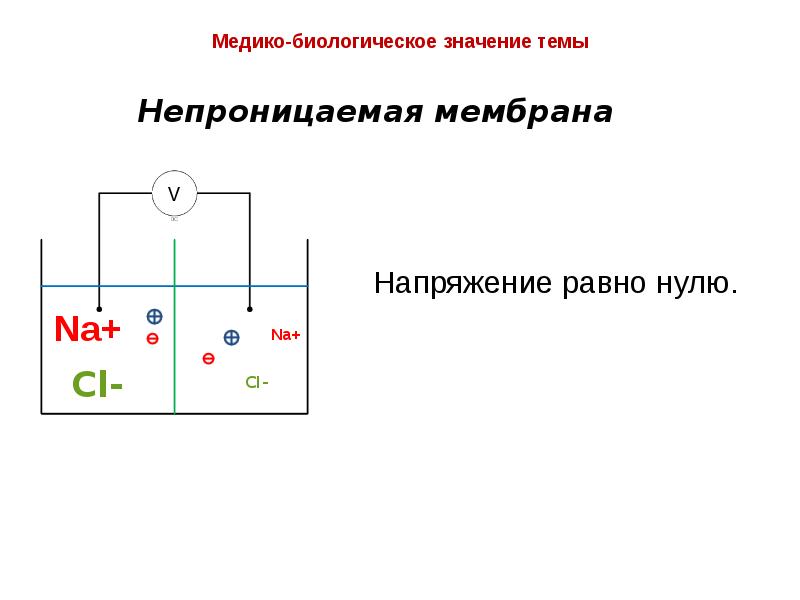
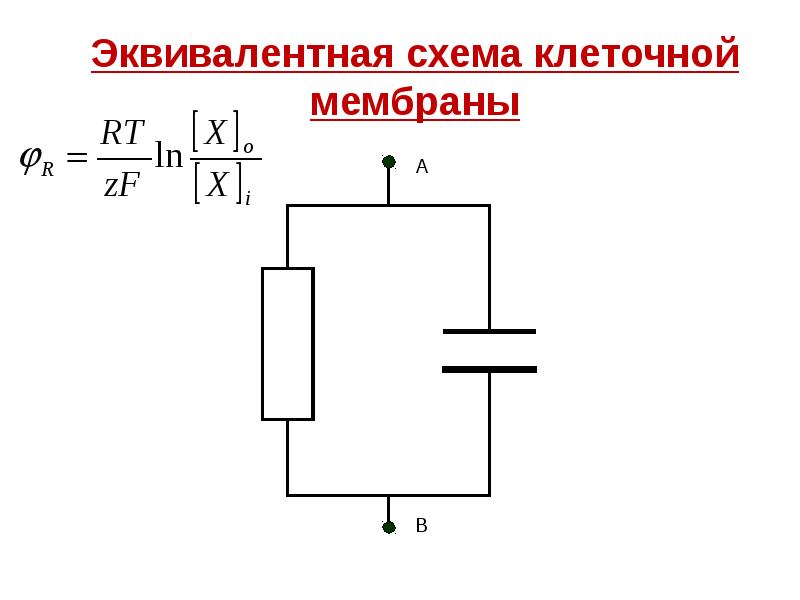
- 27. Эквивалентная схема клеточной мембраны
- 28. Медико-биологическое значение темы
- 29. Медико-биологическое значение темы Свойства фармацевтических препаратов находятся в непосредственной
- 30. Медико-биологическое значение темы
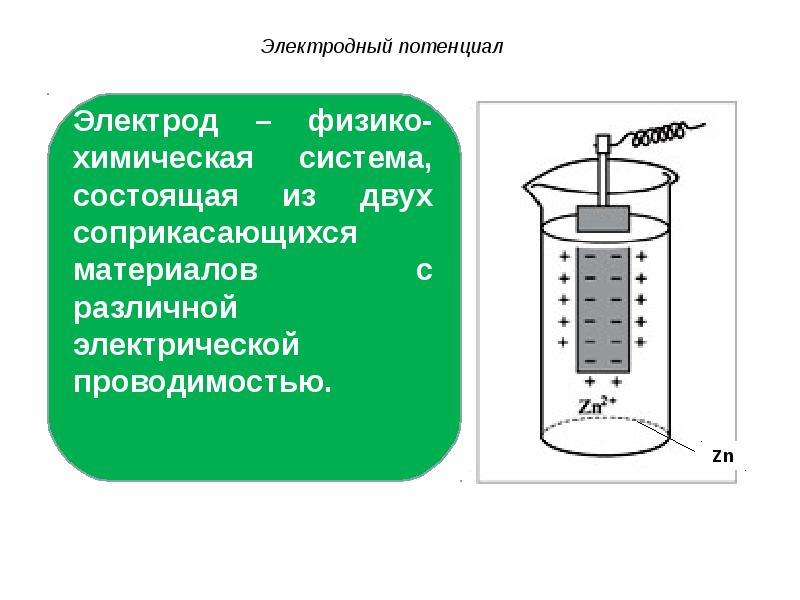
- 31. Электродный потенциал
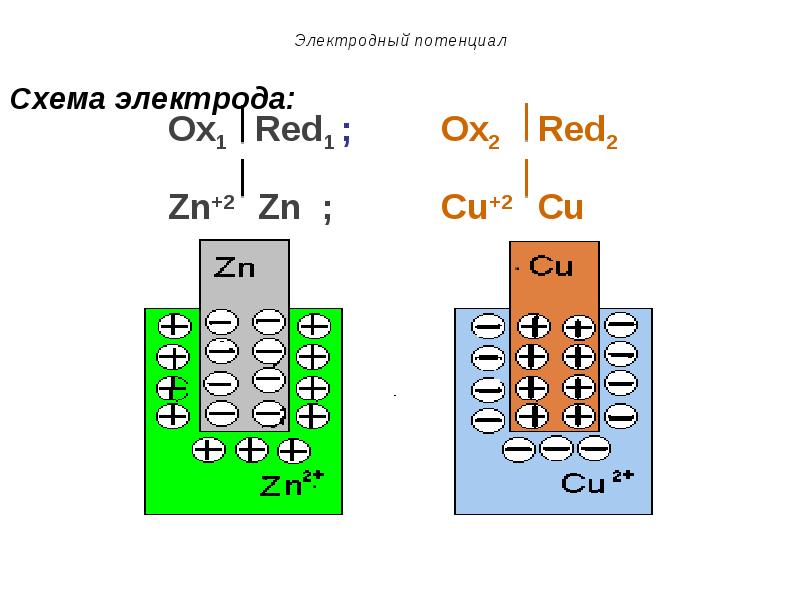
- 32. Электродный потенциал Схему электрода изображают в виде вертикальной черты, которая
- 34. Электродный потенциал
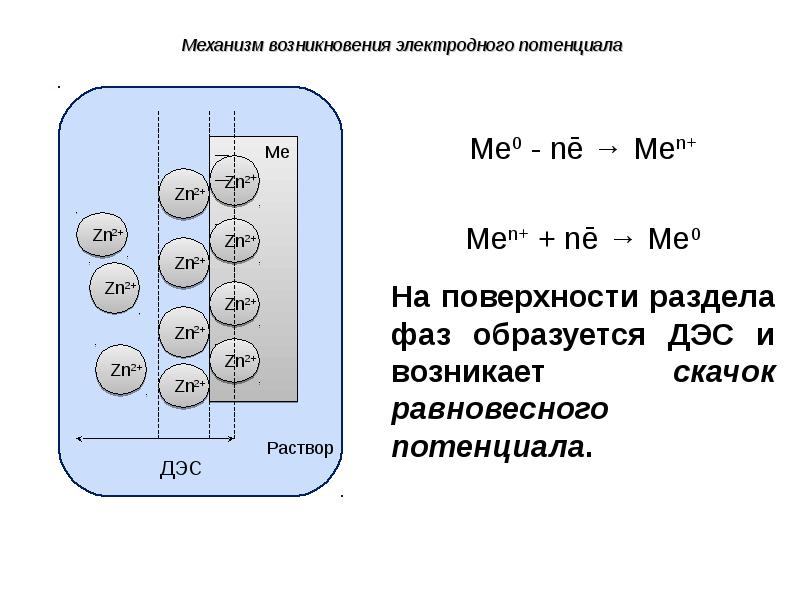
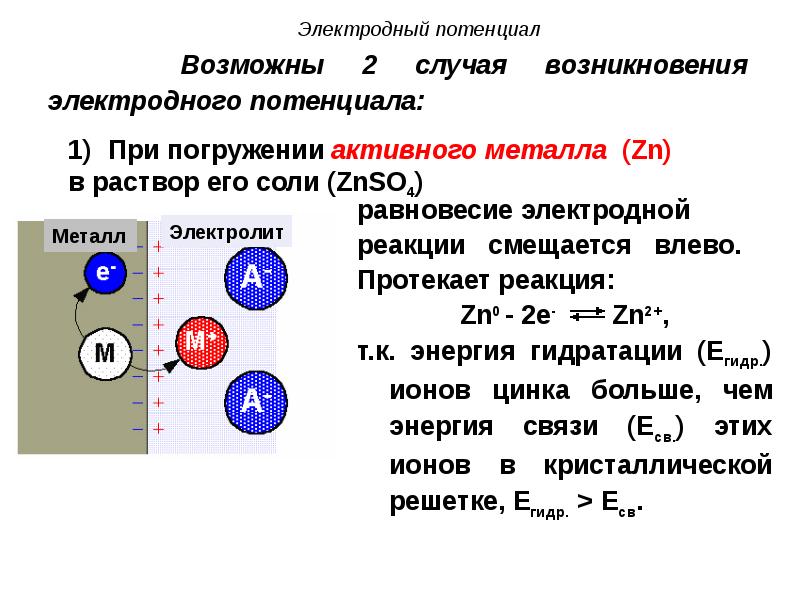
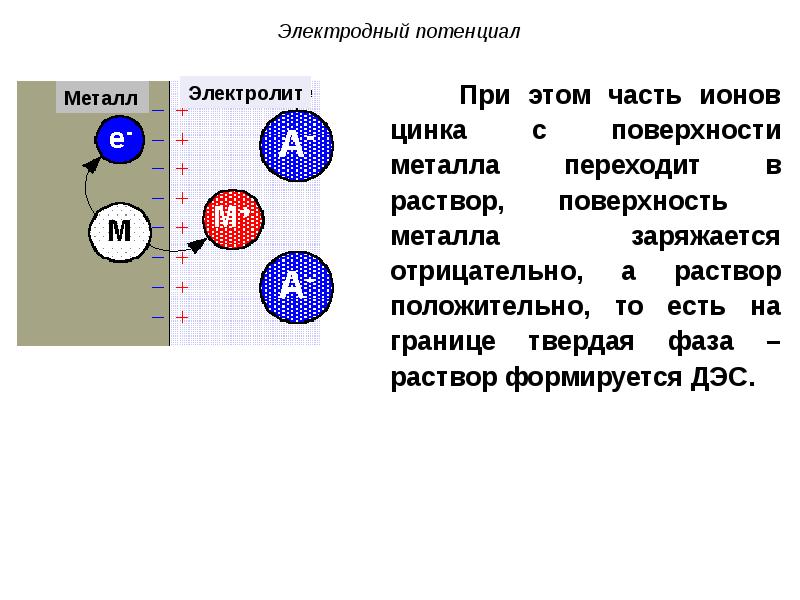
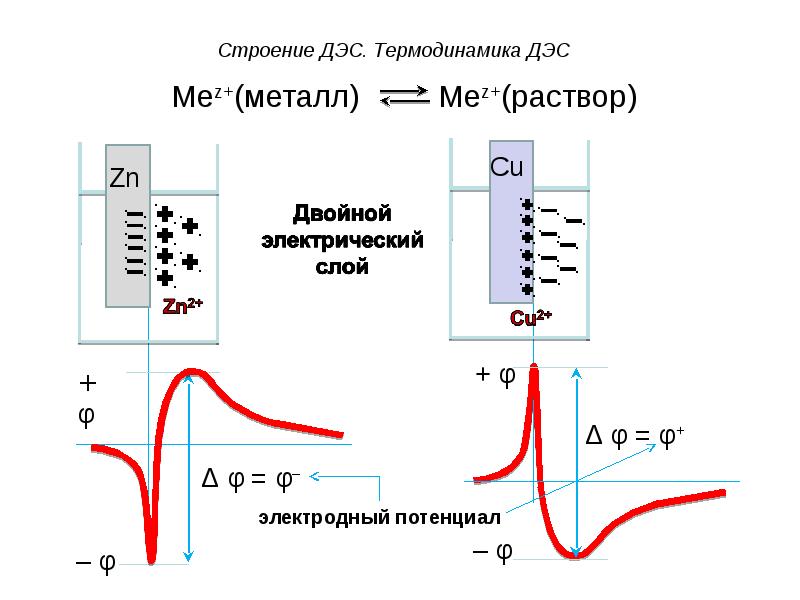
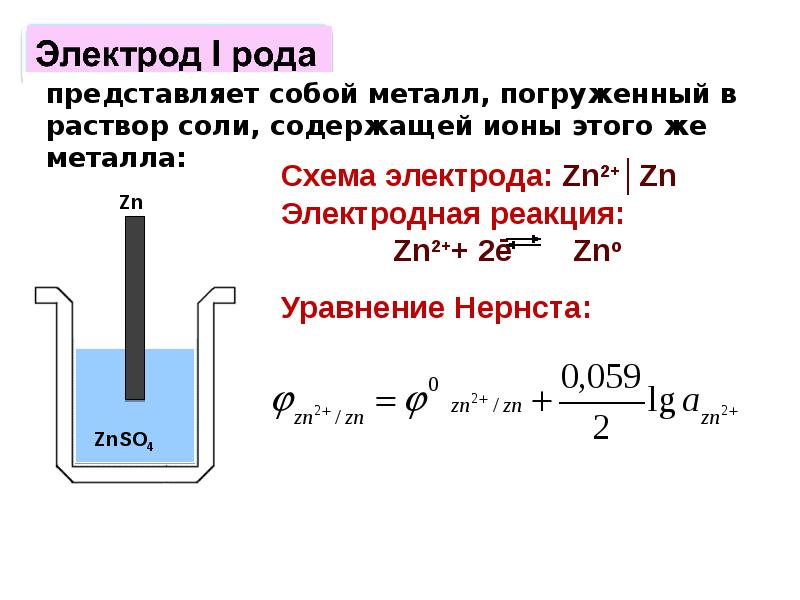
- 36. При погружении металла в раствор его одноименной соли, в системе металл
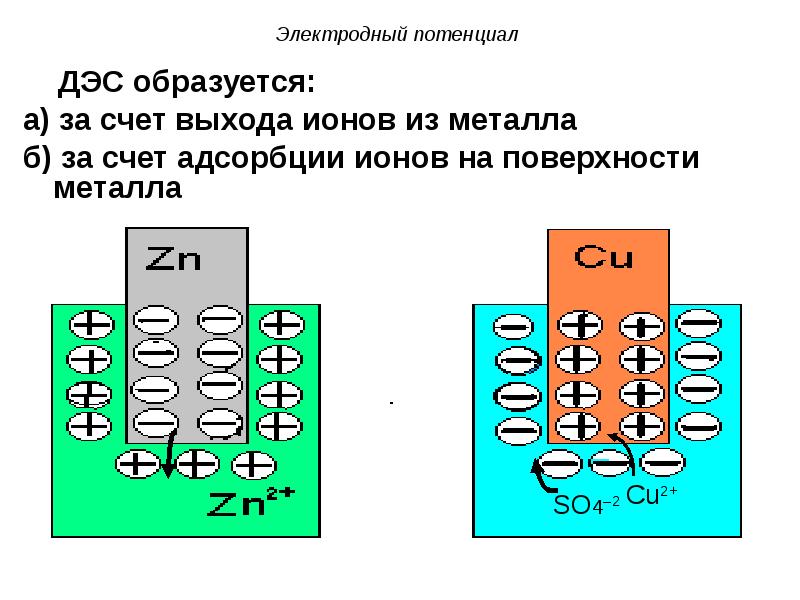
- 38. ДЭС образуется: ДЭС образуется: а) за счет выхода ионов из
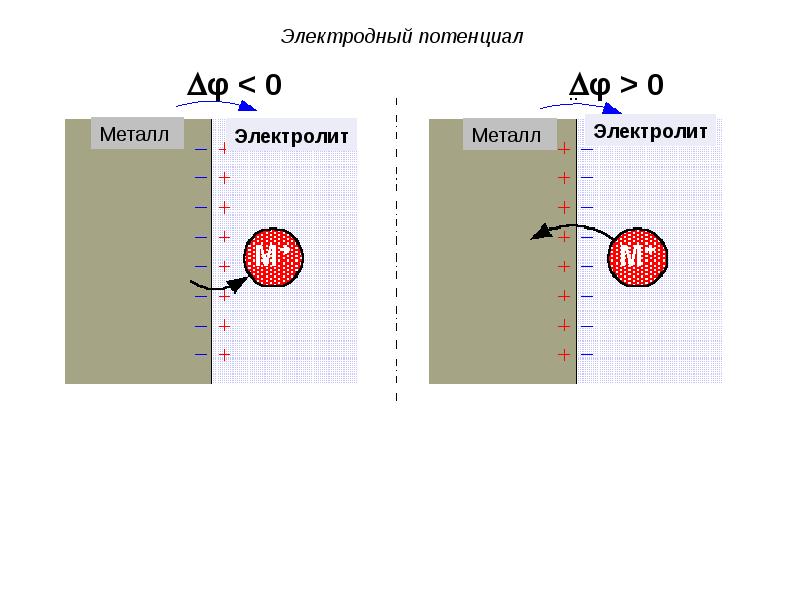
- 39. Возможны 2 случая возникновения электродного потенциала:
- 40. Электродный потенциал
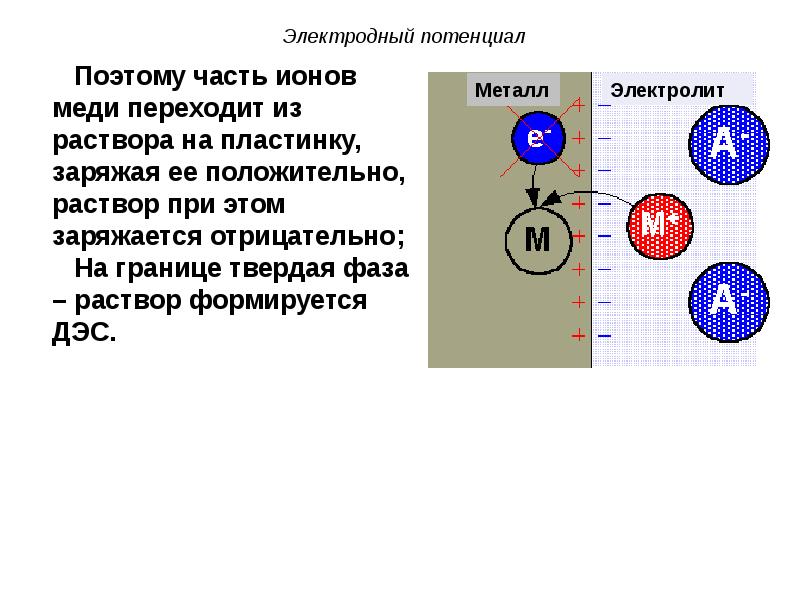
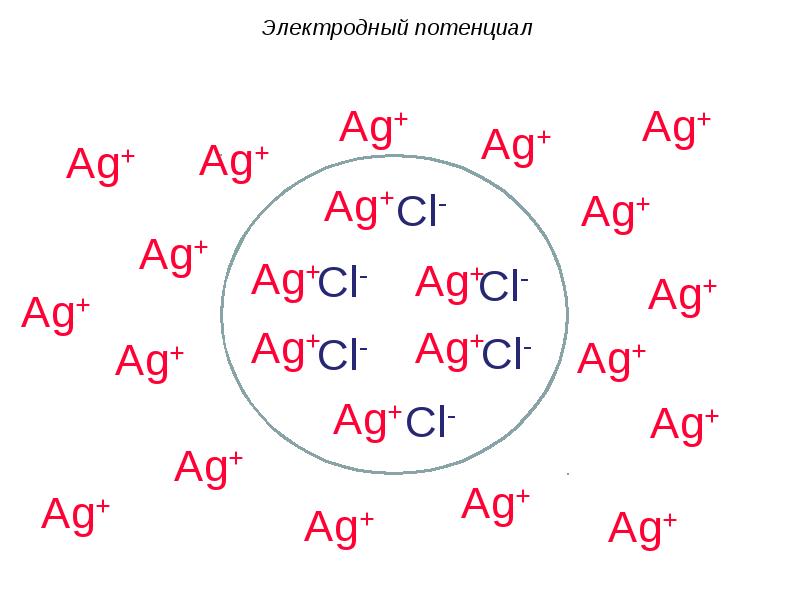
- 41. 2) При погружении неактивного металла (Cu) в раствор его соли (CuSO4)
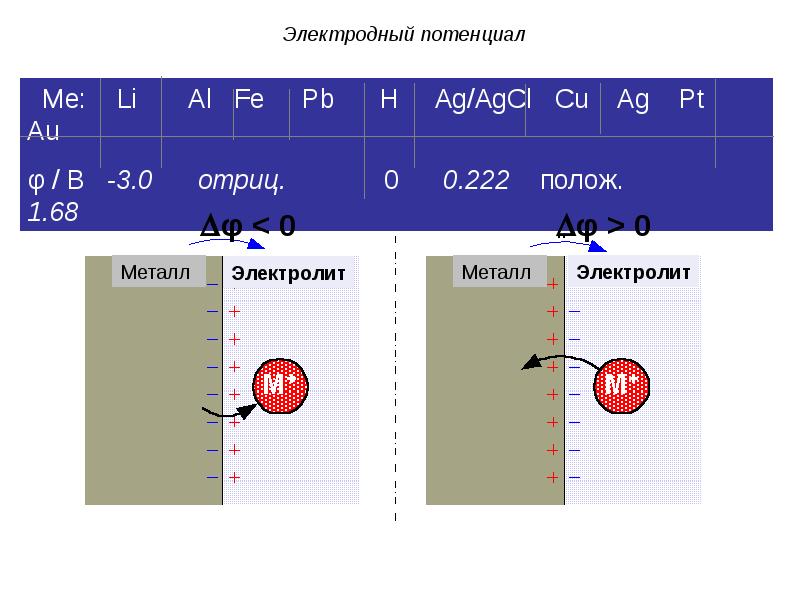
- 42. Электродный потенциал
- 43. Электродный потенциал
- 44. Электродный потенциал
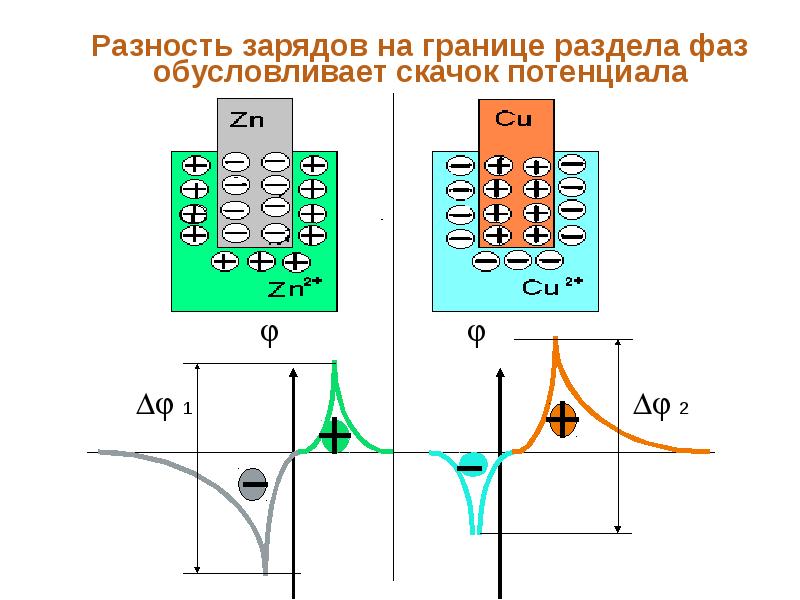
- 45. Разность зарядов на границе раздела фаз обусловливает скачок потенциала
- 46. Электродный потенциал Существуют и другие механизмы возникновения ДЭС, например, процесс
- 47. Электродный потенциал
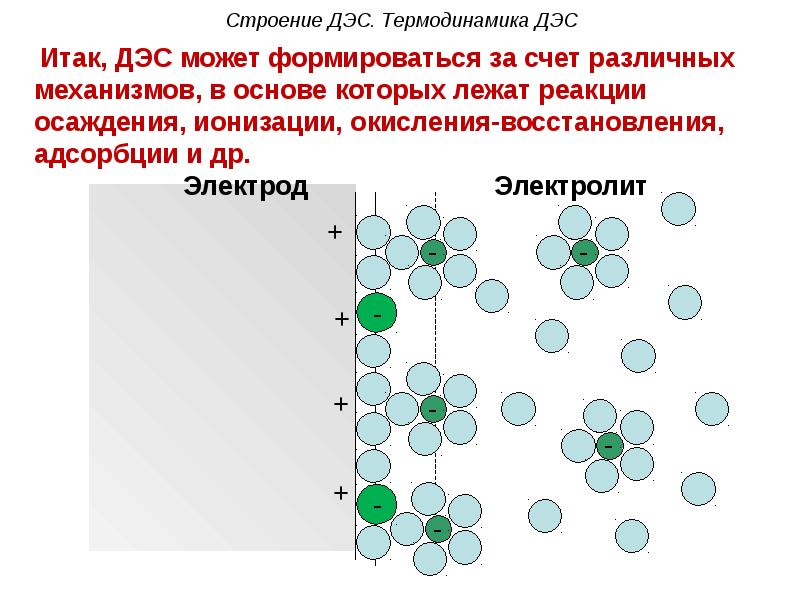
- 48. Строение ДЭС. Термодинамика ДЭС
- 49. Строение ДЭС по Штерну ДЭС можно сравнить с конденсатором, одна
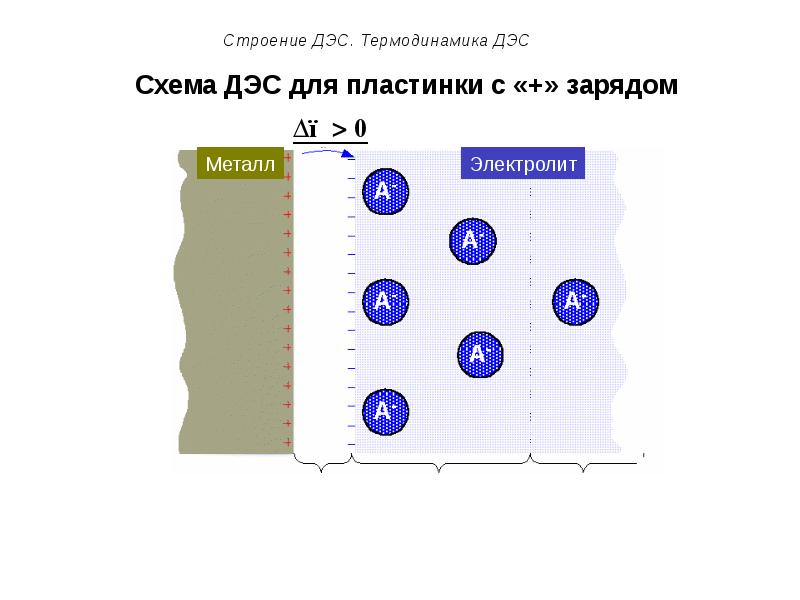
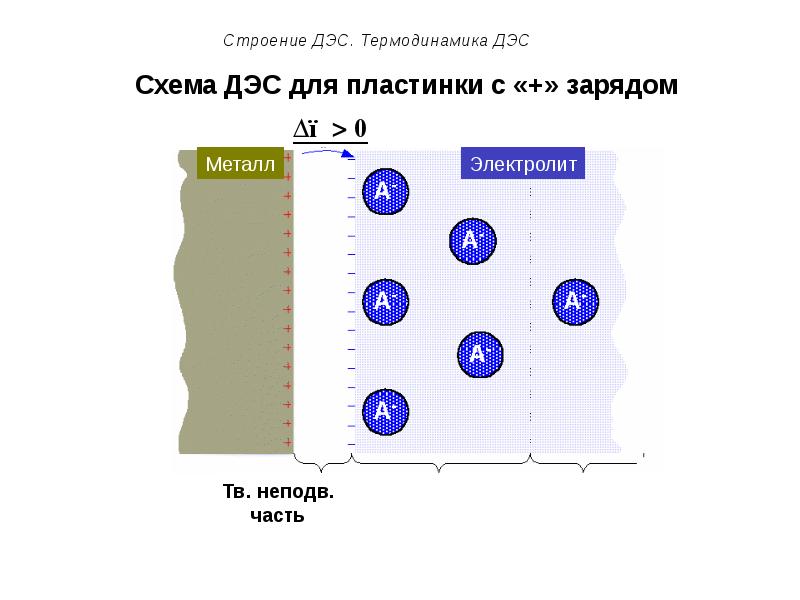
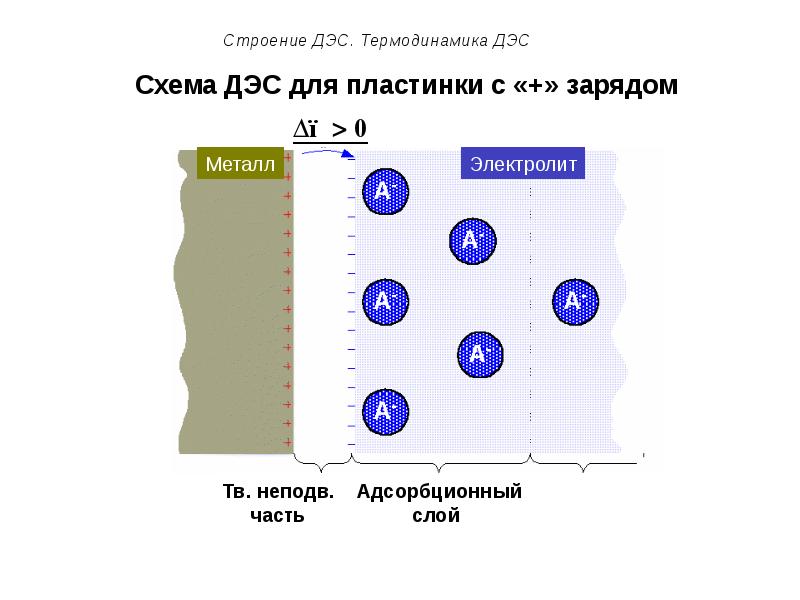
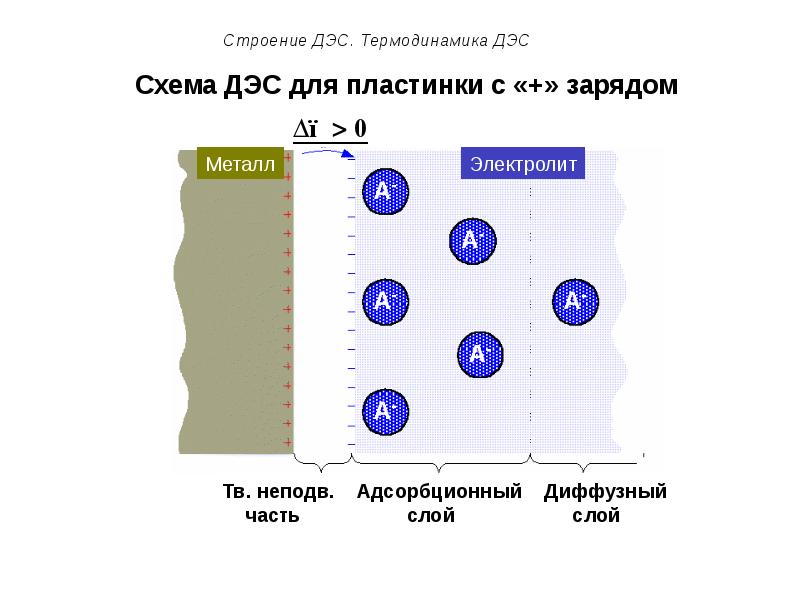
- 50. Строение ДЭС. Термодинамика ДЭС Подвижную часть ДЭС можно разделить на
- 52. Строение ДЭС. Термодинамика ДЭС Схема ДЭС для пластинки с «-» зарядом:
- 53. Схема ДЭС для пластинки с «+» зарядом
- 54. Схема ДЭС для пластинки с «+» зарядом
- 55. Схема ДЭС для пластинки с «+» зарядом
- 56. Схема ДЭС для пластинки с «+» зарядом
- 57. Строение ДЭС. Термодинамика ДЭС От величины электродного потенциала (φ) зависит
- 58. Строение ДЭС. Термодинамика ДЭС В изобарно-изотермических условиях работа равна уменьшению
- 59. Уравнение Нернста
- 60. Уравнение Нернста: Уравнение Нернста: φ – электродный потенциал
- 61. Уравнение Нернста При подстановке констант в выражение и переводе натурального
- 62. Уравнение Нернста Например, уравнение Нернста для цинкового электрода для 298
- 64. Электродный потенциал нельзя измерить непосредственно. Можно измерять только разность потенциалов или
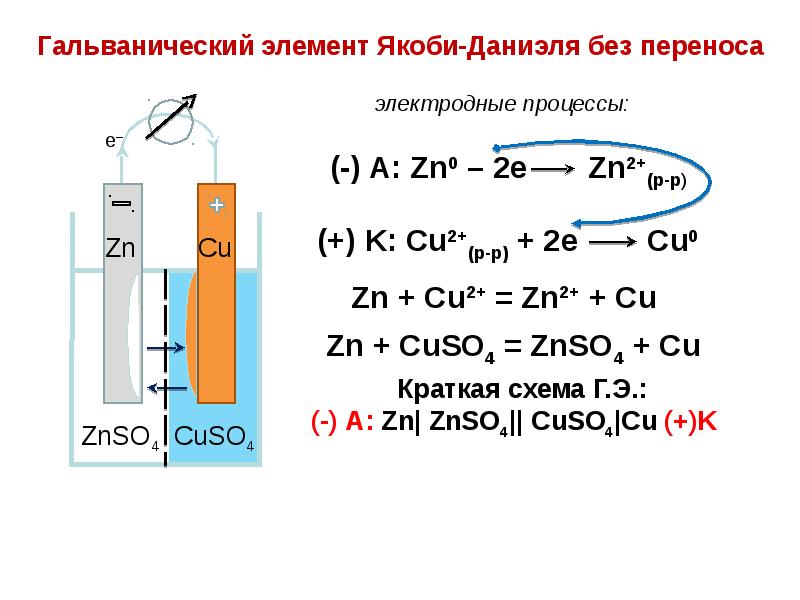
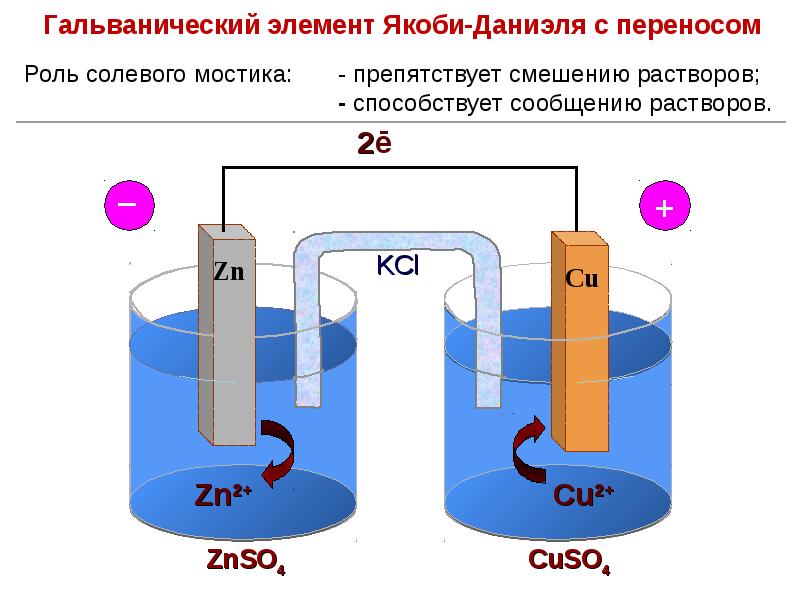
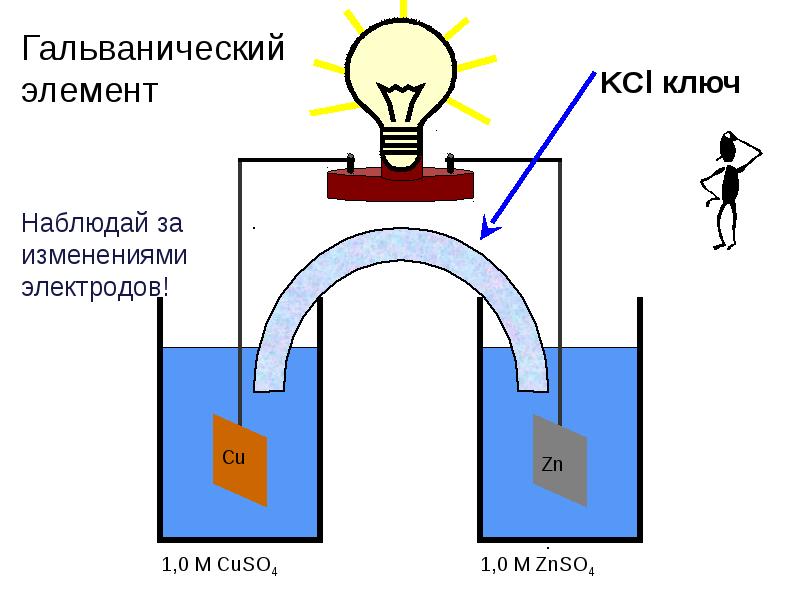
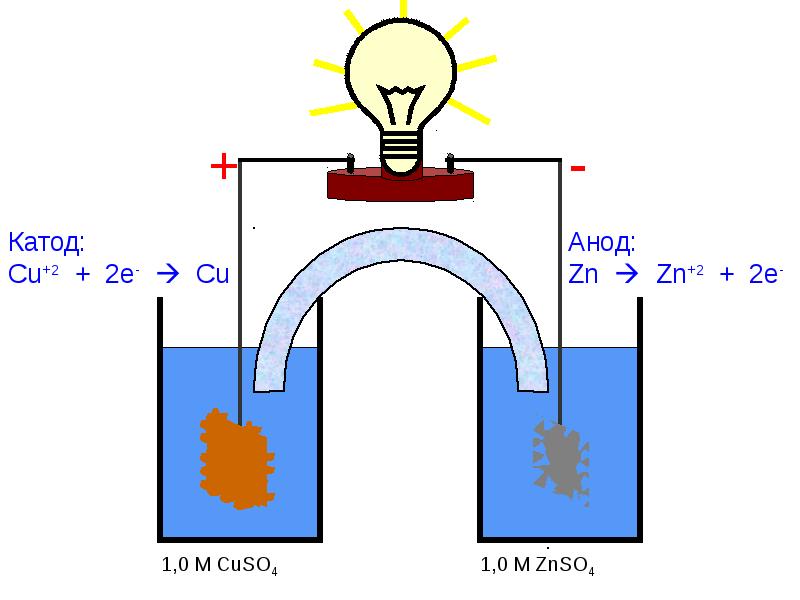
- 67. Измерение величины электродных потенциалов. Гальванические цепи Схема гальванической цепи:
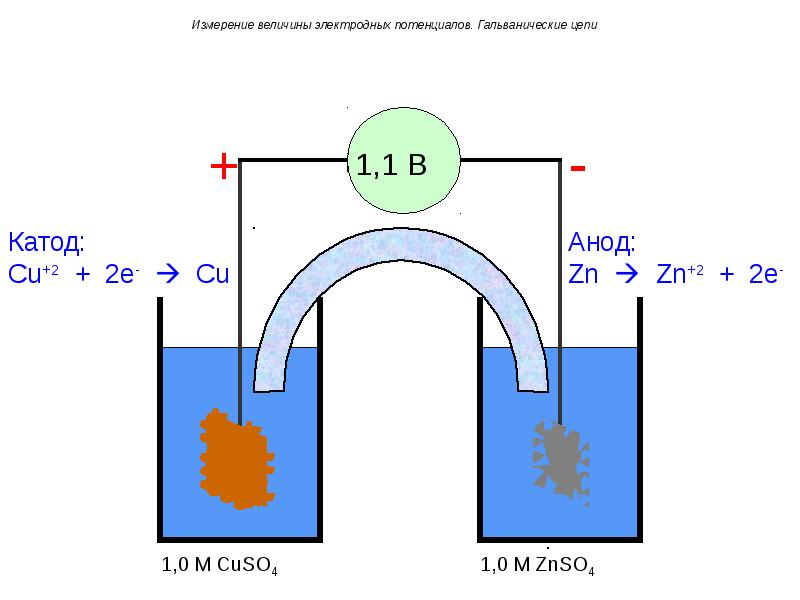
- 75. Измерение величины электродных потенциалов. Гальванические цепи
- 76. Измерение величины электродных потенциалов. Гальванические цепи
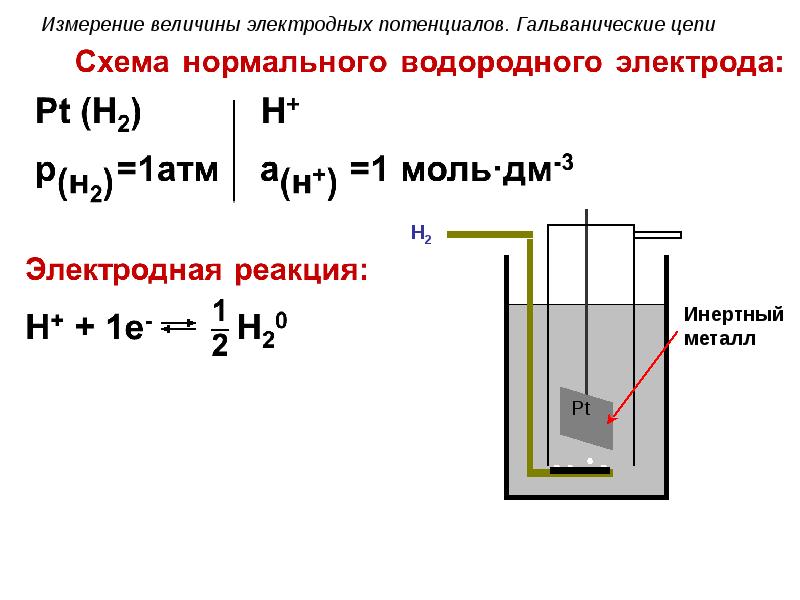
- 78. Измерение величины электродных потенциалов. Гальванические цепи Уравнение Нернста для нормального
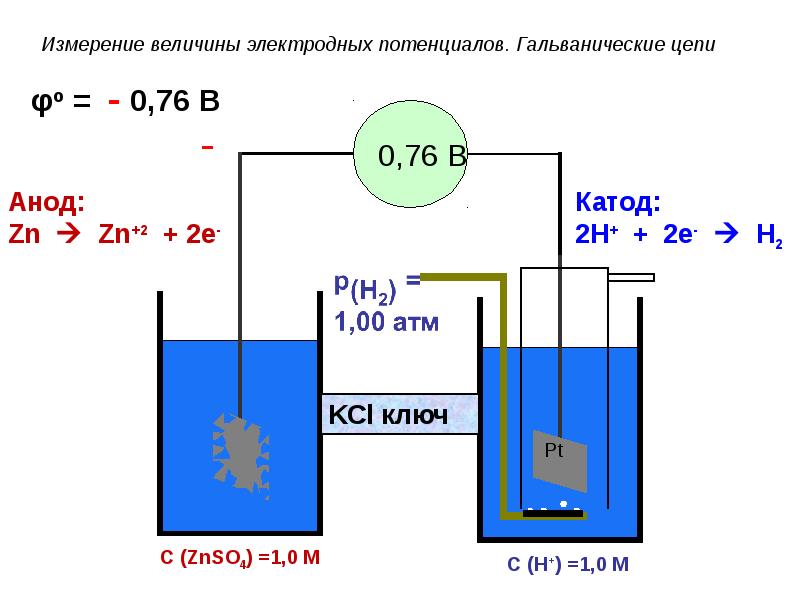
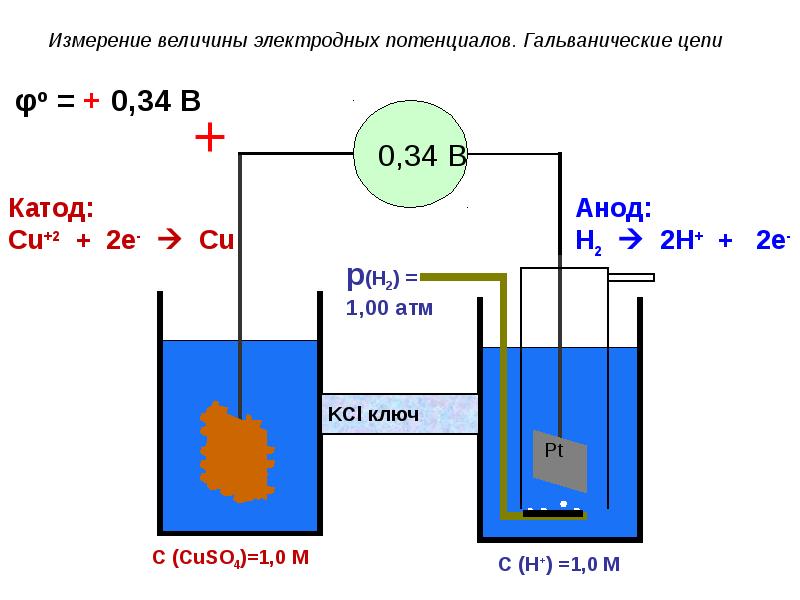
- 79. Измерение величины электродных потенциалов. Гальванические цепи
- 83. Измерение величины электродных потенциалов Al+3 + 3e- Al φo =
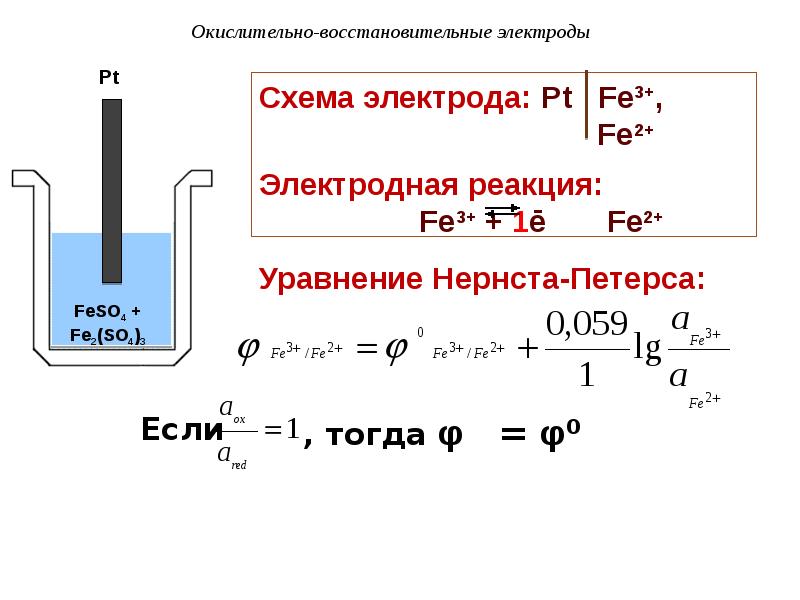
- 90. Окислительно-восстановительные электроды Pt ox (окисленная форма) red
- 91. Окислительно-восстановительные электроды Red-ox-электроды делятся на простые и сложные.
- 92. Окислительно-восстановительные электроды
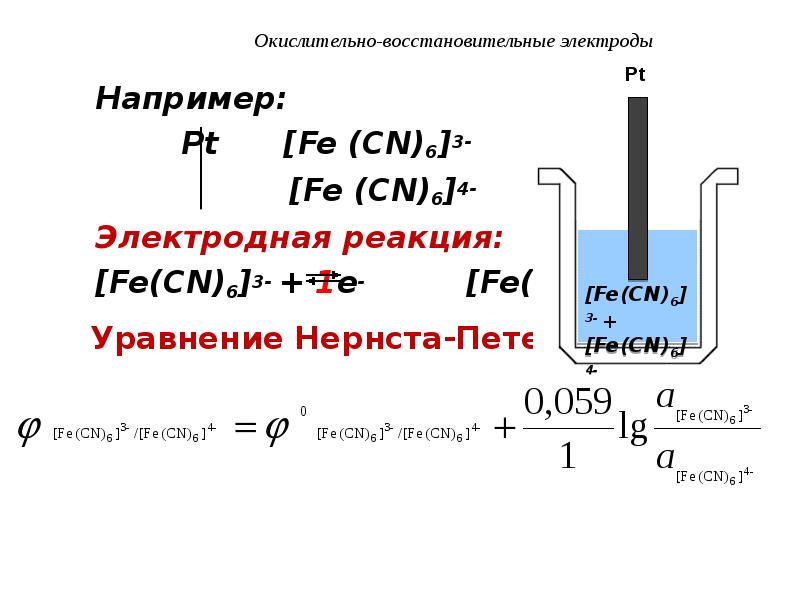
- 94. Окислительно-восстановительные электроды Например: Pt [Fe (CN)6]3-
- 95. Окислительно-восстановительные электроды
- 96. Окислительно-восстановительные электроды Схема сложного электрода: Pt MnO4-, H+
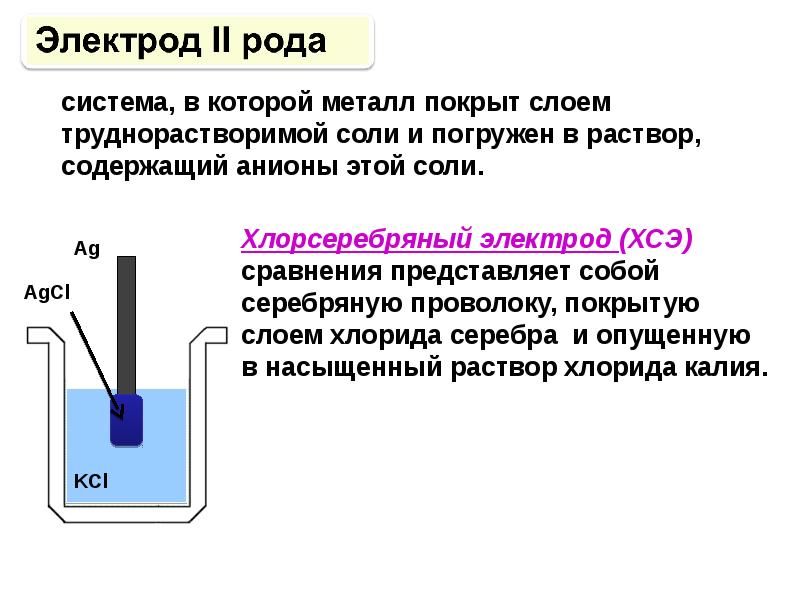
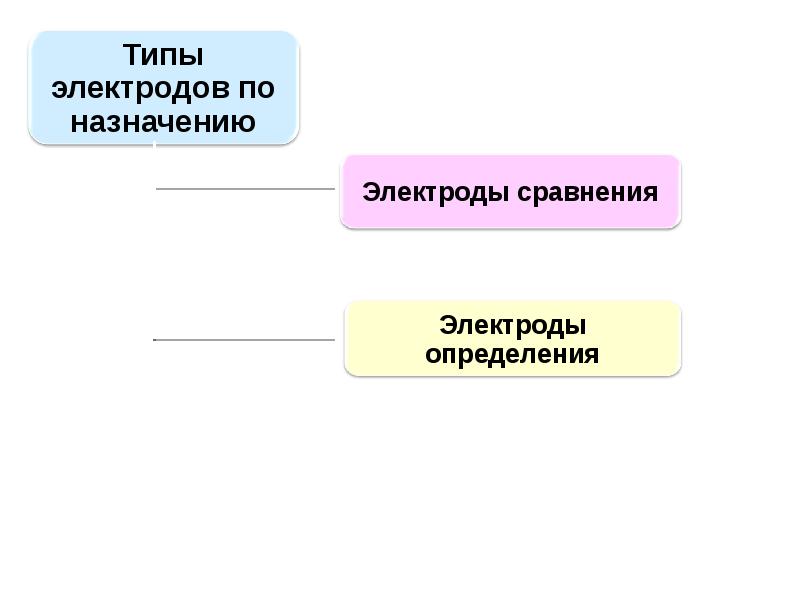
- 99. Электроды сравнения
- 100. Основные требования к электродам определения - специфичность, селективность, высокая чувствительность к
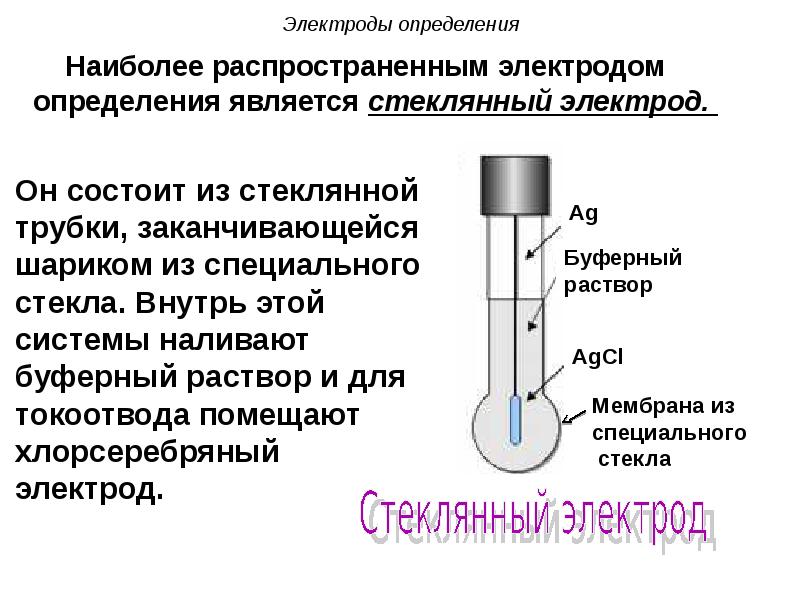
- 101. Электроды определения Наиболее распространенным электродом определения является стеклянный электрод.
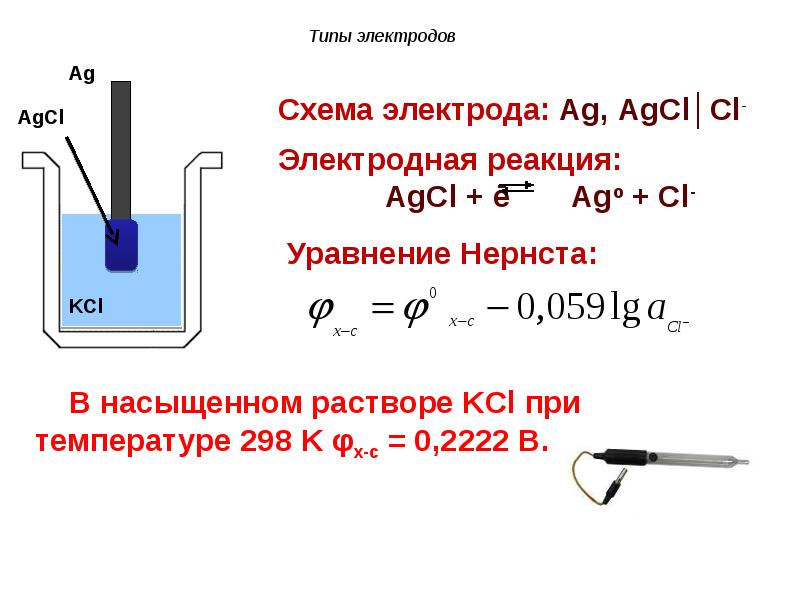
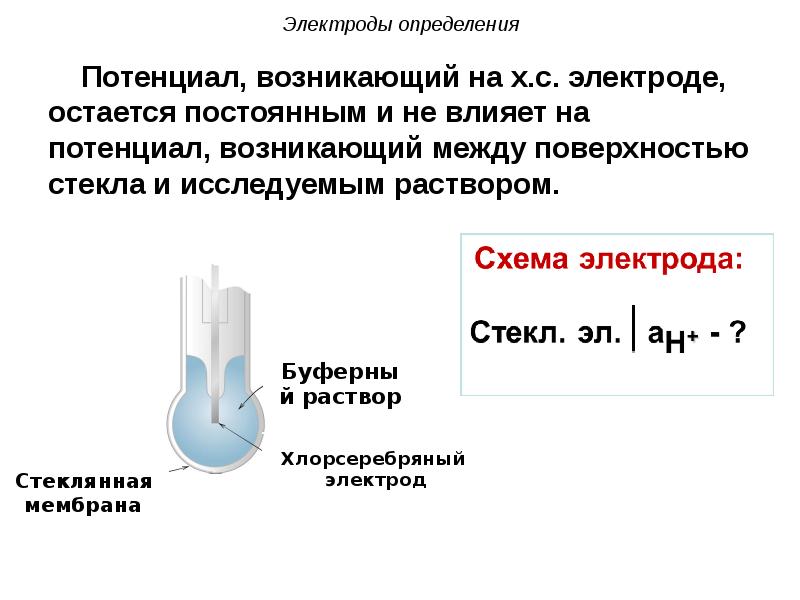
- 102. Электроды определения Потенциал, возникающий на х.с. электроде, остается постоянным и
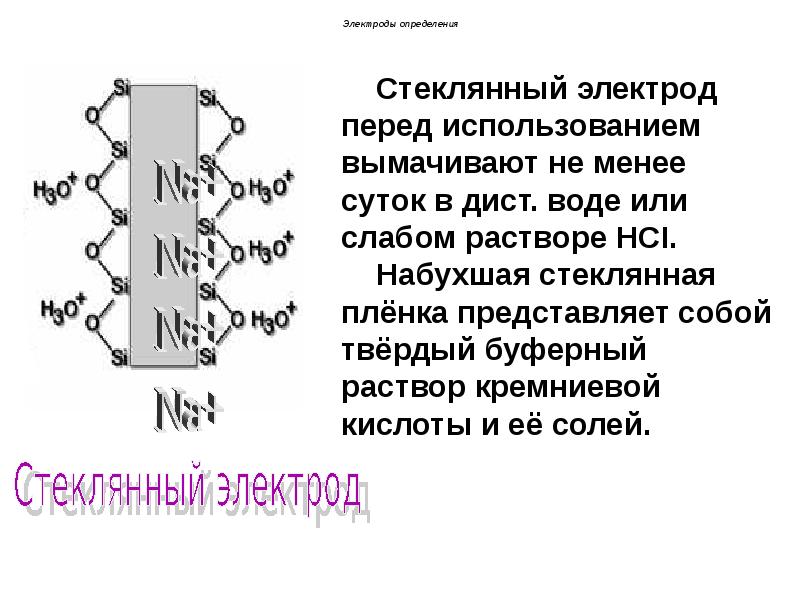
- 103. Электроды определения При помещении стеклянного электрода в раствор в поверхностный
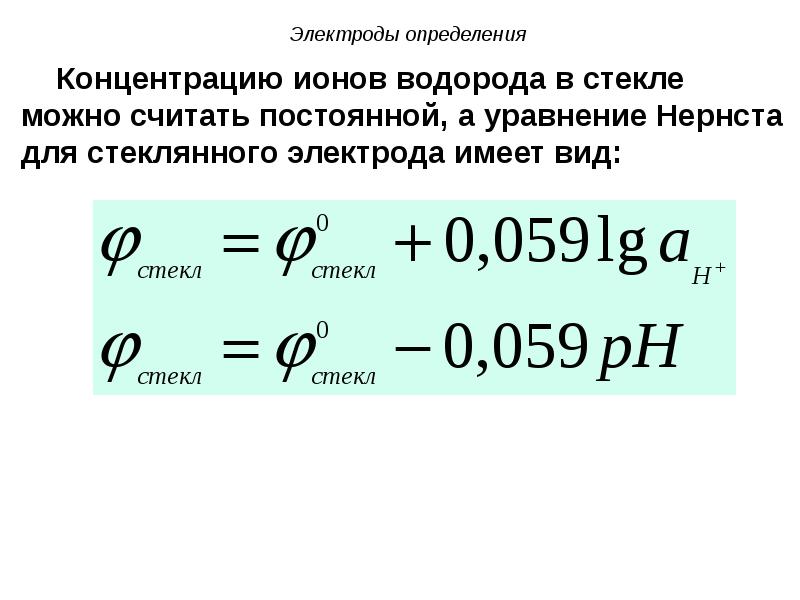
- 105. Электроды определения Концентрацию ионов водорода в стекле можно считать постоянной,
- 106. Ионоселективные электроды Это электроды, проявляющие селективное действие относительно тех
- 107. Электроды определения В настоящее время число ионоселективных электродов с четко
- 108. Вопросы для самоконтроля
- 109. БЛАГОДАРЮ ЗА ВАШЕ ВНИМАНИЕ!
- 110. Скачать презентацию





















































Слайды и текст этой презентации
Скачать презентацию на тему Электрохимия. Понятие электрохимии. Электроды. Гальванические цепи. Окислительно-восстановительные электроды. (Лекция 6.1) можно ниже:
Похожие презентации