Факторы, повышающие интенсивность химического процесса презентация
Содержание
- 2. Интенсивность химического процесса оценивается удельной производительностью, под которой понимают съём целевого
- 3. Уравнение скорости процесса в самом общем виде имеет вид: Уравнение скорости
- 4. Константа скорости процесса. Влияние температуры.
- 5. Константа скорости процесса является сложной величиной, зависящей от химических свойств реагирующих
- 6. Рассмотрим более подробно влияние температуры на скорость химического процесса Повышение температуры
- 7. Если процесс протекает в кинетическом режиме, влияние температуры на константу скорости
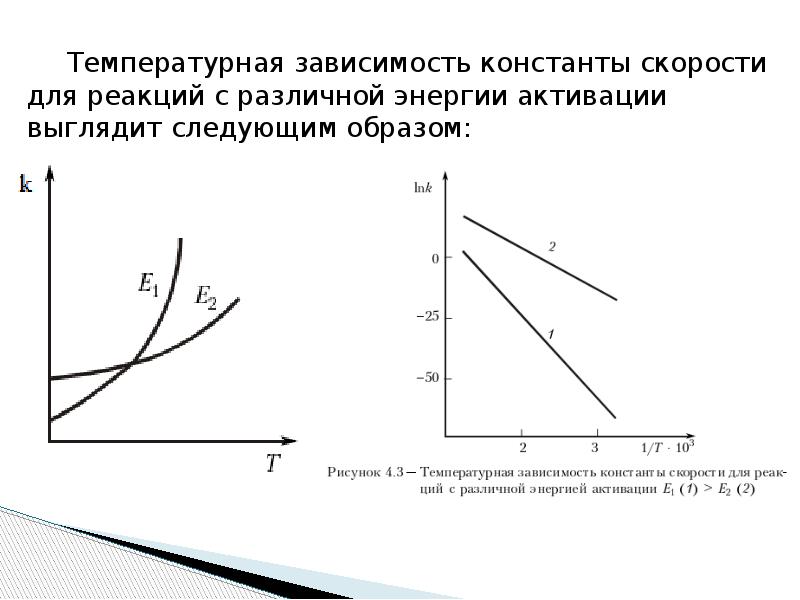
- 8. Температурная зависимость константы скорости для реакций с различной энергии активации выглядит
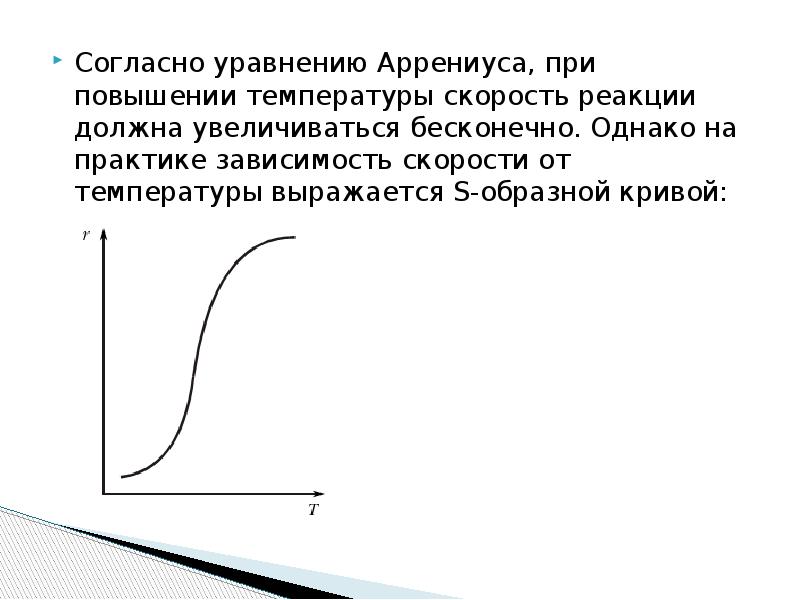
- 9. Согласно уравнению Аррениуса, при повышении температуры скорость реакции должна увеличиваться бесконечно.
- 10. При очень высоких температурах реагенты расходуются настолько быстро, что просто не
- 11. Влияние температуры на скорость процесса в диффузионной области меньше, чем в
- 12. Диффузия в жидкостях протекает медленнее, чем в газах. Значения D для
- 13. В процессах с диффузионным режимом для ускорения массообмена используют интенсивное перемешивание.
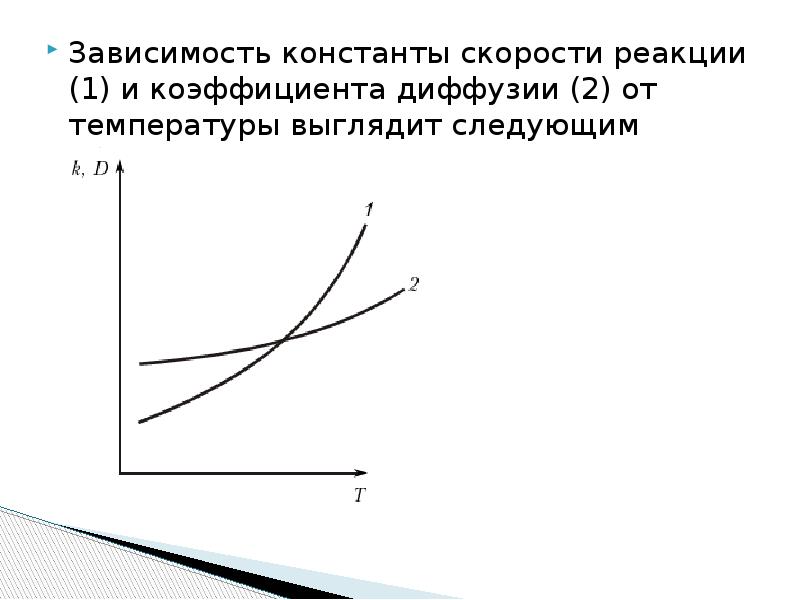
- 14. Зависимость константы скорости реакции (1) и коэффициента диффузии (2) от температуры
- 15. Влияние термодинамического фактора на скорость процесса Для всех обратимых экзотермических реакций
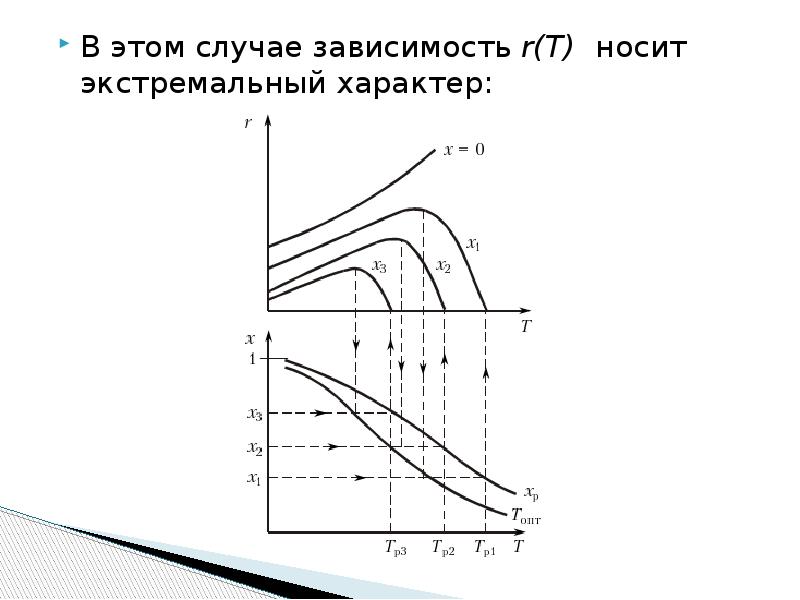
- 16. В этом случае зависимость r(T) носит экстремальный характер: В этом случае
- 17. Анализ графической зависимости: Высокая скорость процесса достигается при низкой конверсии; Большая
- 18. Как интенсифицировать процесс? Для обратимой экзотермической реакции по мере протекания процесса
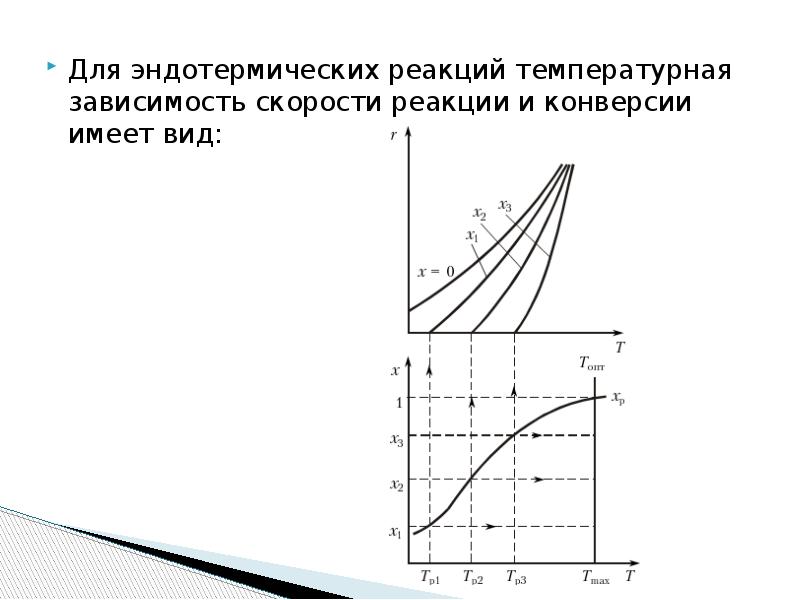
- 19. Для эндотермических процессов высокие температуры более благоприятны. С повышением температуры растет
- 20. Для эндотермических реакций температурная зависимость скорости реакции и конверсии имеет вид:
- 21. Влияние температуры на селективность В ряде процессов, особенно в технологии органических
- 22. Рассмотрим сложнопараллельную реакцию: Рассмотрим сложнопараллельную реакцию: Выразим скорости образования продуктов: -
- 23. Выразим дифференциальные селективности продуктов реакции: Выразим дифференциальные селективности продуктов реакции:
- 24. Если , то с повышением температуры скорость образования R больше, чем
- 25. Остальные причины, ограничивающие температуру процесса Удаление реагирующих веществ за счет десорбции
- 26. Заключение Регулирование температуры процессов необходимо для увеличения константы скорости процесса k
- 27. Спасибо за внимание!
- 28. Скачать презентацию






















Слайды и текст этой презентации
Скачать презентацию на тему Факторы, повышающие интенсивность химического процесса можно ниже:
Похожие презентации





























