Фазовые равновесия «раствор-пар» в двухкомпонентных системах из двух летучих жидкостей презентация
Содержание
- 2. 1. Идеальные растворы из неограниченно смешивающихся жидкостей Жидкие вещества при
- 3. 1. Идеальные растворы из неограниченно смешивающихся жидкостей С практической точки зрения
- 4. 1. Идеальные растворы из неограниченно смешивающихся жидкостей Неограниченно растворимые жидкости
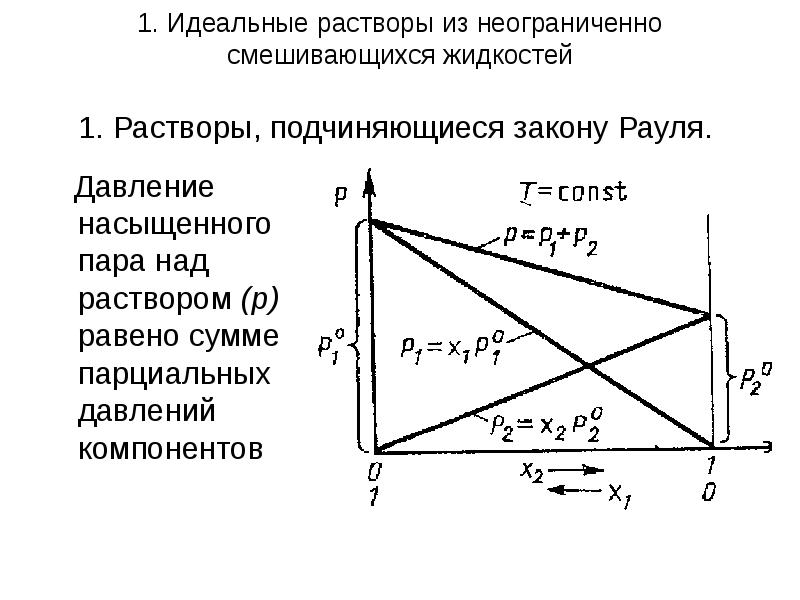
- 5. 1. Идеальные растворы из неограниченно смешивающихся жидкостей 1. Растворы, подчиняющиеся закону
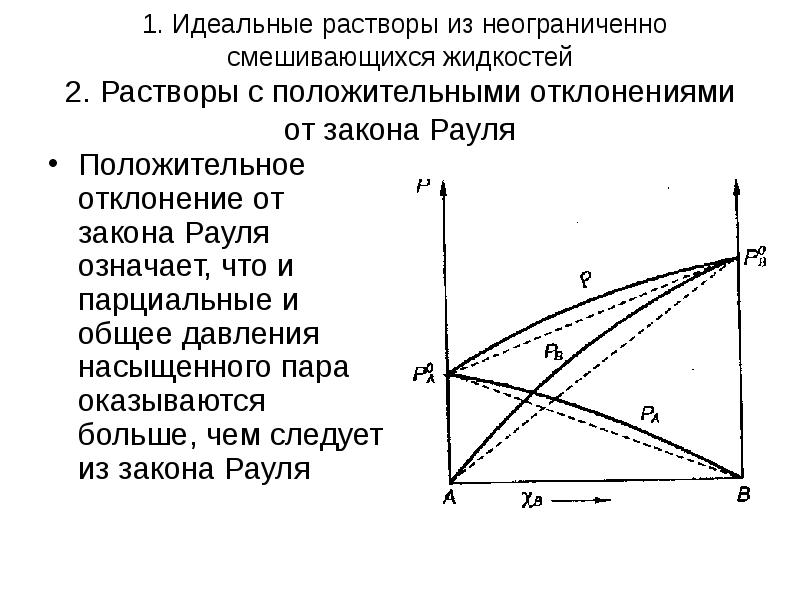
- 6. 1. Идеальные растворы из неограниченно смешивающихся жидкостей 2. Растворы с положительными
- 7. 1. Идеальные растворы из неограниченно смешивающихся жидкостей Положительные отклонения от
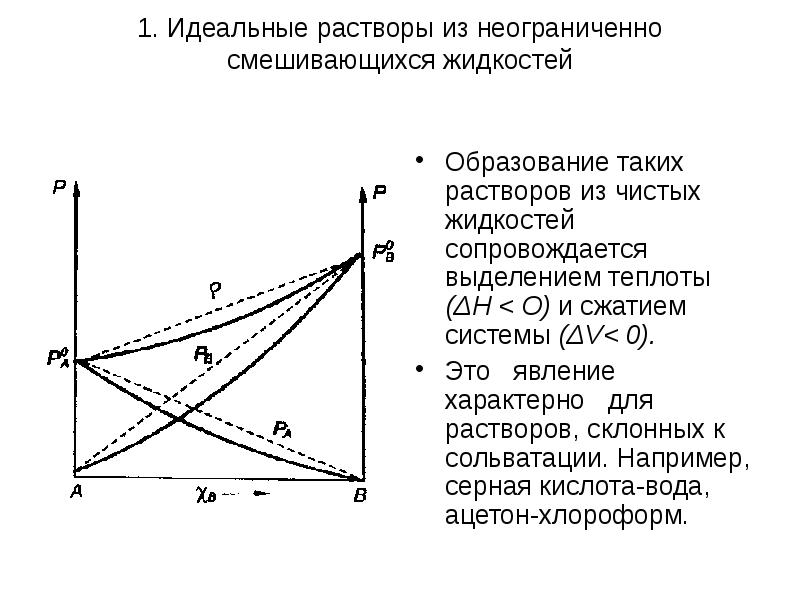
- 8. 1. Идеальные растворы из неограниченно смешивающихся жидкостей Растворы с отрицательными отклонениями
- 9. 1. Идеальные растворы из неограниченно смешивающихся жидкостей Образование таких растворов из
- 10. 1. Идеальные растворы из неограниченно смешивающихся жидкостей 3. В некоторых системах,
- 11. 1. Идеальные растворы из неограниченно смешивающихся жидкостей Жидкие смеси, состав
- 12. 2. Законы Коновалова Состав жидкого раствора и пара в момент
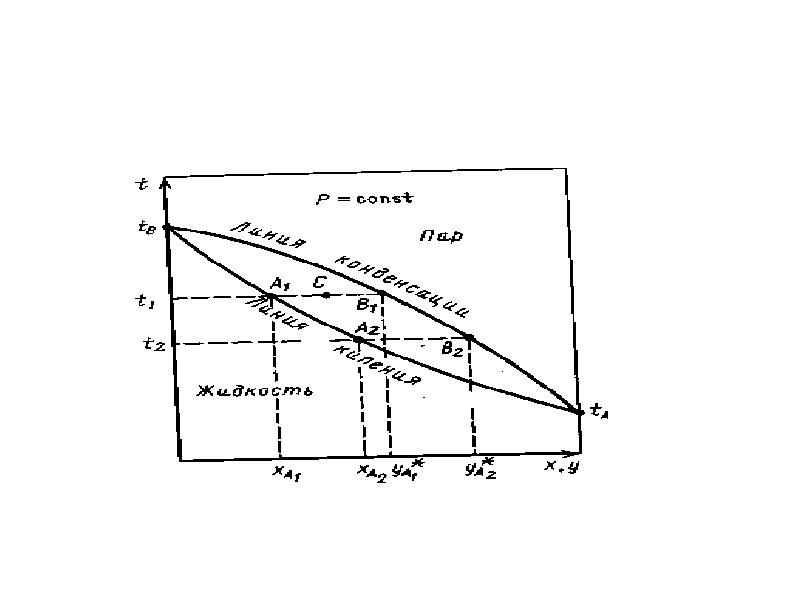
- 14. 2. Законы Коновалова Проведем фазовый анализ диаграммы «температура - состав»
- 15. 2. Законы Коновалова Линия конденсации отделяет область ненасыщенного пара от
- 16. 2. Законы Коновалова Область ниже линии кипения, соответствует некипящей жидкости (жидкости
- 17. 2. Законы Коновалова Область выше линии конденсации, соответствует ненасыщенному пару (пару
- 18. 2. Законы Коновалова Область между кривыми, соответствует сосуществованию пара и жидкости
- 19. 2. Законы Коновалова Чтобы определить состав сосуществующих фаз в системе, надо
- 20. 2. Законы Коновалова Соотношение между составами равновесных жидкости и пара,
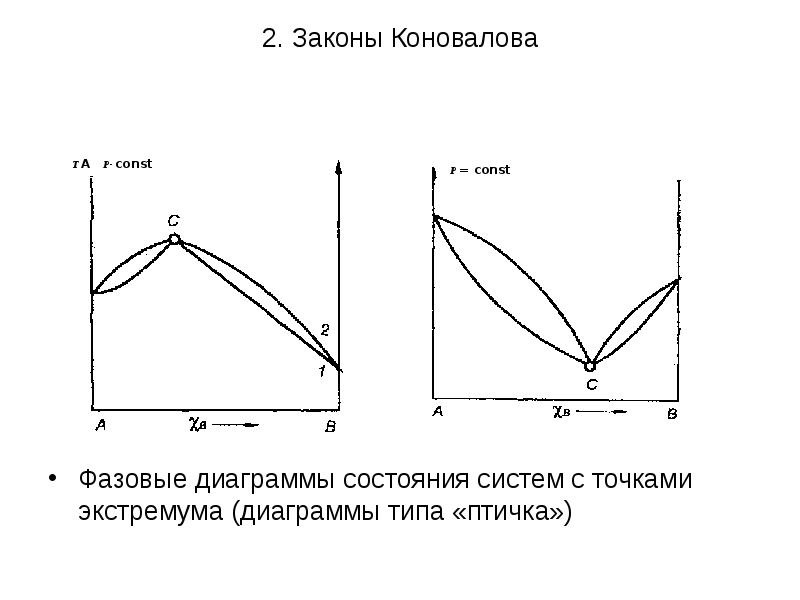
- 21. 2. Законы Коновалова Формулировка второго закона Коновалова: точки максимума или
- 22. 2. Законы Коновалова
- 23. 2. Законы Коновалова Применение правила фаз Гиббса показывает, что для любой
- 24. 3. Перегонка растворов Перегонка - процесс разделения жидких смесей, основанный
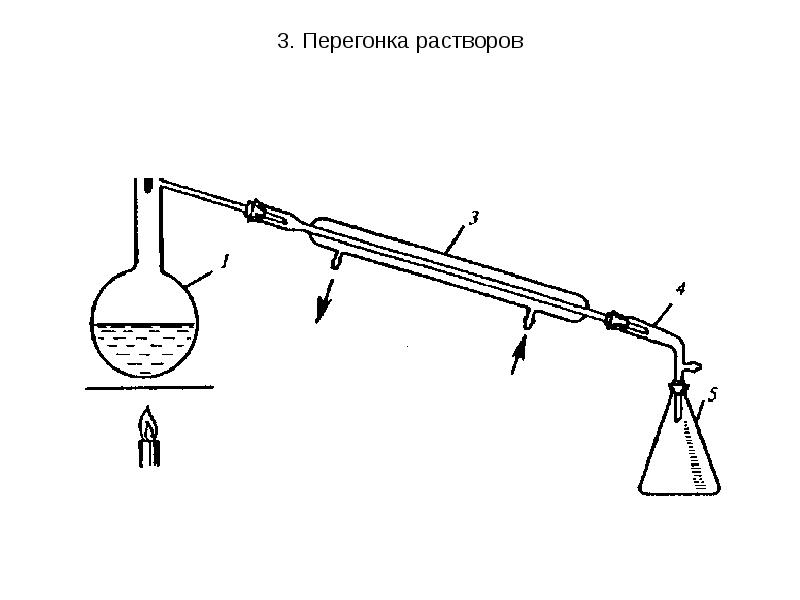
- 25. 3. Перегонка растворов Виды перегонок: Простая перегонка заключается в непрерывном нагревании
- 26. 3. Перегонка растворов
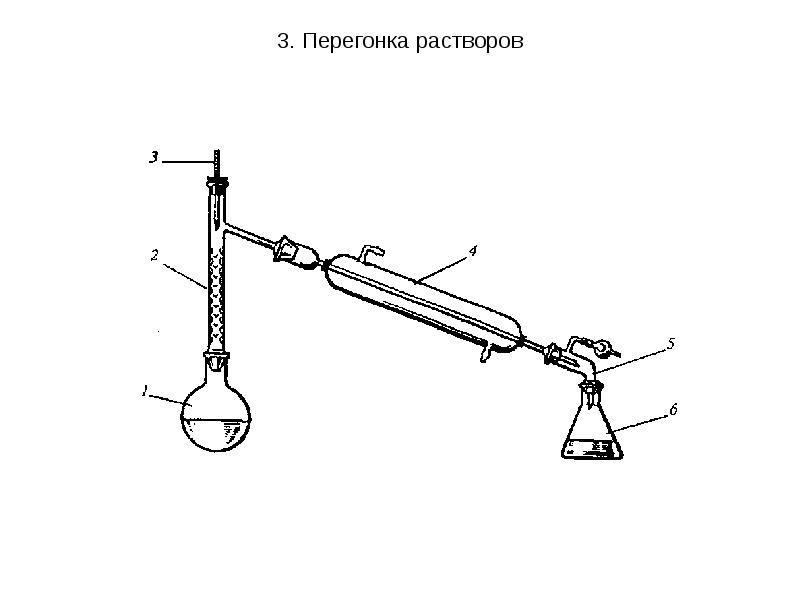
- 27. 3. Перегонка растворов 2. Фракционная перегонка применяется для разделения смесей жидкостей,
- 28. 3. Перегонка растворов
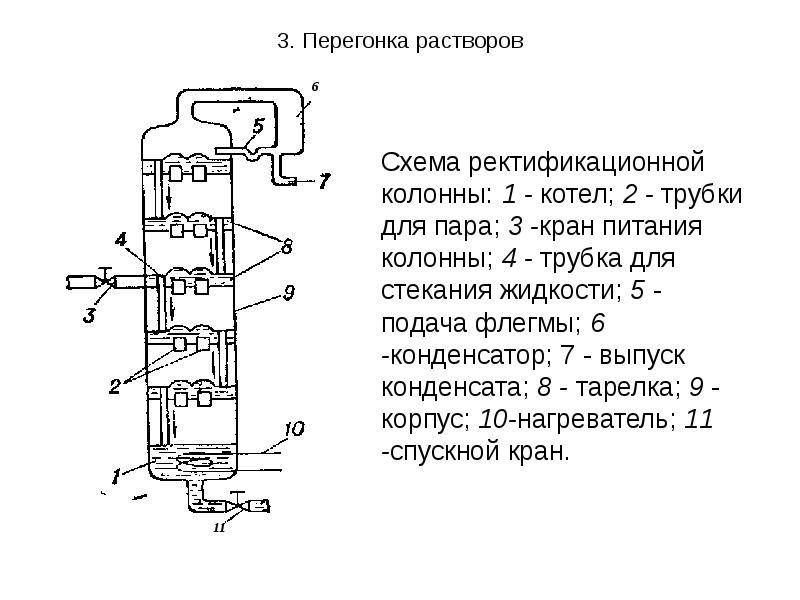
- 29. 3. Перегонка растворов 3. Ректификация - непрерывная фракционная перегонка, осуществляемая в
- 30. 3. Перегонка растворов
- 31. 3. Перегонка растворов Поступающая в колонку жидкость (А+В) быстро доводится
- 32. 3. Перегонка растворов Методы разделения азеотропных смесей: • Химическое связывание одного
- 33. 3. Перегонка растворов Разделение азеотропной смеси путем добавления третьего компонента. Абсолютный
- 34. 3. Перегонка растворов Последовательная ректификация на двух колоннах с различным давлением.
- 35. Скачать презентацию


























Слайды и текст этой презентации
Скачать презентацию на тему Фазовые равновесия «раствор-пар» в двухкомпонентных системах из двух летучих жидкостей можно ниже:
Похожие презентации





























