Фенолы. Химические свойства и способы получения презентация
Содержание
- 2. План: Фенолы; Классификация; Химические свойства; Способы получения; Применение; Использованная литература.
- 3. ФЕНОЛЫ – класс органических соединений. Содержат одну или несколько группировок С–ОН,
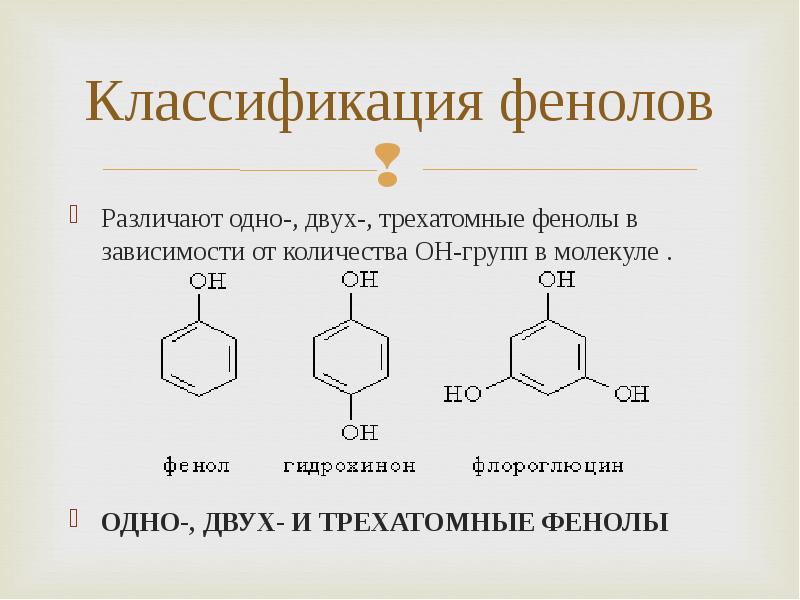
- 4. Классификация фенолов Различают одно-, двух-, трехатомные фенолы в зависимости от количества
- 5. Химические свойства фенолов В фенолах p-орбиталь атома кислорода образует с
- 6. Химические свойства: 1. Кислотность фенола существенно выше, чем у предельных спиртов;
- 7. 2. Образование сложных эфиров. В отличие от спиртов, фенолы не образуют
- 8. 3. Реакции электрофильного замещения в феноле протекают значительно легче, чем в
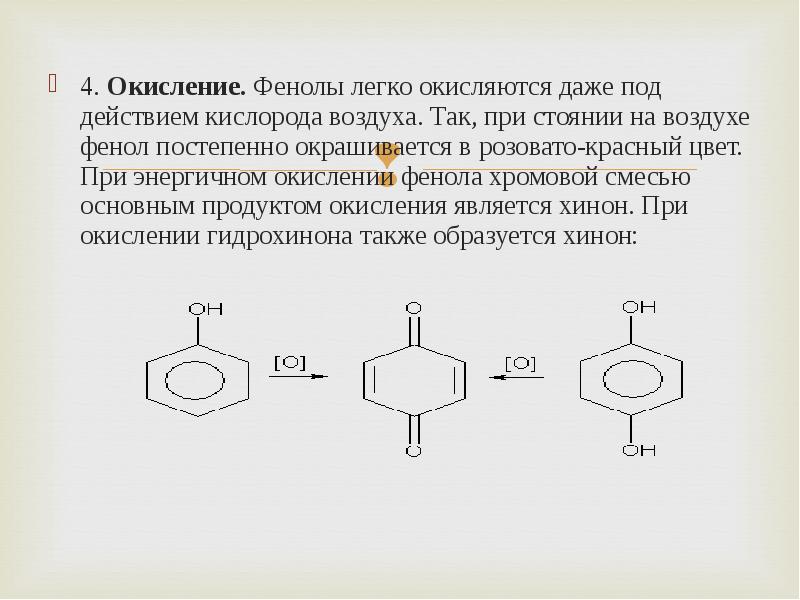
- 9. 4. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. Так,
- 10. Способы получения 1. Получение из галогенбензолов. При нагревании хлорбензола и
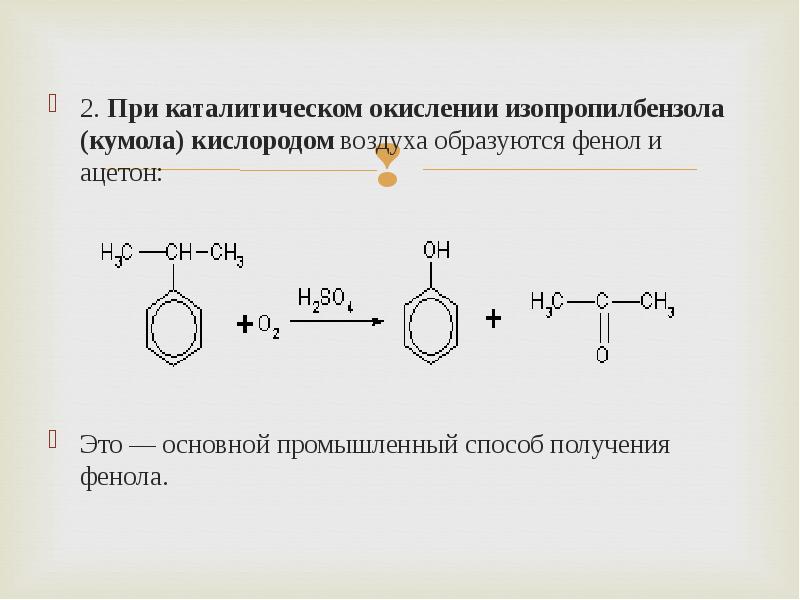
- 11. 2. При каталитическом окислении изопропилбензола (кумола) кислородом воздуха образуются фенол и
- 12. 3. Получение из ароматических сульфокислот. Реакция проводится при сплавлении сульфокислот с
- 13. Применение Фенол используют как полупродукт при получении фенолформальдегидных смол, синтетических волокон,
- 14. Использованная литература: «Органическая химия» Тюкавкина. Органическая химия ВФ.Травень.
- 15. Скачать презентацию











Слайды и текст этой презентации
Скачать презентацию на тему Фенолы. Химические свойства и способы получения можно ниже:
Похожие презентации





























