Физика поверхностных явлений. Свойства растворов презентация
Содержание
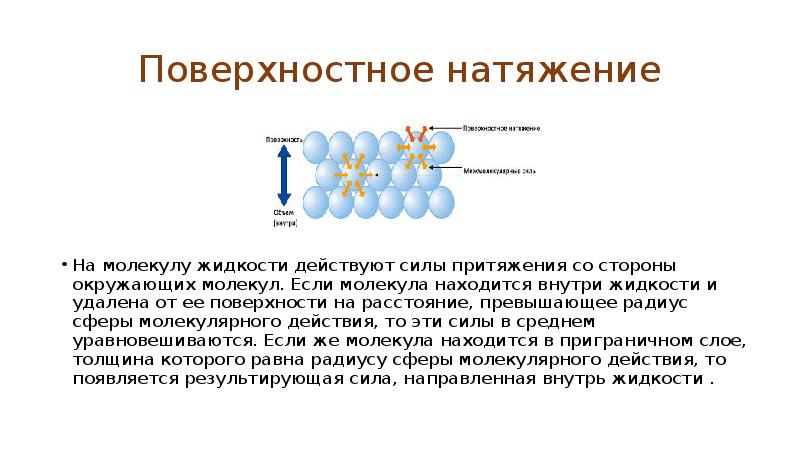
- 2. Поверхностное натяжение На молекулу жидкости действуют силы притяжения со стороны окружающих
- 3. Поверхностное натяжение Поэтому для извлечения молекулы из внутренних частей жидкости на
- 4. Поверхностное натяжение Поскольку для «извлечения» молекулы на поверхность необходимо совершить работу
- 5. Поверхностное натяжение Рассмотрим такой опыт: возьмем проволочный каркас, имеющий форму прямоугольника.
- 6. Поверхностное натяжение Для удержания в равновесии перемычки СD к ней надо
- 7. Поверхностное натяжение Найдем f. Поддерживая температуру постоянной, увеличим силу f на
- 8. Поверхностное натяжение По определению поверхностного натяжения работа A может быть представлена
- 9. Поверхностное натяжение Таким образом, жидкость ведет себя так, как если бы
- 10. Поверхностное натяжение Как мы установили, поверхностное натяжение не зависит от площади
- 11. Поверхностное натяжение Важной характеристикой поверхностного натяжения является теплота, которую необходимо подвести
- 12. Поверхностное натяжение Будем откладывать по горизонтальной оси площадь пленки , а
- 13. Поверхностное натяжение В состоянии 2 изолируем пленку от нагревателя и адиабатически
- 14. Поверхностное натяжение Поверхность пленки уменьшится на , и она совершит положительную
- 15. Поверхностное натяжение По теореме Карно Подставляя сюда найденные выше
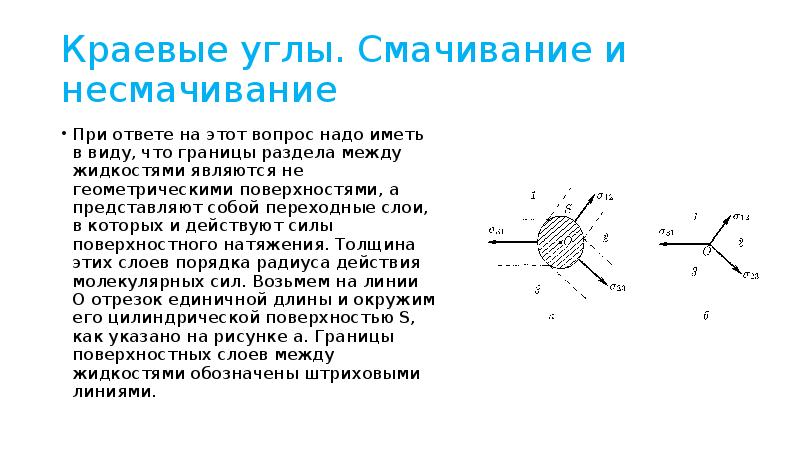
- 16. Краевые углы. Cмачивание и несмачивание Допустим, что три жидких среды 1,2,3
- 17. Краевые углы. Cмачивание и несмачивание При ответе на этот вопрос надо
- 18. Краевые углы. Cмачивание и несмачивание Для равновесия необходимо, чтобы силы, действующие
- 19. Краевые углы. Cмачивание и несмачивание Силой веса и гидростатического давления можно
- 20. Краевые углы. Cмачивание и несмачивание Примером, когда три среды граничат между
- 21. Краевые углы. Cмачивание и несмачивание Этими формулами однозначно определяются углы 1
- 22. Краевые углы. Cмачивание и несмачивание Аналогично ведет себя капля жидкости на
- 23. Краевые углы. Cмачивание и несмачивание Надо требовать лишь обращения в нуль
- 24. Краевые углы. Cмачивание и несмачивание Угол называется краевым углом. Его
- 25. Краевые углы. Cмачивание и несмачивание В большинстве случаев имеет место частичное
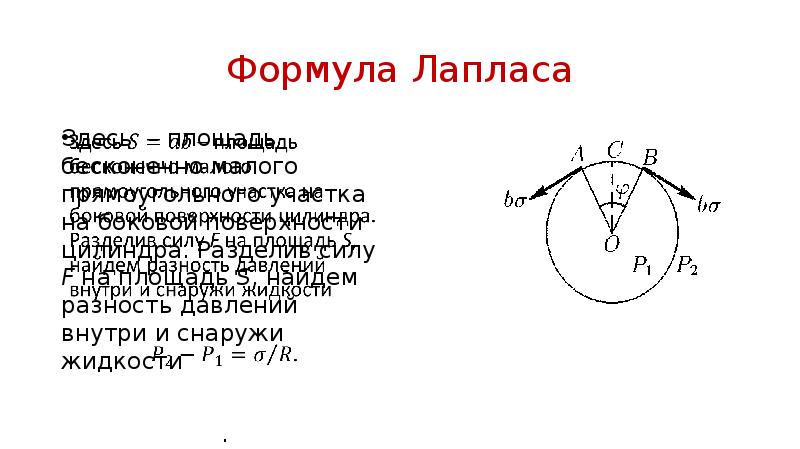
- 26. Формула Лапласа Если поверхность жидкости – кривая, то при равновесии давления
- 27. Формула Лапласа Выберем на его поверхности бесконечно малый участок АВ, стягиваемый
- 28. Формула Лапласа Здесь – площадь бесконечно малого прямоугольного участка на боковой
- 29. Формула Лапласа Обобщим теперь эту формулу на случай, когда жидкость ограничена
- 30. Формула Лапласа Пусть R1 – радиус кривизны дуги АВ. Радиус кривизны
- 31. Формула Лапласа Модуль результирующей всех сил поверхностного натяжения, действующих на границах
- 32. Формула Лапласа Если поверхность жидкости – сферическая, то R1 = R2
- 33. Капиллярные явления Применим формулу Лапласа для расчета высоты поднятия жидкости в
- 34. Капиллярные явления . В рассматриваемом случае P1 есть атмосферное давление, а
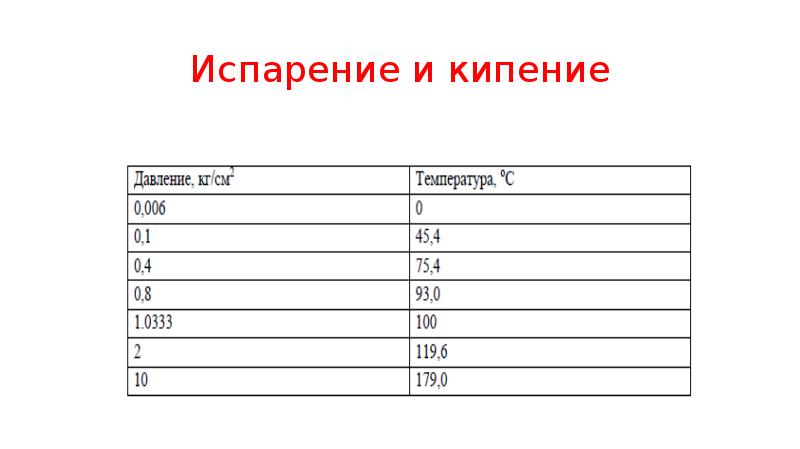
- 35. Испарение и кипение Если жидкость в сосуде нагревать при постоянном внешнем
- 36. Испарение и кипение На поверхности каждого пузырька непрерывно идет испарение жидкости
- 37. Испарение и кипение
- 38. Зависимость давления насыщенного пара от кривизны поверхности Жидкость находится в сообщающихся
- 39. Зависимость давления насыщенного пара от кривизны поверхности Остается найти величину h.
- 40. Зависимость давления насыщенного пара от кривизны поверхности Тогда получим .
- 41. Растворы Растворами называют физически однородные смеси двух или нескольких веществ. В
- 42. Растворы Раствор называется идеальным, если взаимодействия между молекулами растворителя и растворенного
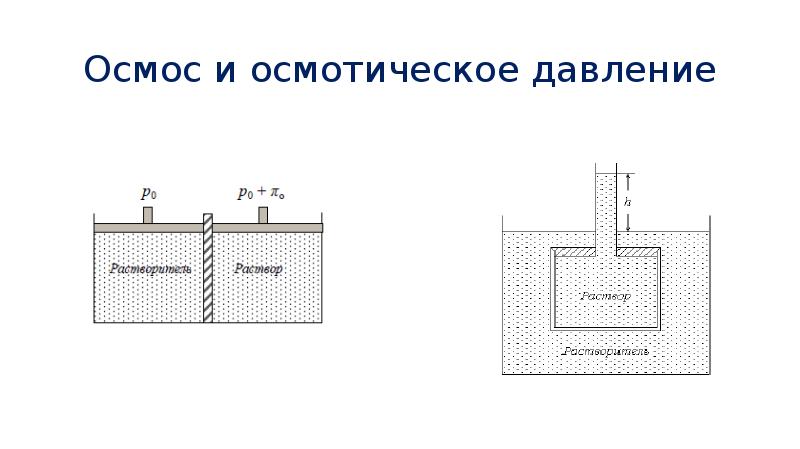
- 43. Осмос и осмотическое давление Существуют, однако, перегородки, проницаемые для молекул растворителя
- 44. Осмос и осмотическое давление
- 45. Осмос и осмотическое давление Существование осмотического давления объясняется следующим образом. Так
- 46. Осмос и осмотическое давление Для слабых растворов осмотическое давление можно найти,
- 47. Осмос и осмотическое давление Молекулярная природа явления осмоса до сих пор
- 48. Осмос и осмотическое давление Осмос играет важную роль в жизнедеятельности животных
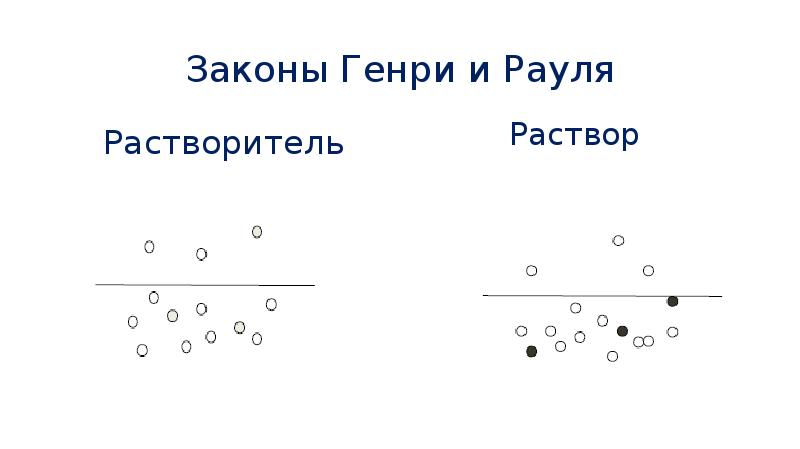
- 49. Законы Генри и Рауля Пусть имеется газ, находящийся в равновесии со
- 50. Законы Генри и Рауля Если над поверхностью жидкости находится смесь разных
- 51. Законы Генри и Рауля Если в жидкости растворено нелетучее вещество, то
- 52. Законы Генри и Рауля Растворитель
- 53. Законы Генри и Рауля Растворенное вещество занимает часть поверхностного слоя жидкости,
- 54. Законы Генри и Рауля Тогда указанная пропорциональность позволяет утверждать, что
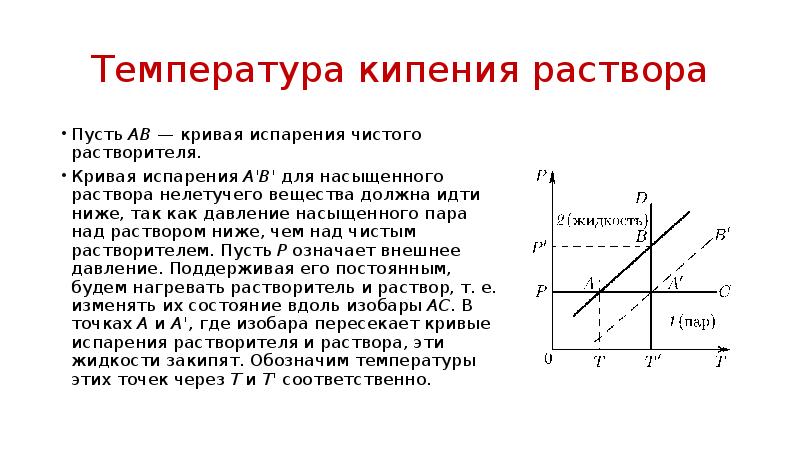
- 55. Температура кипения раствора Из этого закона следует, что при одном и
- 56. Температура кипения раствора Пусть АВ — кривая испарения чистого растворителя. Кривая
- 57. Температура кипения раствора Для вычисления Т' через точку А' проведем изотерму
- 58. Температура кипения раствора Для вычисления Т' через точку А' проведем изотерму
- 59. Температура кипения раствора По уравнению Клапейрона—Клаузиуса, если пренебречь удельным объемом жидкости
- 60. Температура кипения раствора Почленным делением находим , или, пренебрегая различием P
- 61. До следующей лекции
- 62. Скачать презентацию






















































Слайды и текст этой презентации
Скачать презентацию на тему Физика поверхностных явлений. Свойства растворов можно ниже:
Похожие презентации





























