Гальванические элементы презентация
Содержание
- 2. План лекции Общие понятия Расчет ЭДС гальванических элементов Диффузионный потенциал Мембранный
- 3. Гальванический элемент Устройство, состоящее из двух электродов, дающее возможность получать электрический
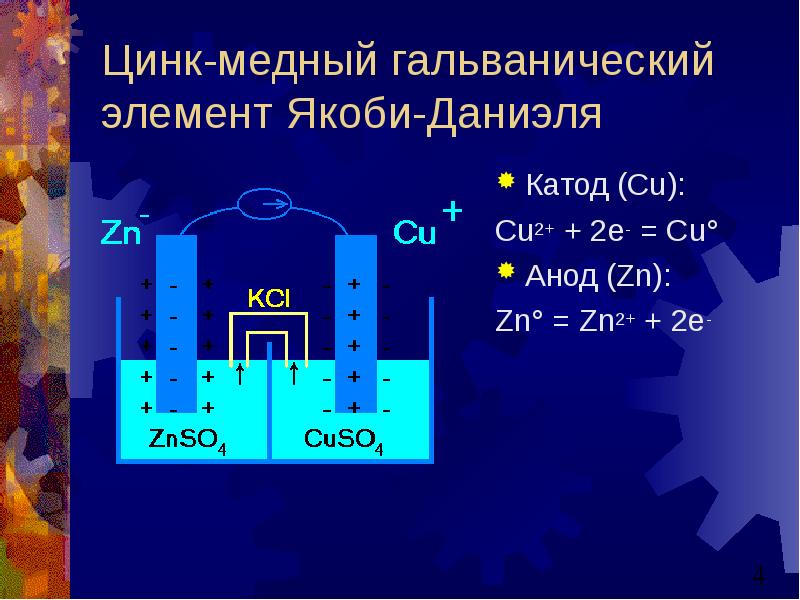
- 4. Цинк-медный гальванический элемент Якоби-Даниэля Катод (Сu): Cu2+ + 2e- = Cu°
- 5. ЭДС гальванического элемента, составленного из двух металлов Из потенциала положительно заряженного
- 6. ЭДС зависит от: ЭДС зависит от: Положения металлов в ряду напряжений
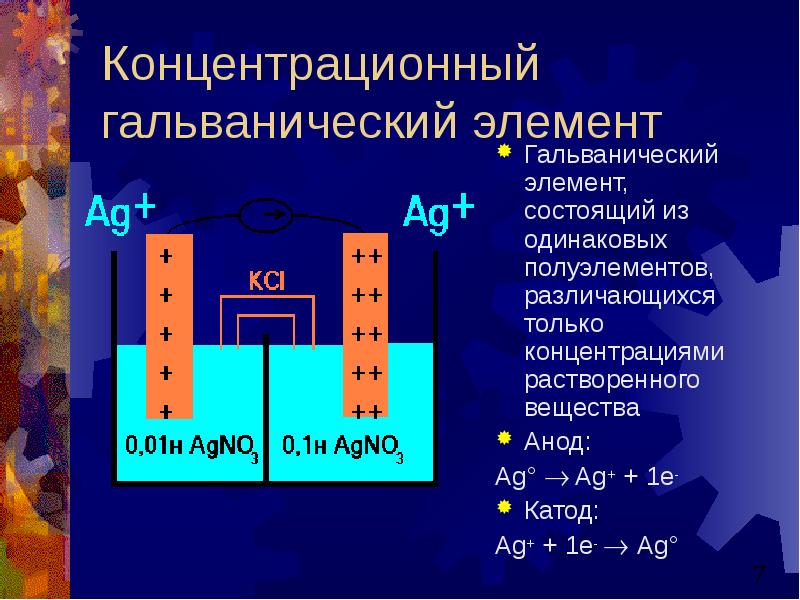
- 7. Концентрационный гальванический элемент Гальванический элемент, состоящий из одинаковых полуэлементов, различающихся только
- 8. ЭДC концентрационного гальванического элемента ЭДС = ЕAg1 – EAg2
- 9. Измеряя ЭДС концентрационного элемента можно практически определить: Измеряя ЭДС концентрационного
- 10. Пример Цепь из двух водородных электродов: нормального – электрод сравнения и
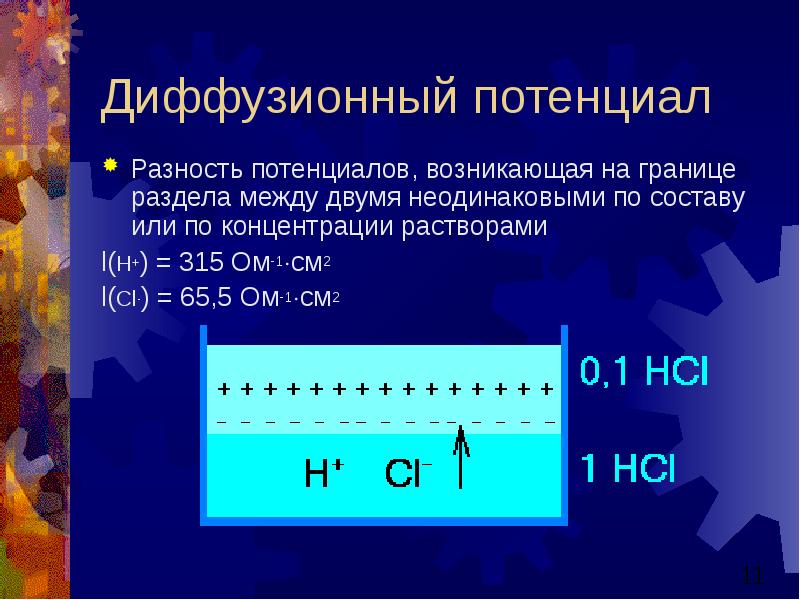
- 11. Диффузионный потенциал Разность потенциалов, возникающая на границе раздела между двумя неодинаковыми
- 12. Диффузионный потенциал усредняет скорости движения ионов при сохранении скачка потенциала на
- 13. Диффузионные потенциалы в биологических объектах Потенциал повреждения (поврежденная ткань заряжается отрицательно)
- 14. Межфазовые потенциалы Возникают: На границе раздела между двумя несмешивающимися жидкостями; обусловлены
- 15. Мембранный потенциал Потенциал, возникающий на мембране с избирательной проницаемостью (пропускающей только
- 16. Потенциал покоя мембранный потенциал, возникающий между внутренней и наружной сторонами клеточной
- 17. Возбужденное состояние клетки проницаемость мембраны для ионов Na+ Перемена знака
- 18. Потенциал действия Разность между потенциалом покоя и зарядом мембраны в возбужденном
- 19. Потенциометрия Физико-химический метод анализа, в основе которого лежит измерение ЭДС цепи,
- 20. Методы потенциометрии Прямые – определение активности и концентрации ионов или веществ
- 21. Прямая потенциометрия Электроды сравнения – электроды, потенциал которых практически постоянен, легко
- 22. Индикаторные электроды Мембранные: ионоселективные – способны определять в растворе концентрацию одного
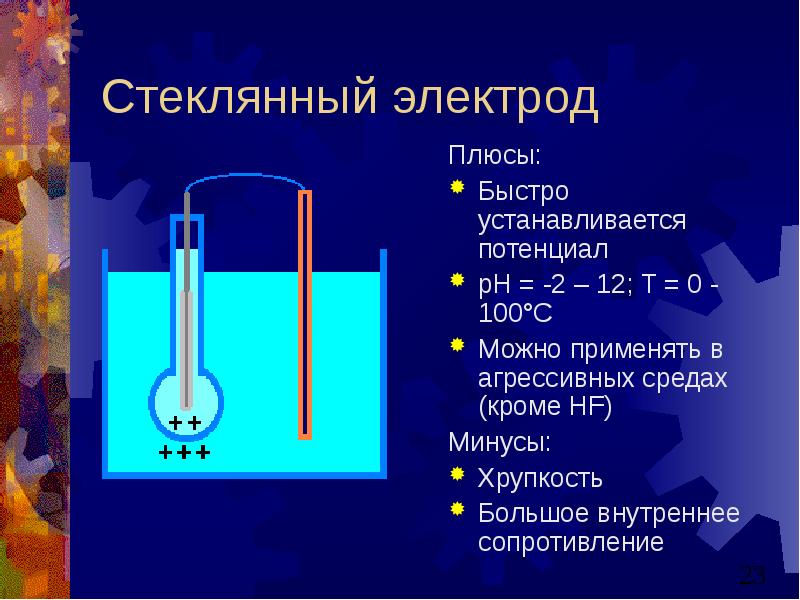
- 23. Стеклянный электрод Плюсы: Быстро устанавливается потенциал рН = -2 – 12;
- 24. Ионоселективные электроды Действие основано на возникновении мембранного потенциала на мембране с
- 25. Мембранный электрод С твердыми мембранами – метеллическая или кристаллическая пластинка, содержащая
- 26. Ферментные электроды Мочевино-селективный уреаза СО(NH2)2 NH4+ Пенициллино-селективный пенициллиназа Пенициллин
- 27. Косвенная потенциометрия (потенциометрическое титрование) График зависимости ЭДС цепи от объема титранта
- 28. Значение потенциометрических методов исследования Определение концентрации веществ в мутных и окрашенных
- 29. Скачать презентацию
























Слайды и текст этой презентации
Похожие презентации





























