Гидролиз презентация
Содержание
- 2. Цель: Ознакомиться с понятием гидролиз, его особенностями , методами получения и
- 3. Содержание: -Определение -Особенности -Схема образования -Примеры - Приминение -Тест -Вывод -Литература
- 4. Определение: Гидролиз- один из видов химических реакций, где при взаимодействии веществ
- 5. Особенности Гидролиз органических веществ Живые организмы осуществляют гидролиз различных органических веществ
- 6. Обратимый и необратимый гидролиз. Все рассмотренные процессы гидролиза органических соединений -
- 7. Гидролиз солей Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций
- 8. Гидролиз солей Различают обратимый и необратимый гидролиз солей: 1. Гидролиз соли
- 10. Гидролиз соли слабой кислоты и слабого основания: (равновесие смещено в сторону
- 11. Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор
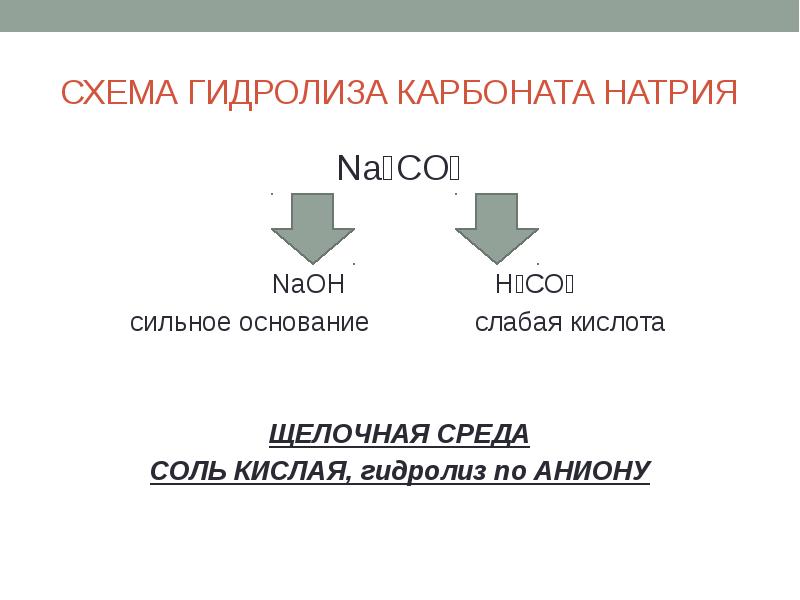
- 12. СХЕМА ГИДРОЛИЗА КАРБОНАТА НАТРИЯ Na₂CO₃
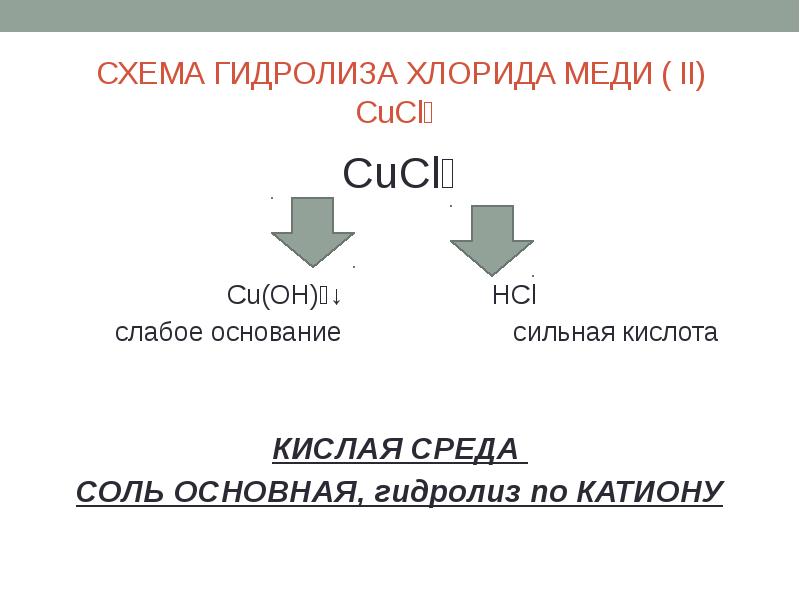
- 13. СХЕМА ГИДРОЛИЗА ХЛОРИДА МЕДИ ( II) CuCl₂ CuCl₂
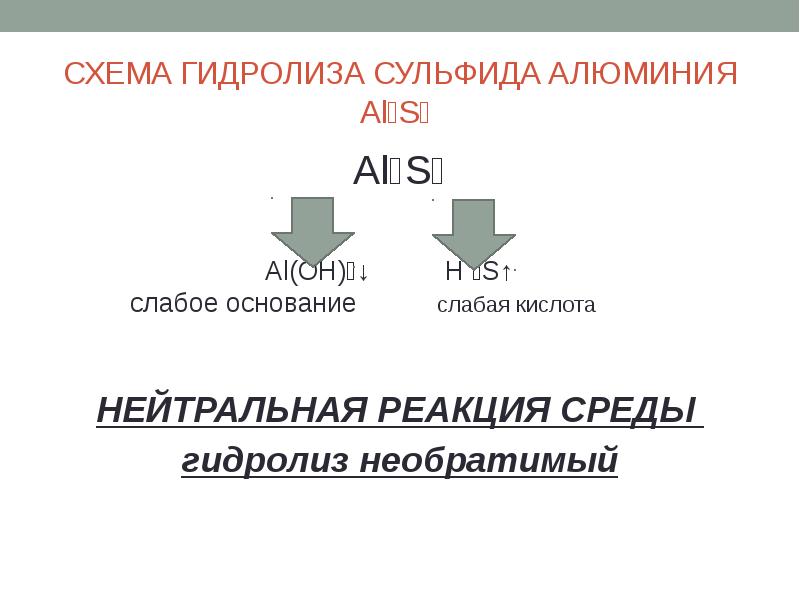
- 14. СХЕМА ГИДРОЛИЗА СУЛЬФИДА АЛЮМИНИЯ Al₂S₃ Al₂S₃
- 15. Примеры: НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА: Гидридов: CaH2+2H2O=Ca(OH)2+2H2↑ Солей: CH3COONH4+H2 CH3COOH+NH4OH ОРГАНИЧЕСКИЕ
- 16. Применение: Применение: 1.Основной компонент мыла – это натриевые или калиевые соли
- 17. Практическая часть (1)Гидролиз солей-это взаимодействие с водой: а)Катионов или анионов любой(
- 20. (2.) При гидролизе соли по аниону взаимодействует с водой: а)анион любой
- 23. (3.) При гидролизе клетчатки ( крахмала ) могут образовываться: а) глюкоза
- 26. (4.) Среда раствора в результате гидролиза карбоната натрия а) щёлочная
- 29. (5.) Среда раствора в результате гидролиза хлорида меди(2): а) слабощёлочная
- 32. (6.) При гидролизе сложных эфиров образуется: а)Спирты и альдегиды б)Карбоновые
- 35. (7.) Необратимый гидролиз- один ( лучше оба) из продуктов гидролиза должен быть
- 38. Литература: https://ru.wikipedia.org/wiki/Гидролиз http://infourok.ru/rol_i_prakticheskoe_primenenie_gid.. http://ppt4web.ru/khimija/gidroliz-solejj0.html Учебник Химия. 11 класс. Базовый уровень Габриелян
- 39. Скачать презентацию


































Слайды и текст этой презентации
Похожие презентации





























