Иониты и цеолиты. Цеолитные катализаторы презентация
Содержание
- 2. Цеолитные катализаторы Все природные и большинство синтетических цеолитов представляют собой
- 3. Активация цеолитных катализаторов Активация цеолитных катализаторов Цеолитные катализаторы в некоторых процессах
- 4. Катализаторы на основе ионообменных смол (ионитов) Катализ ионитами развился в
- 5. Активные группы в ионитах после диссоциации способны к обмену ионами при
- 6. Использование ионитов в качестве катализаторов Преимущества перед кислотами и щелочами:
- 7. Варианты синтеза ионитов По реакции полимеризации или поликонденсации из исходных мономеров
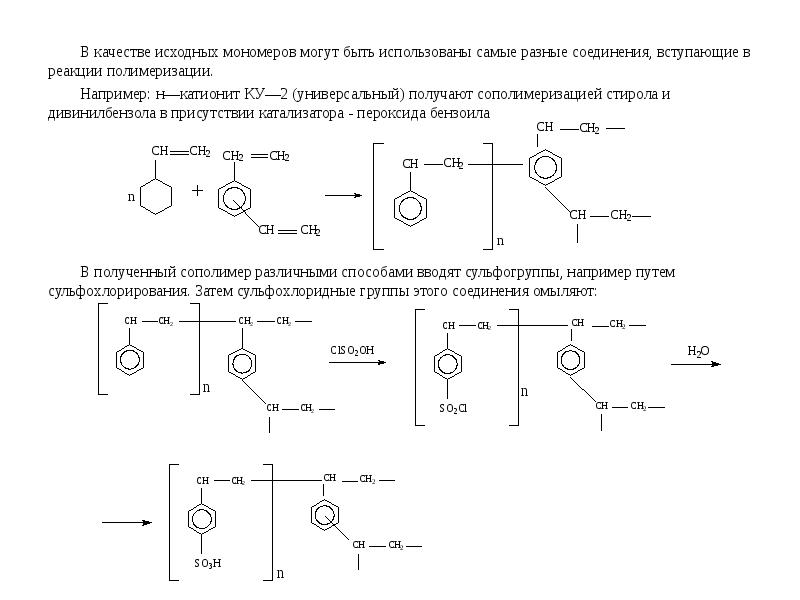
- 8. В качестве исходных мономеров могут быть использованы самые разные соединения, вступающие
- 9. Скачать презентацию







Слайды и текст этой презентации
Скачать презентацию на тему Иониты и цеолиты. Цеолитные катализаторы можно ниже:
Похожие презентации





























