Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение презентация
Содержание
- 2. Карбоновыми кислотами называются производные углеводородов, в молекуле которых содержится одна или
- 3. Модели молекул
- 4. Номенклатура Распространены тривиальные названия. По правилам IUPAC к названию углеводорода
- 5. Изомерия. Для алифатических кислот - изомеризация углеводородного радикала. Для ароматических
- 6. Физические свойства С1- С3 жидкости с характерным резким запахом С4- С9
- 7. Получение Окисление первичных спиртов и альдегидов (кислородом на катализаторе; KMnO4; K2Cr2O7):
- 8. Химические свойства Карбоновые кислоты- слабые электролиты, в водном растворе диссоциируют:
- 9. Взаимодействие с солями более слабых и летучих кислот: Взаимодействие с солями
- 10. Применение Муравьиная кислота – в медицине, в пчеловодстве, в органическом
- 11. Какие вещества образуются, если в реакцию вступят вещества, модели молекул которых
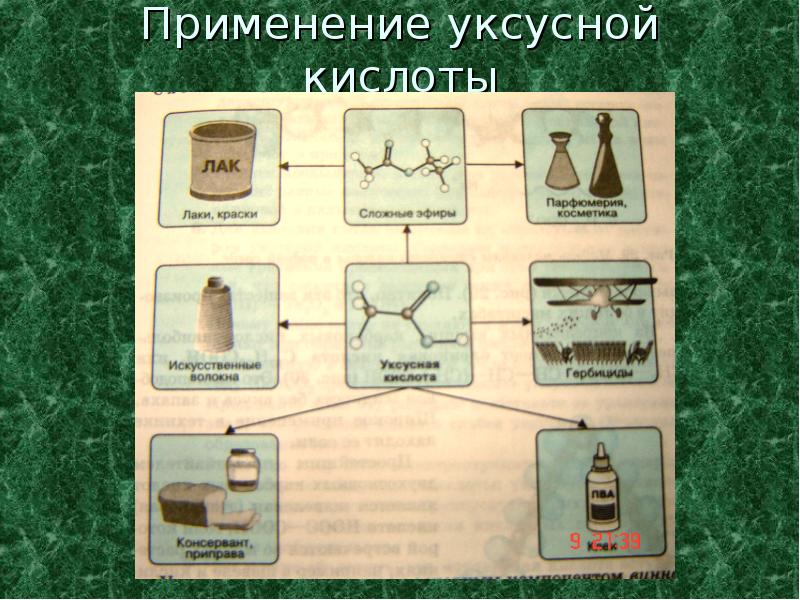
- 12. Применение уксусной кислоты
- 13. Скачать презентацию











Слайды и текст этой презентации
Скачать презентацию на тему Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение можно ниже:
Похожие презентации





























