Кинетика химических реакций. Основные понятия и законы химической кинетики презентация
Содержание
- 2. Химическая кинетика – учение о скоростях химических реакций и влиянии различных
- 3. Химическая кинетика изучает протекание процессов во времени, т.е. в неравновесном состоянии
- 13. Причины несовпадения молекулярности и порядка
- 15. Кинетика необратимых реакций целого порядка Основной постулат формальной кинетики объединяет два
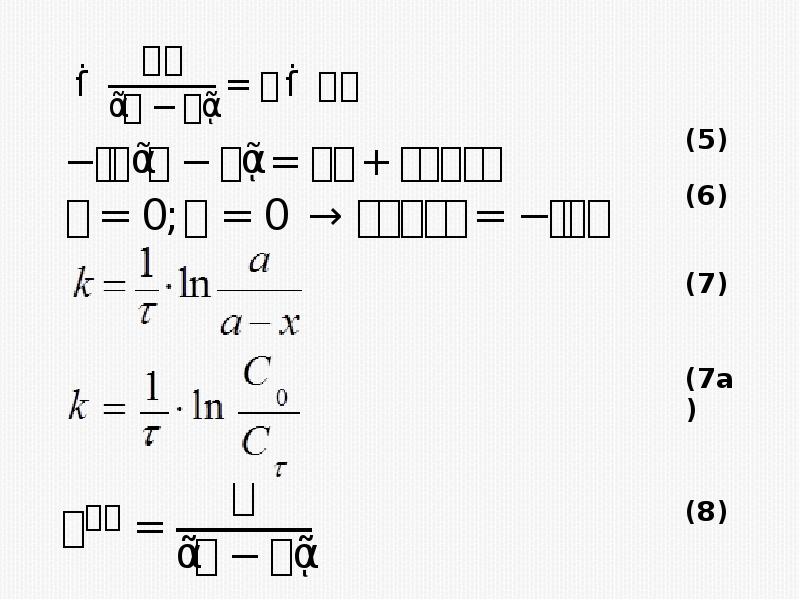
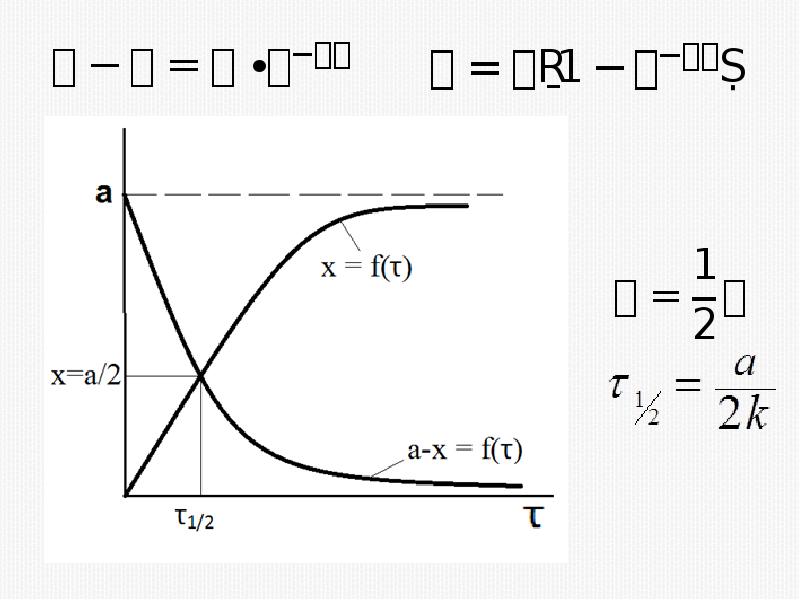
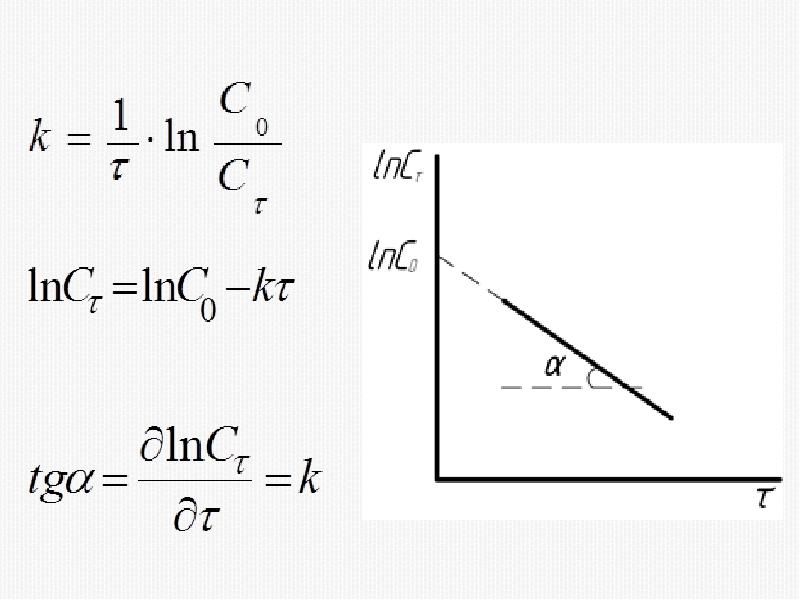
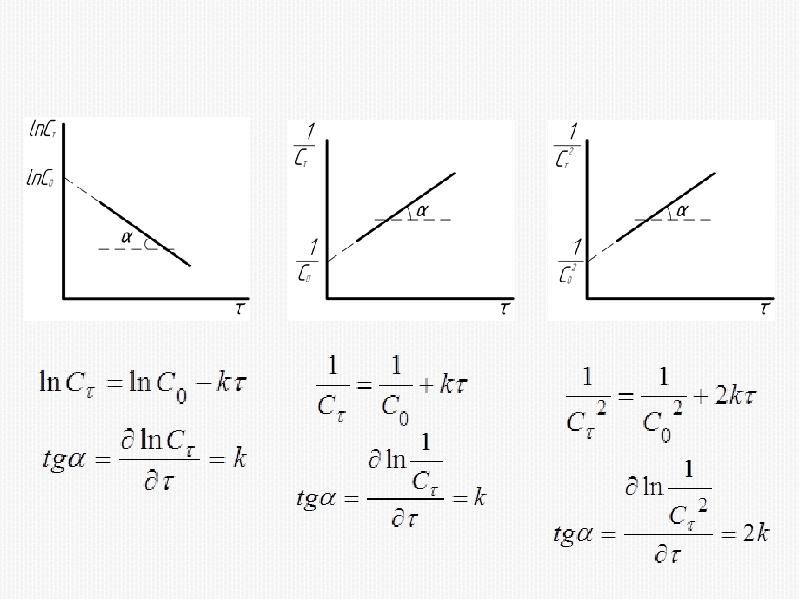
- 16. Кинетическое уравнение реакции первого порядка
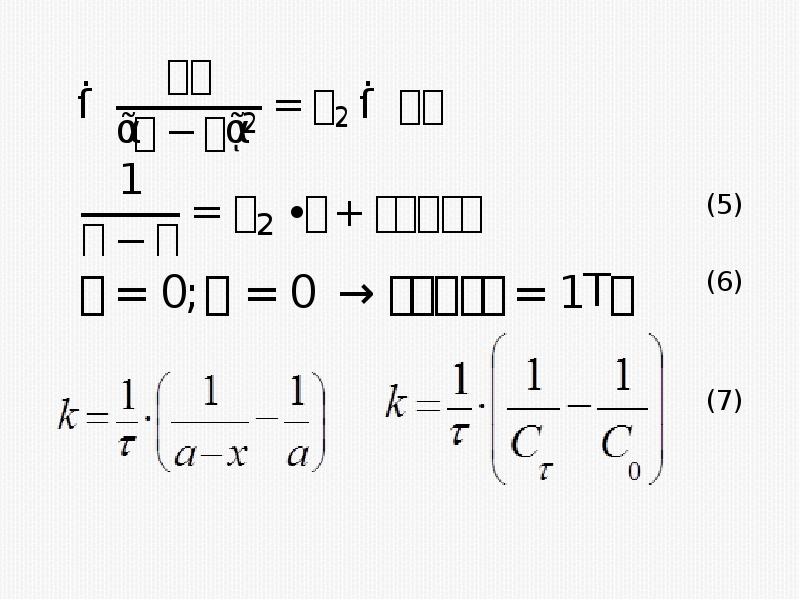
- 20. Кинетическое уравнение реакции второго порядка
- 23. Кинетическое уравнение реакции третьего порядка
- 25. Методы определения порядка реакции Порядок реакции является эмпирической величиной и не
- 27. Интегральные методы определения порядка реакции метод подстановки (аналитический и графический) метод
- 28. 1) Метод подстановки
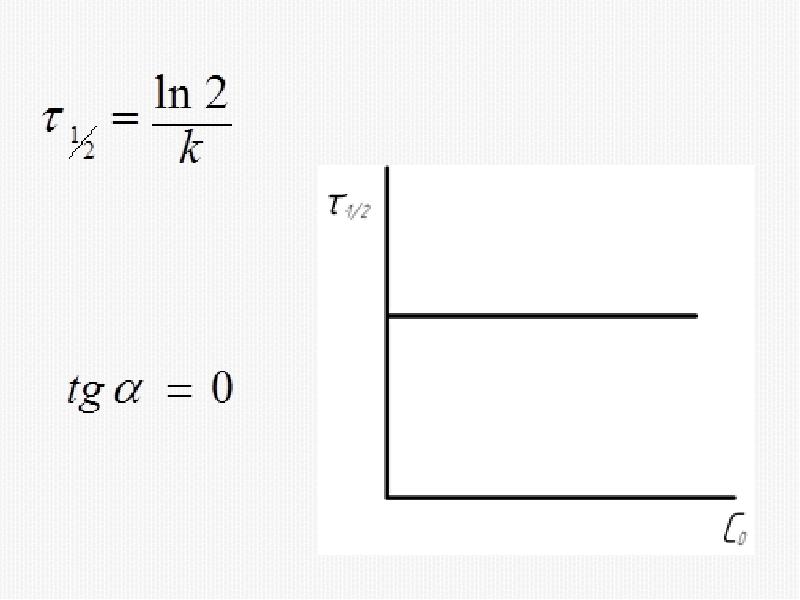
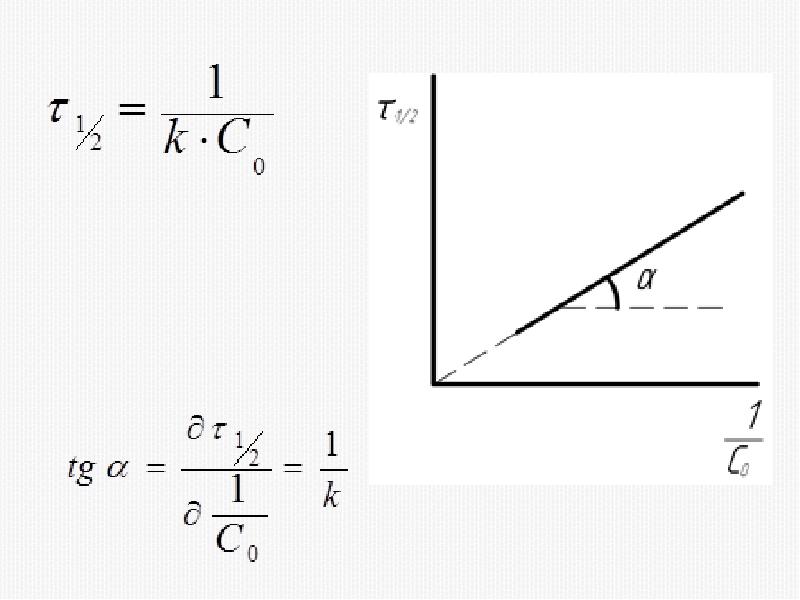
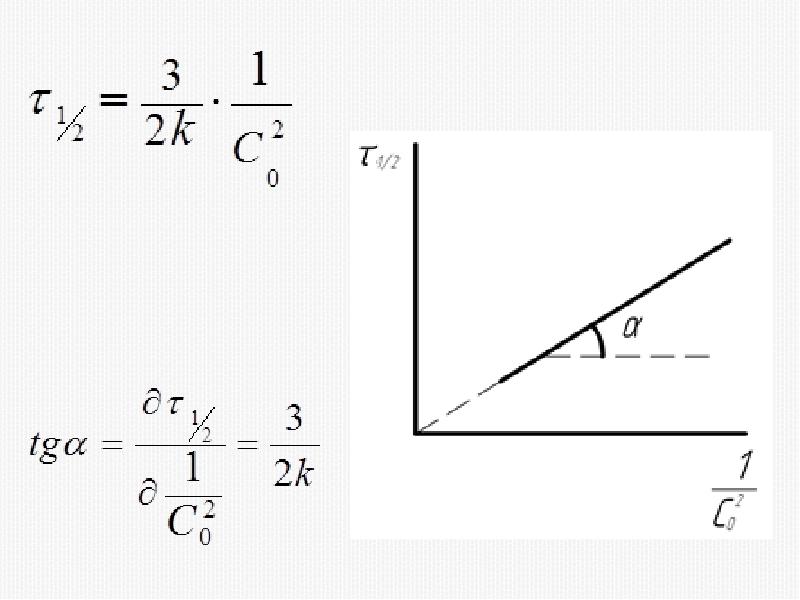
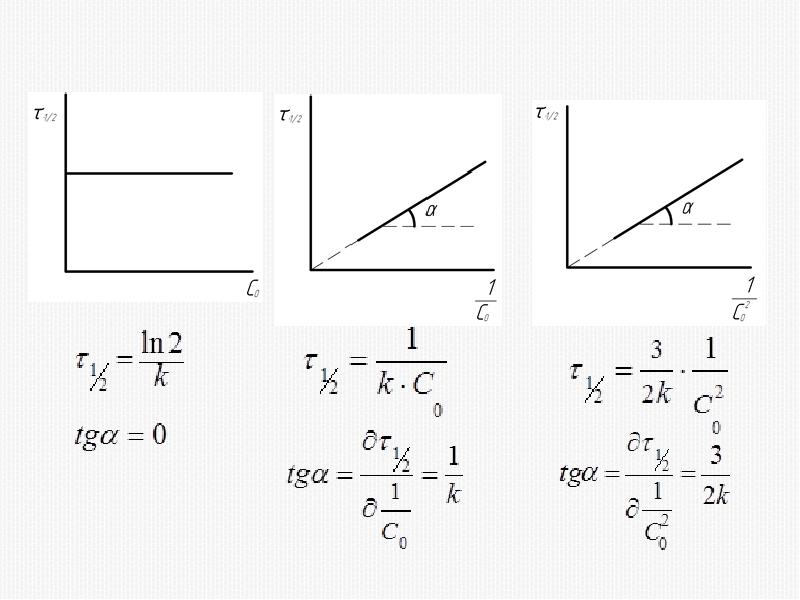
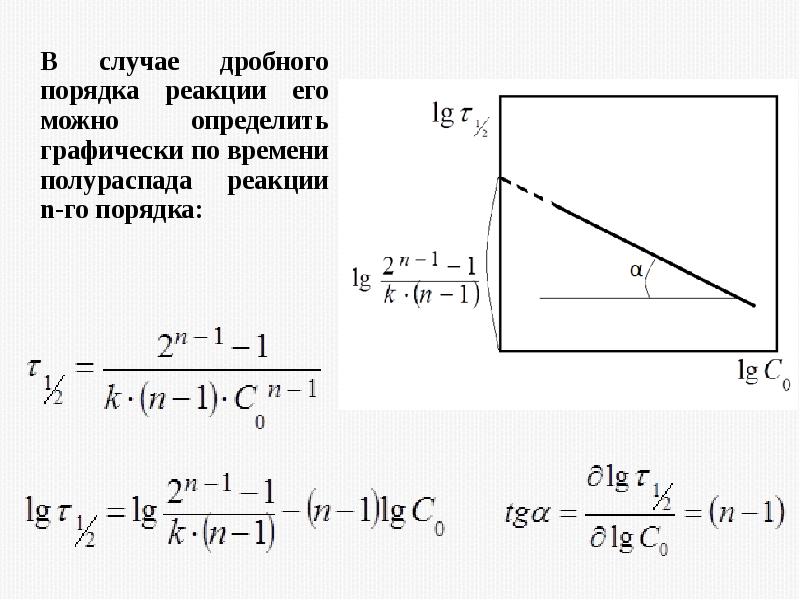
- 33. 2) Метод времени полупревращения
- 39. 3) Метод Оствальда-нойеса
- 40. дифференциальные методы определения порядка реакции метод избытка или изоляции (графический метод
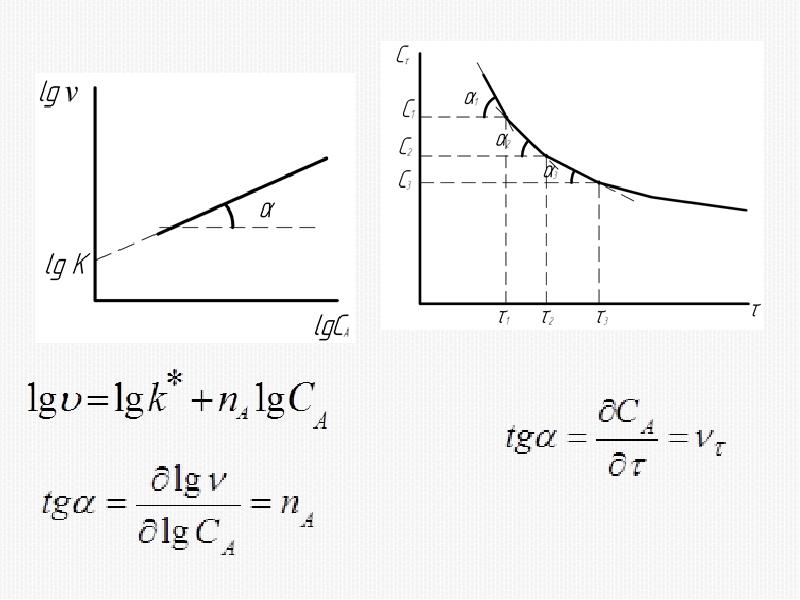
- 41. 1) Метод избытка (изоляции)
- 43. 2) Метод Вант-Гоффа
- 44. Скачать презентацию


















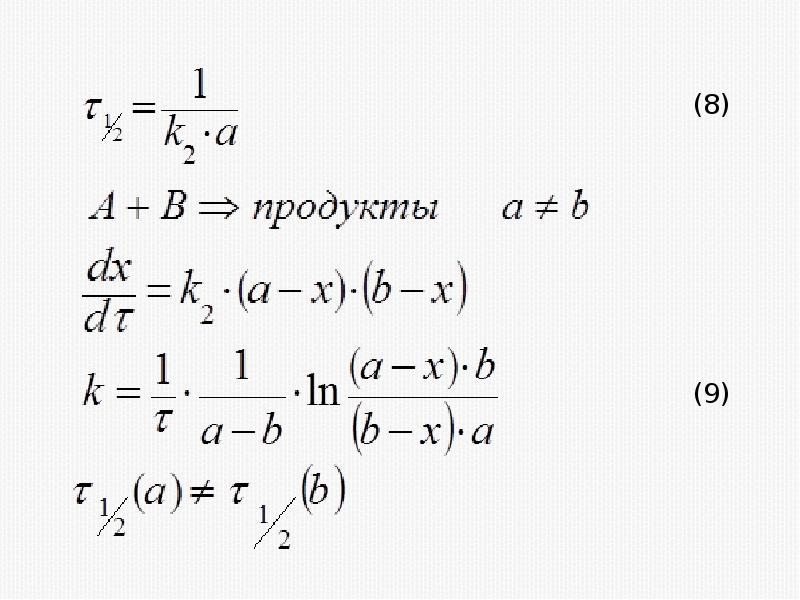

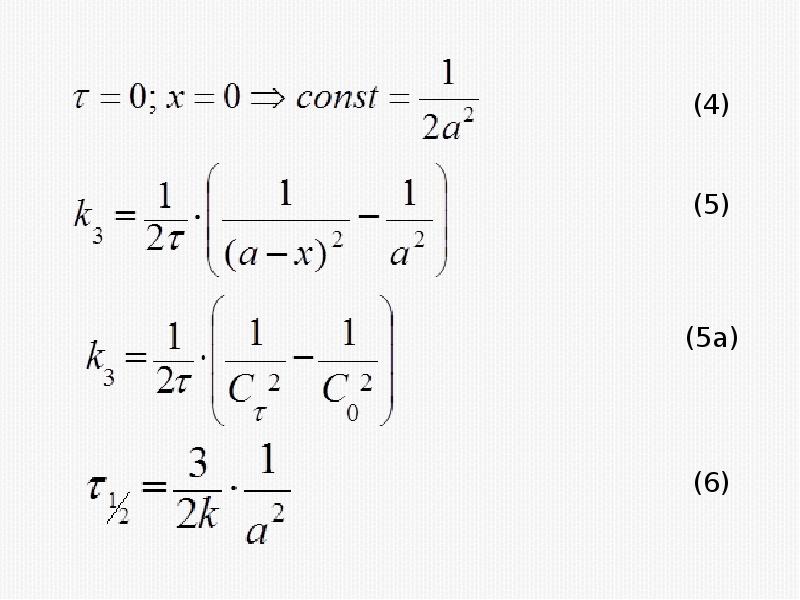




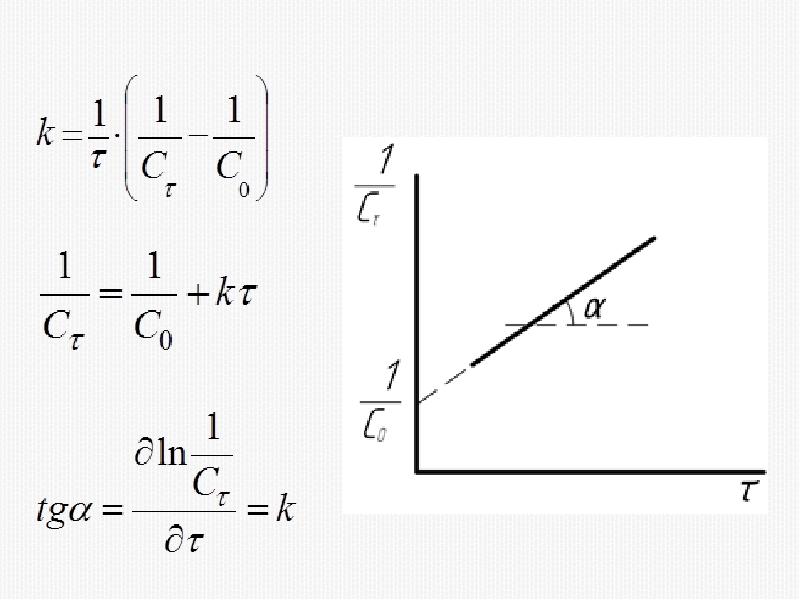






Слайды и текст этой презентации
Скачать презентацию на тему Кинетика химических реакций. Основные понятия и законы химической кинетики можно ниже:
Похожие презентации





























