Кислоты: названия, получение, свойства, применение презентация
Содержание
- 2. это сложные вещества, имеющие в своем составе водород, способный замещаться на
- 3. “Из всех кислот она конечно, прима! Присутствует везде и зримо и
- 4. Для взрывчатых веществ нужна она, для красителей, лаков, лекарств идет самая
- 5. Алхимикам удалось получить эту кислоту еще в X веке при прокаливании
- 10. Кислотный оксид +Н2О = Кислота SO3 + Н2О = Н2SO4 Кислотный
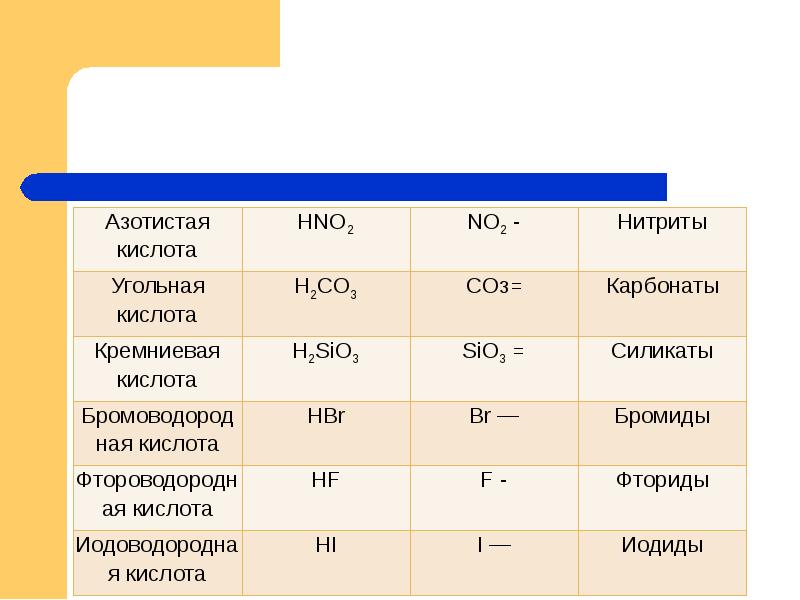
- 11. Формулы некоторых кислот и кислотных остатков.
- 14. а) жидкости (кроме кремниевой кислоты), б) без цвета, в) без запаха,
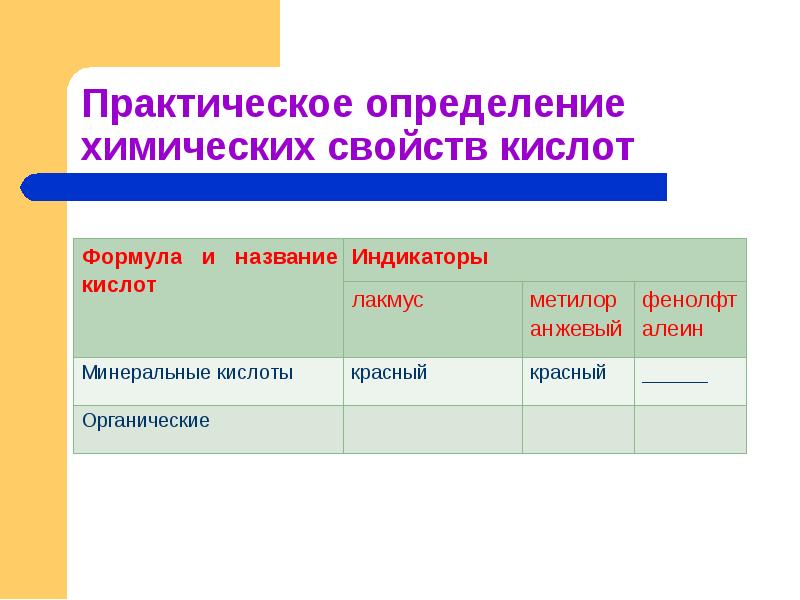
- 16. Действие индикатора. Действие индикатора. Взаимодействие с металлами. Взаимодействие с
- 17. §20,стр 76 таблица §20,стр 76 таблица Кому было легко – упражнение
- 20. Скачать презентацию





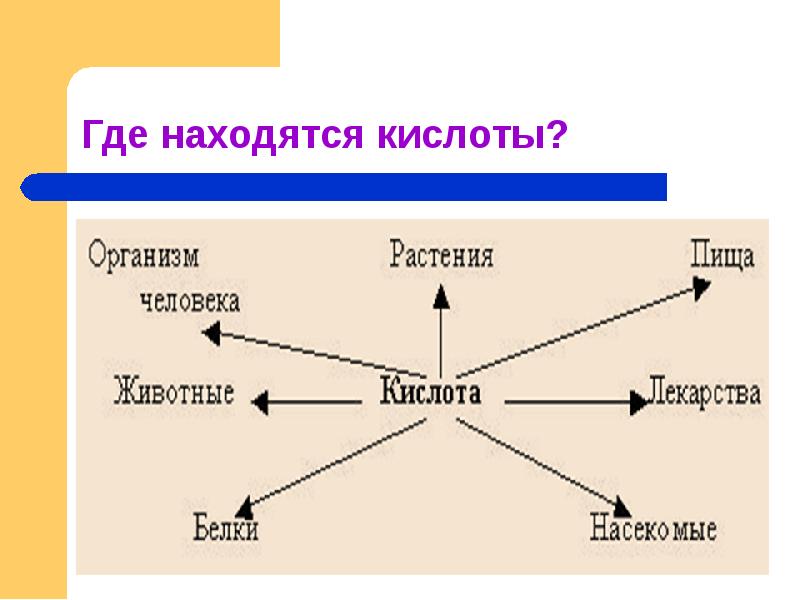
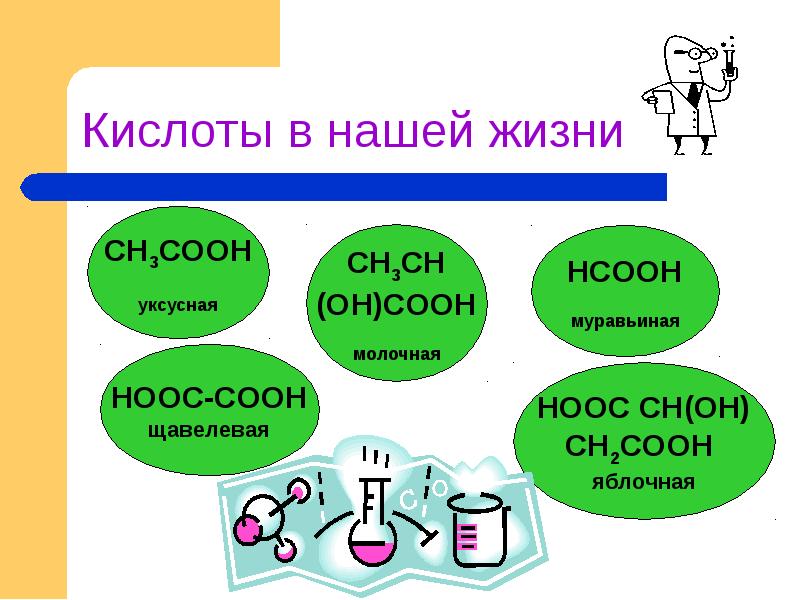
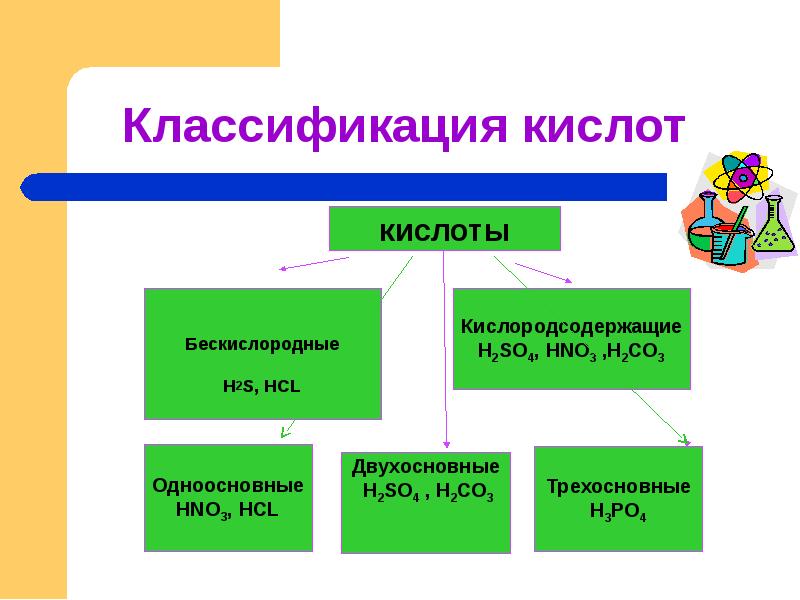


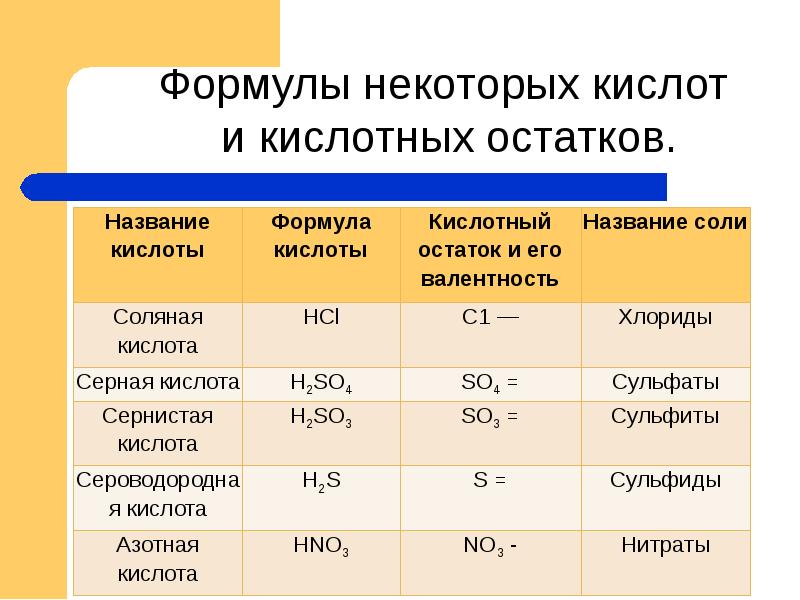






Слайды и текст этой презентации
Скачать презентацию на тему Кислоты: названия, получение, свойства, применение можно ниже:
Похожие презентации





























