Классификация дисперсных систем. Электрокинетические свойства и устойчивость коллоидных растворов. (Лекция 8) презентация
Содержание
- 2. Классификация дисперсных систем. Электрокинетические свойства и устойчивость коллоидных растворов Лекция №8
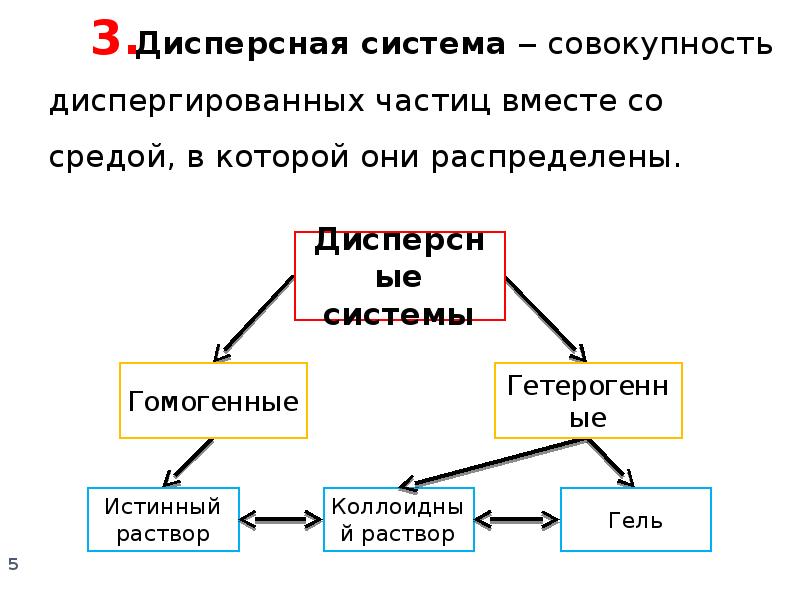
- 3. Коллоидная химия ‒ … … наука о поверхностных явлениях и дисперсных
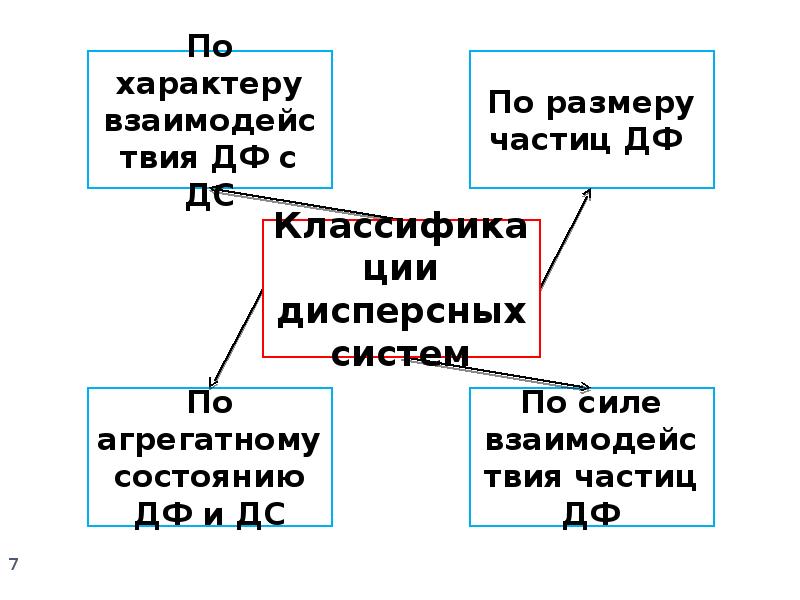
- 4. Основные понятия: Дисперсность ‒ мерой её служит удельная поверхность (Sуд). Sуд
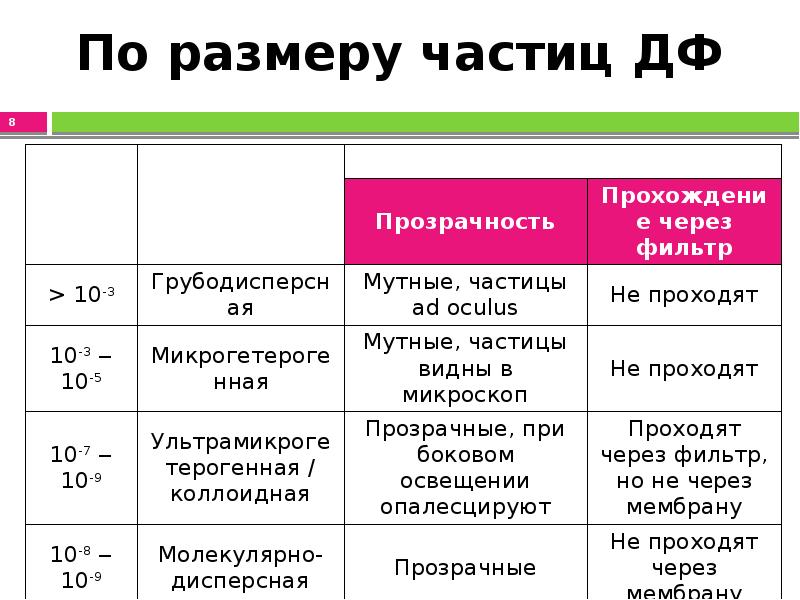
- 8. По размеру частиц ДФ
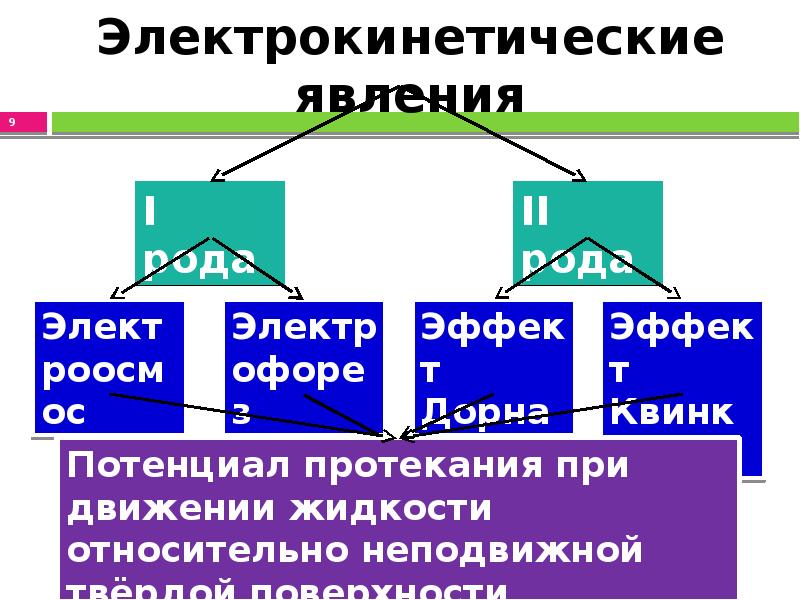
- 9. Электрокинетические явления
- 10. Мицеллярная теория лиофобных золей Мицелла ‒ гетерогенная микросистема, состоящая из микрокристалла
- 11. Мицеллярная теория лиофобных золей – агрегат с адсорбированными на нём потенциалопределяющими
- 12. Мицеллярная теория лиофобных золей – ядро с адсорбционным слоем противоионов, являющаяся
- 13. Получение золя конденсационным методом по реакции обмена
- 14. Мицелла
- 15. Факторы агрегативной устойчивости золя Одноимённый заряд коллоидных частиц; Гидратная (сольватная) оболочка,
- 16. Возникновение ДЭС и потенциалов в мицелле На границе между ядром и
- 17. Возникновение ДЭС и потенциалов в мицелле По величине 0 ≤ ζ
- 18. Факторы, влияющие на ζ Концентрация стабилизатора. Состояние ИЭТ золя, ζ =
- 20. Расчёт ζ Поскольку ζ обнаруживает себя при попадании мицеллы в электрическое
- 21. Виды устойчивости растворов (по Пескову) … устойчивость ДФ к агрегации (укрупнению)
- 22. Коагуляция ‒ … … процесс слипания частиц, образование крупных агрегатов с
- 23. Факторы, вызывающие коагуляцию Увеличение концентрации золя приводит к уменьшению расстояния между
- 24. Факторы, вызывающие коагуляцию Добавление электролитов наиболее сильное по 2-м причинам: из-за
- 27. Правило Дерягина ‒ Ландау …
- 28. Факторы, вызывающие коагуляцию Способность ионов одного заряда к гидратации (лиотропные ряды)
- 29. Факторы, вызывающие коагуляцию «Ионы-партнёры», идущие в паре с коагулирующими ионами, уменьшают
- 30. Особые случаи коагуляции Смесями электролитов; Многозарядными ионами‒коагуляторами (чередование зон коагуляции); При
- 32. 2. Чередование зон коагуляции
- 33. 3. Гетерокоагуляция
- 34. 4. Сенсибилизация … … вызвана добавлением очень малых количеств ВМС и
- 35. Вывод: адсорбционный слой является механическим препятствием для иона ‒ коагулянта. …повышение
- 36. Защитное число … … min масса ВМС (мг), достаточная для предотвращения
- 38. Теории коагуляции
- 40. Скачать презентацию



































Слайды и текст этой презентации
Скачать презентацию на тему Классификация дисперсных систем. Электрокинетические свойства и устойчивость коллоидных растворов. (Лекция 8) можно ниже:
Похожие презентации





























