Количество теплоты, для получения углекислого газа. Химическое равновесие. Примеры. (Лекция 4) презентация

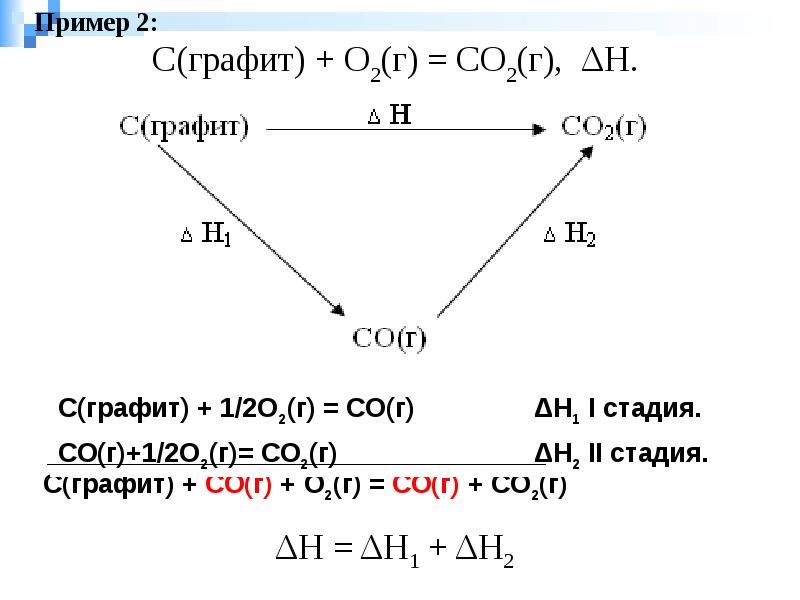







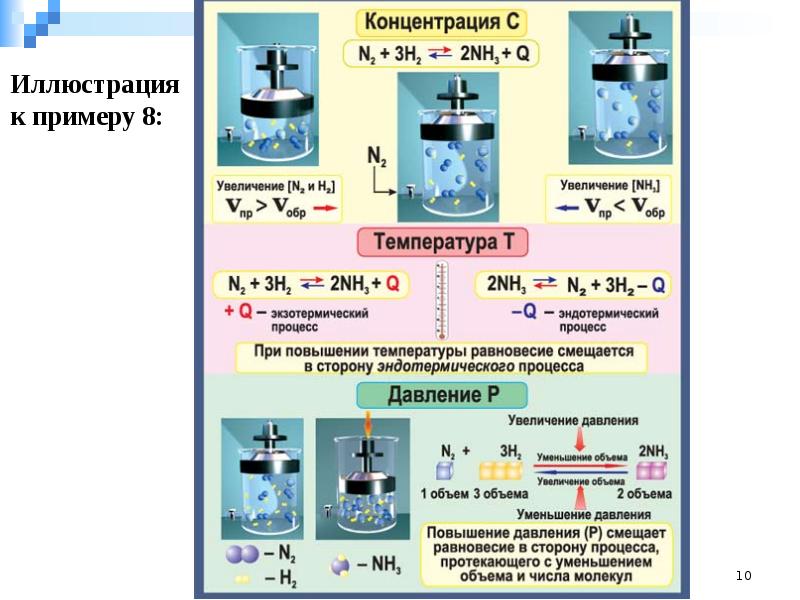
Слайды и текст этой презентации
Скачать презентацию на тему Количество теплоты, для получения углекислого газа. Химическое равновесие. Примеры. (Лекция 4) можно ниже:
Похожие презентации





























