Коллоидные растворы. Методы получения и очистки коллоидных растворов. Строение мицеллы гидрофобных систем. (Часть 1) презентация
Содержание
- 2. Коллоидная химия («коллоид» – от греческого κόλλα – клей) – наука,
- 3. История развития коллоидной химии Томас Грэм (Грэхэм) английский/шотладский химик впервые
- 4. История развития коллоидной химии
- 10. .
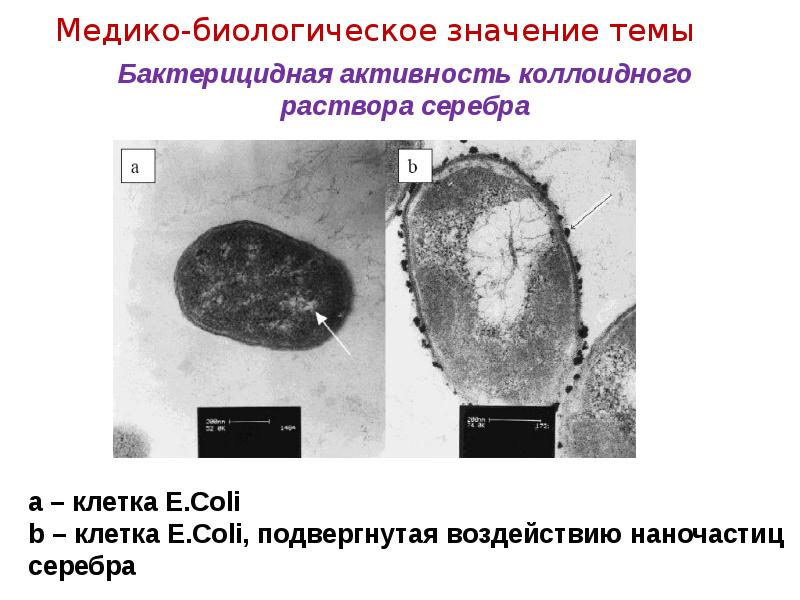
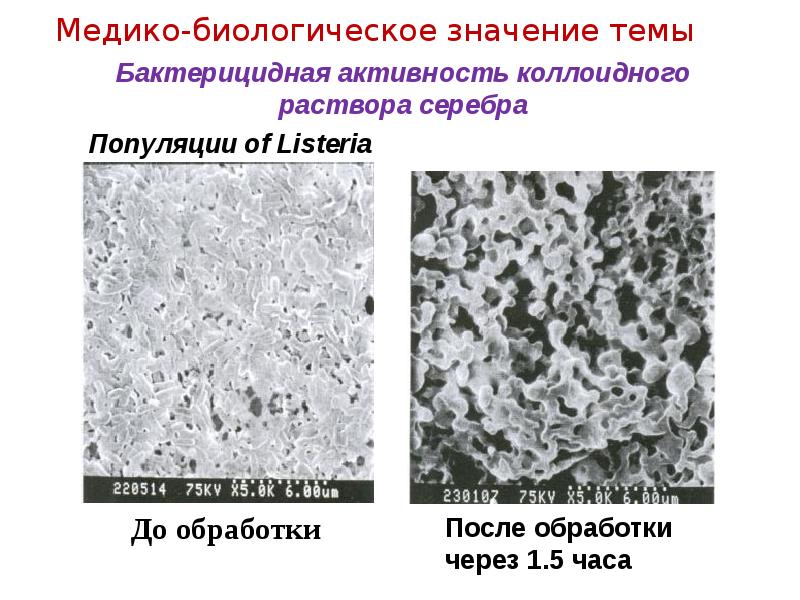
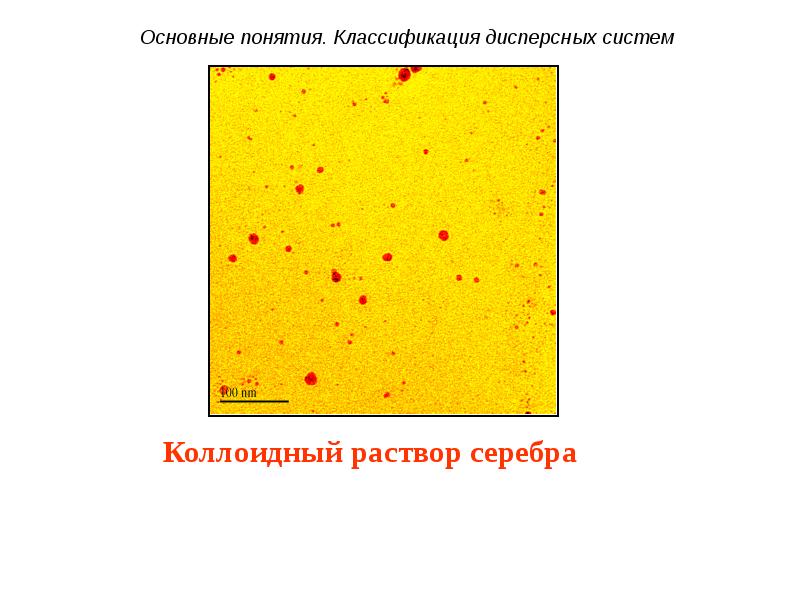
- 11. Бактерицидная активность коллоидного раствора серебра
- 12. Бактерицидная активность коллоидного раствора серебра
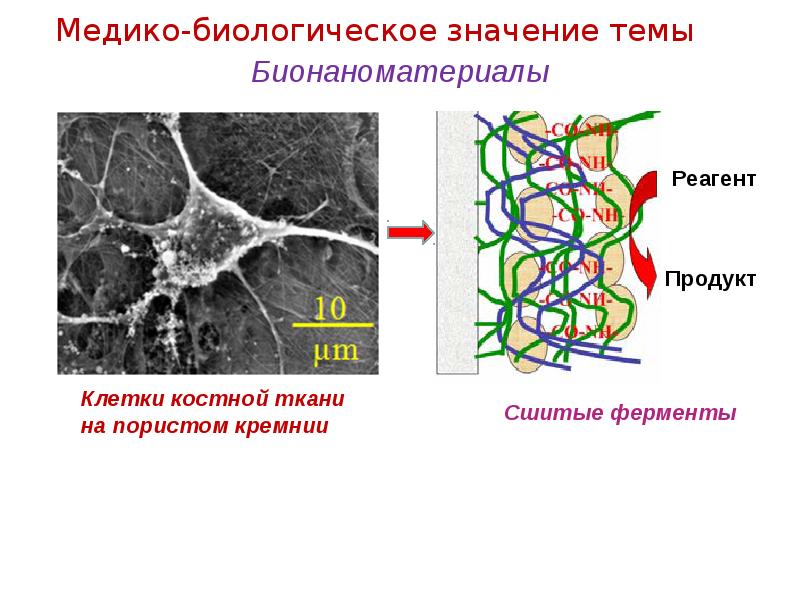
- 13. Бионаноматериалы
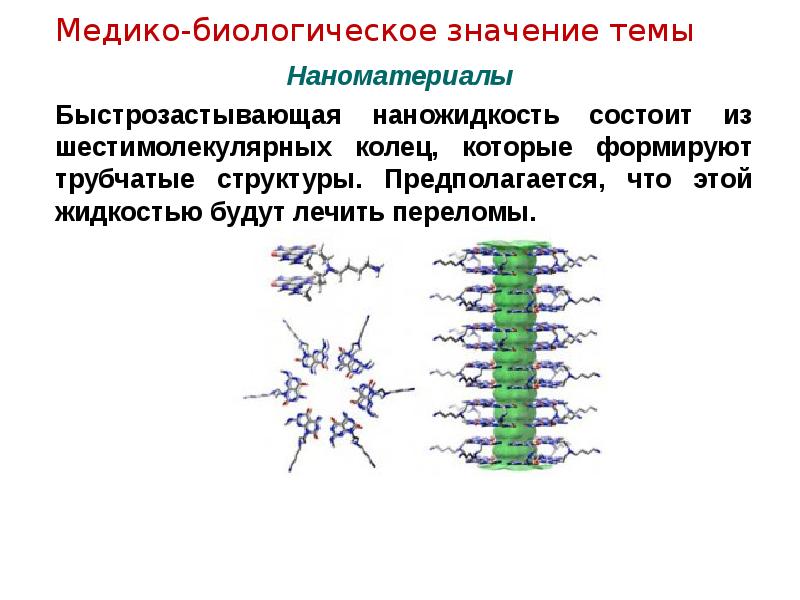
- 14. Наноматериалы Быстрозастывающая наножидкость состоит из шестимолекулярных колец, которые формируют трубчатые структуры.
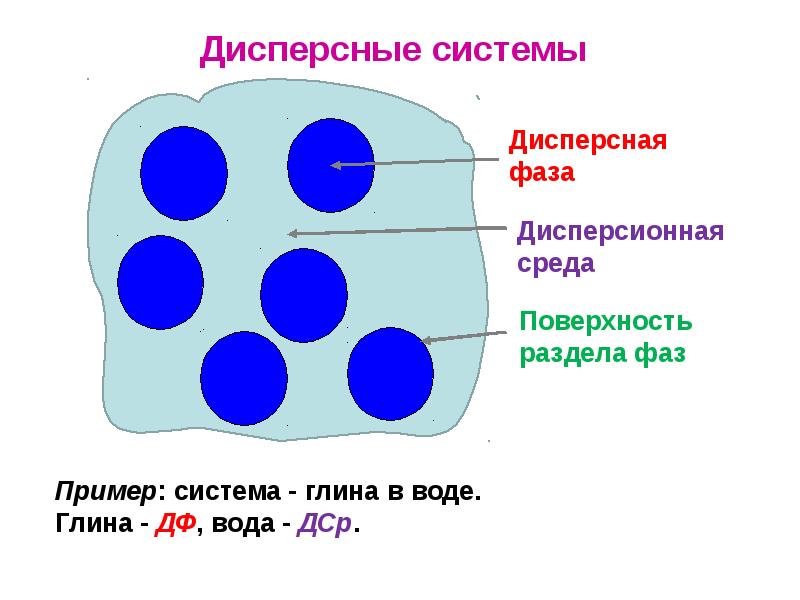
- 15. Основные понятия Два общих признака дисперсных систем: гетерогенность и дисперсность. Дисперсной системой
- 16. Классификация дисперсных систем Дисперсная фаза (ДФ) представляет собой частицы, а
- 17. Дисперсные системы
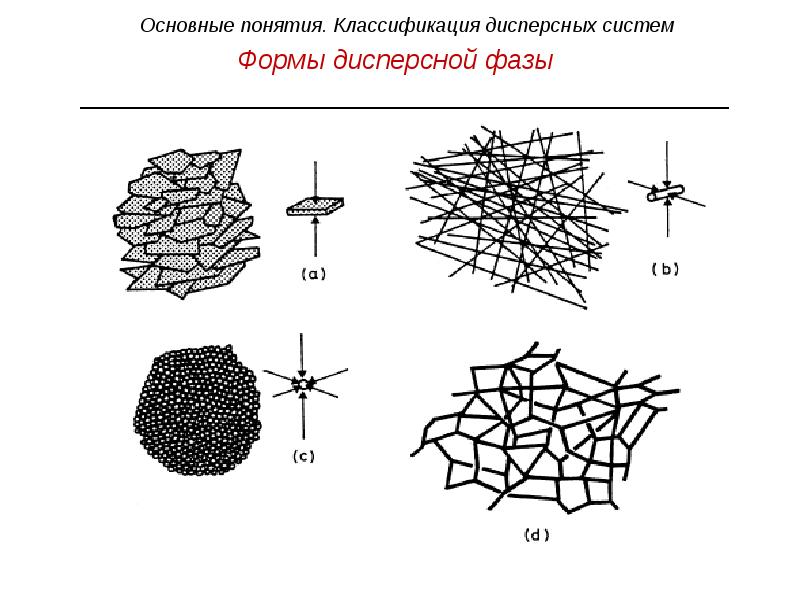
- 20. Формы дисперсной фазы n
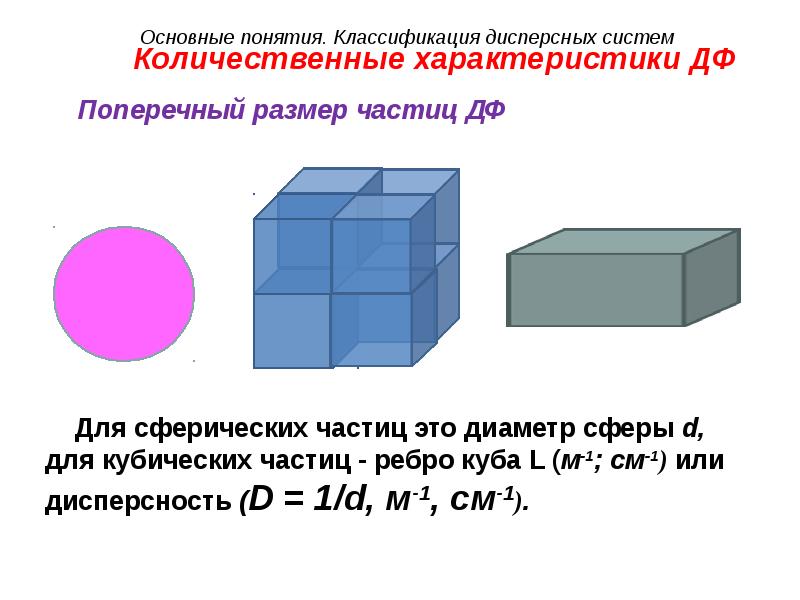
- 21. Количественные характеристики ДФ Удельная поверхность Удельная поверхность для сферической
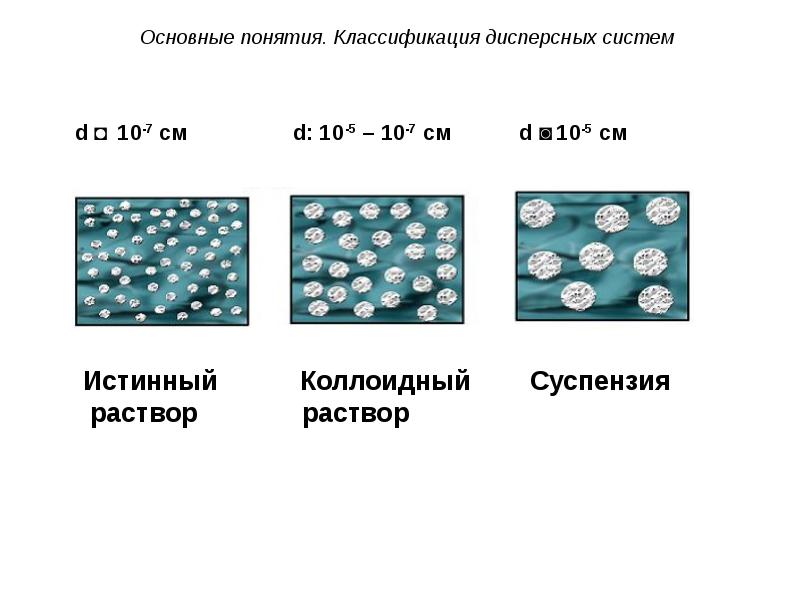
- 25. Грубодисперсные (d ˃ 10-5 см) – не проходят через тонкие бумажные
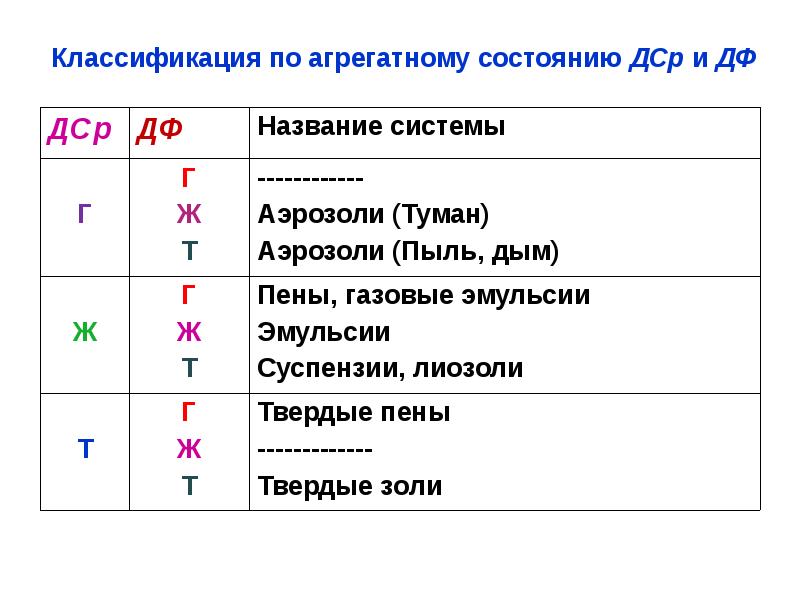
- 26. Классификация по агрегатному состоянию ДСр и ДФ
- 27. Суспензии
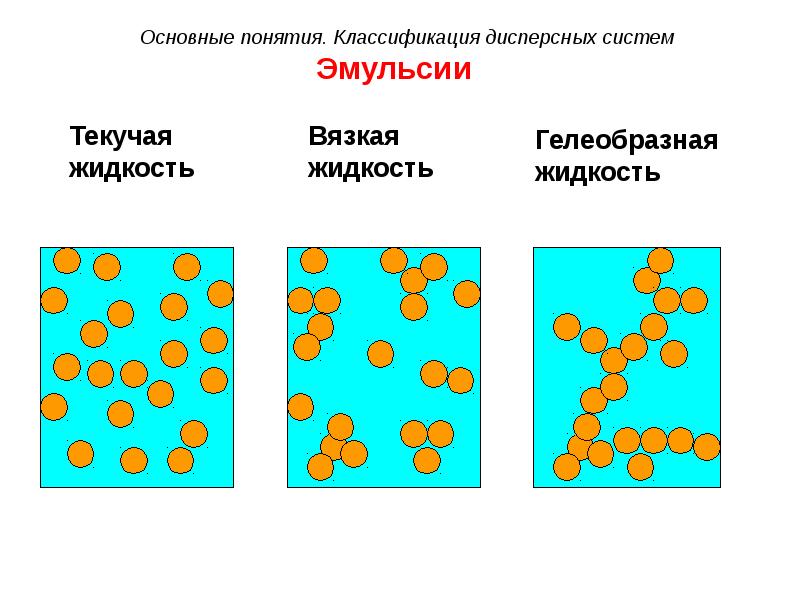
- 28. Эмульсии
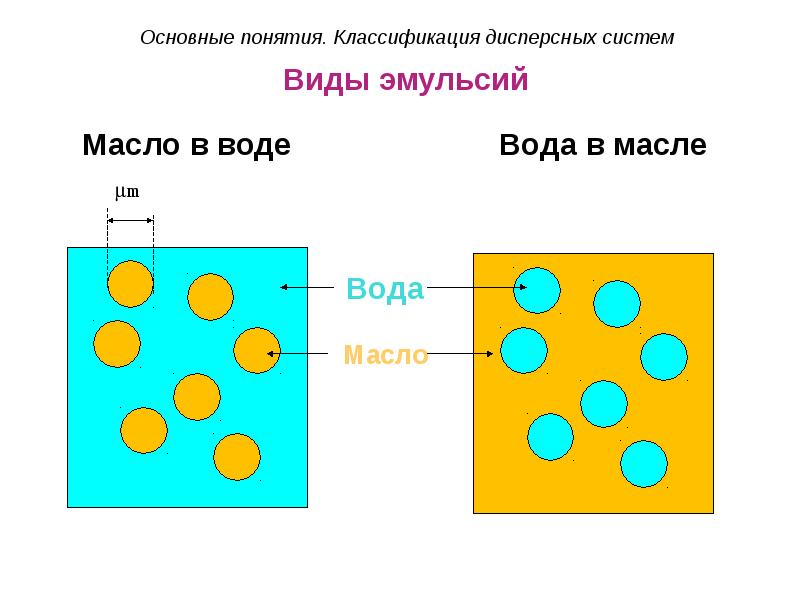
- 29. Виды эмульсий
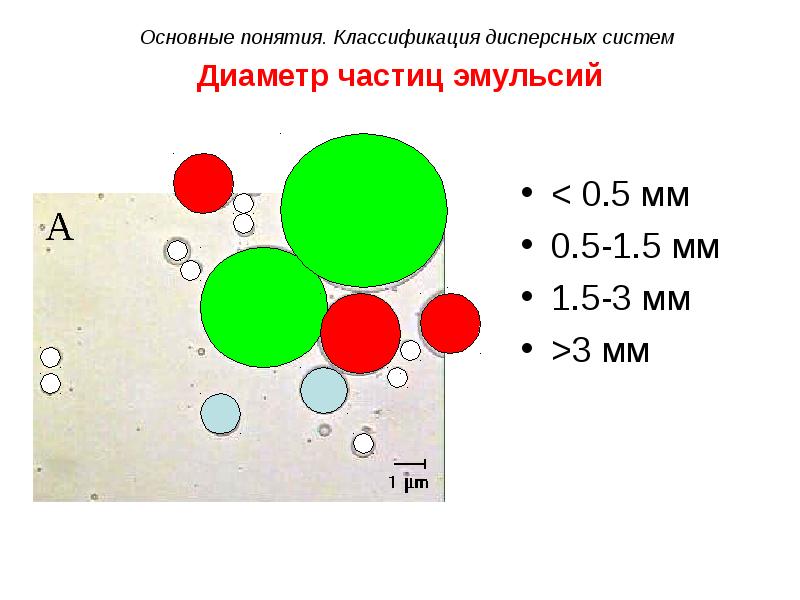
- 30. Диаметр частиц эмульсий < 0.5 мм 0.5-1.5 мм 1.5-3 мм >3
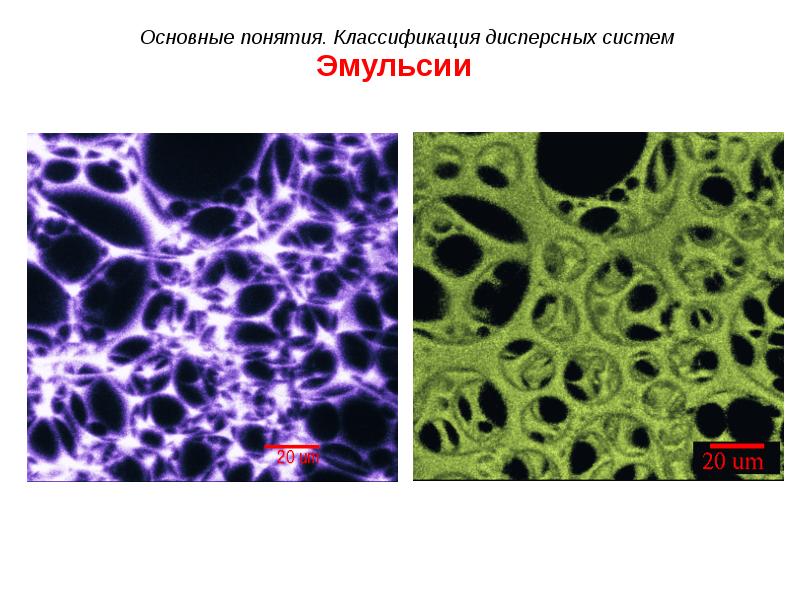
- 31. Эмульсии
- 32. Эмульсии
- 33. Эмульсии
- 34. Пена
- 35. Аэрозоль
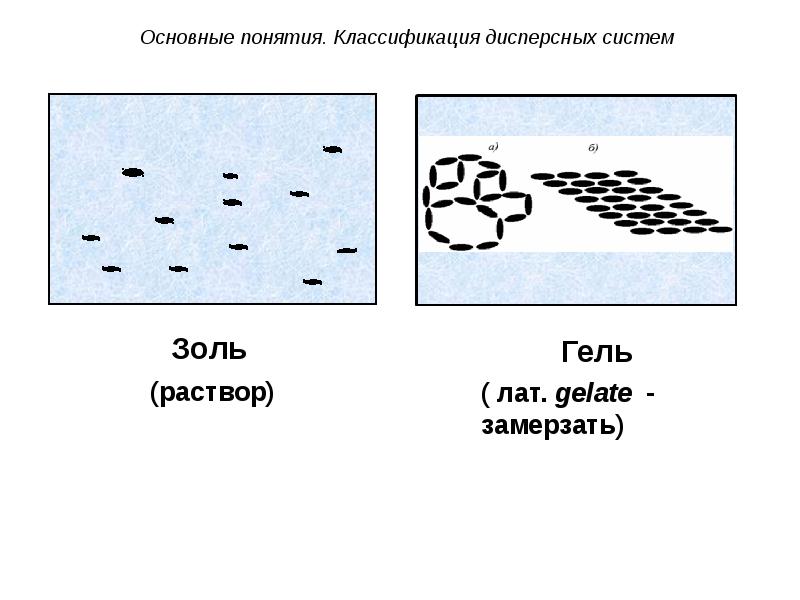
- 37. Золи и гели
- 38. Золь – бесструктурный коллоидный раствор, в котором частицы ДФ слабо взаимодействуют
- 39. Гель – структурированный коллоидный раствор, в котором частицы ДФ связаны между
- 41. Методы получения коллоидных растворов
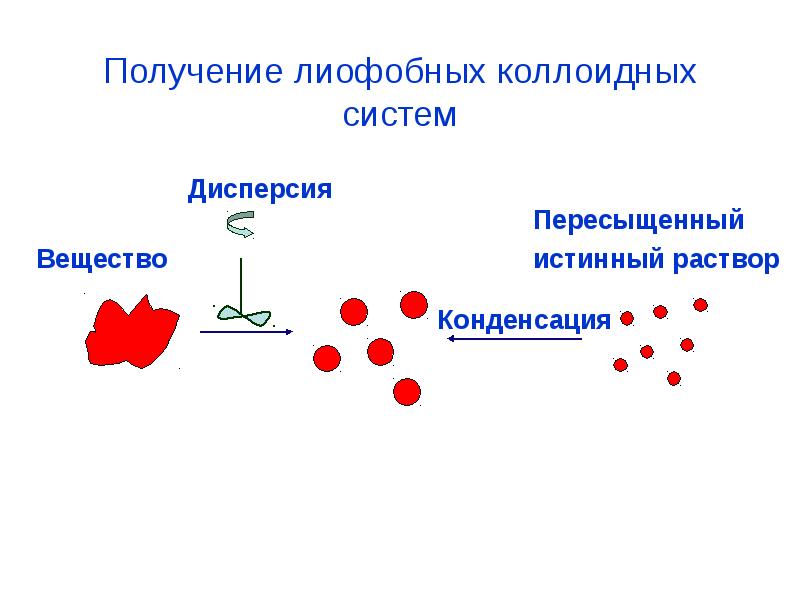
- 42. Получение лиофобных коллоидных систем
- 43. Методы получения коллоидных растворов Методы диспергирования (от лат. – измельчать)
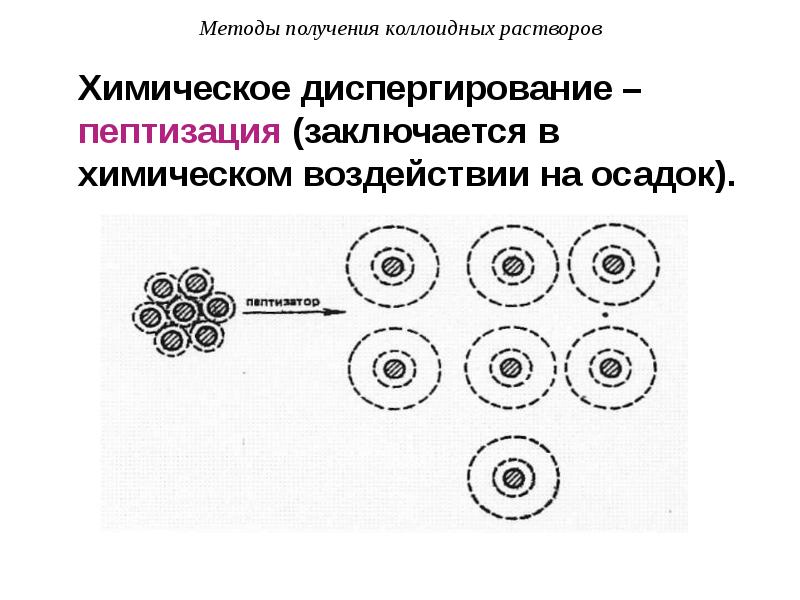
- 45. Методы получения коллоидных растворов Химическое диспергирование – пептизация (заключается
- 46. Методы получения коллоидных растворов Конденсационные методы (от лат. – укрупнять)
- 47. Методы получения коллоидных растворов Физическая конденсация – это метод замены
- 48. Методы получения коллоидных растворов Химическая конденсация – для получения коллоидных
- 49. Химическая конденсация Чтобы в ходе реакции образовался коллоидный раствор,
- 50. Примеры реакций химической конденсации
- 51. Методы очистки коллоидных растворов
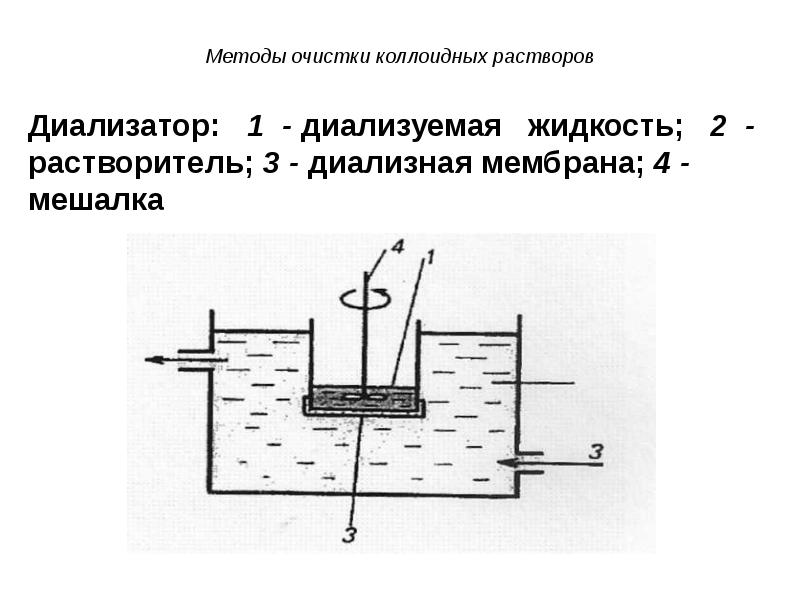
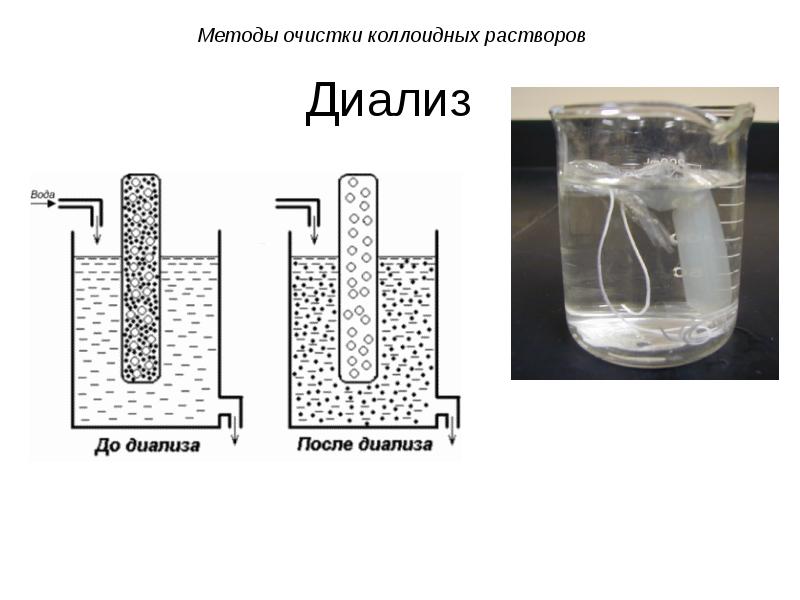
- 52. Диализ Диализ проводят с помощью прибора - диализатора. Он состоит
- 53. Методы очистки коллоидных растворов
- 54. Диализ
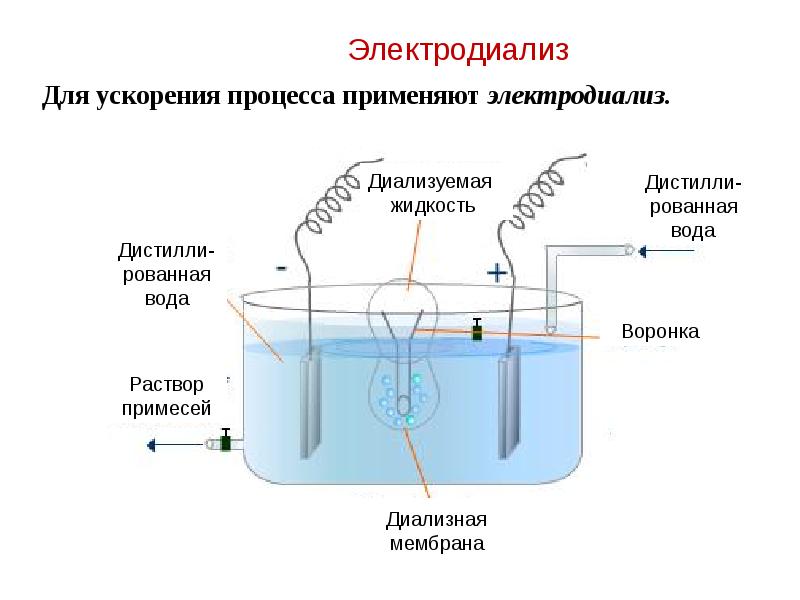
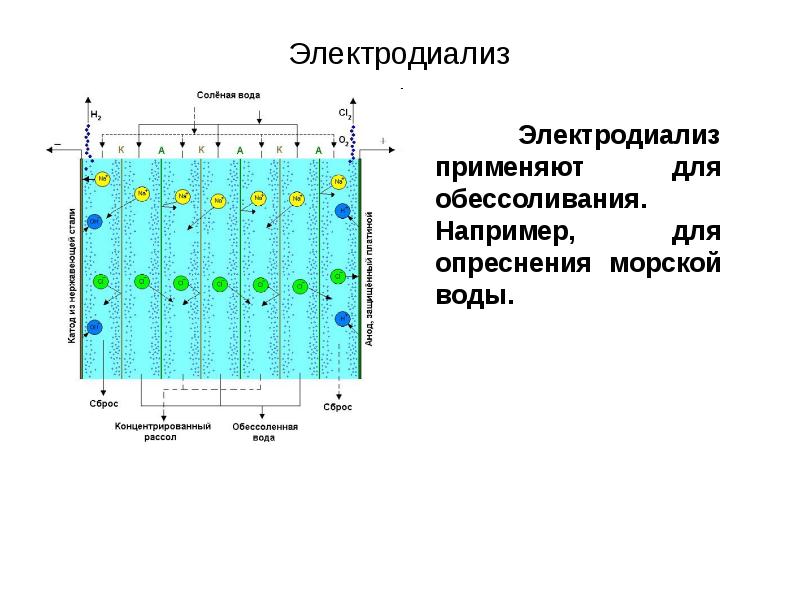
- 56. Электродиализ
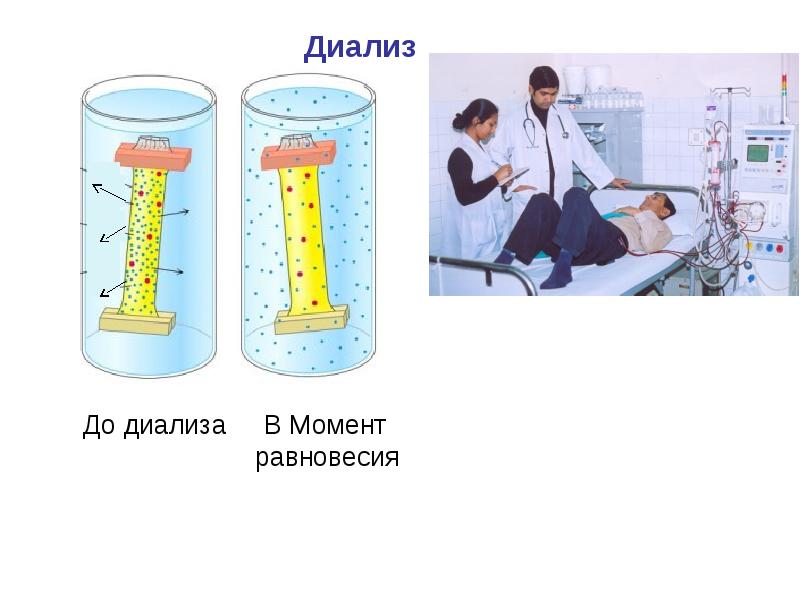
- 57. Диализ По принципу компенсационного диализа работает аппарат «искусственная почка».
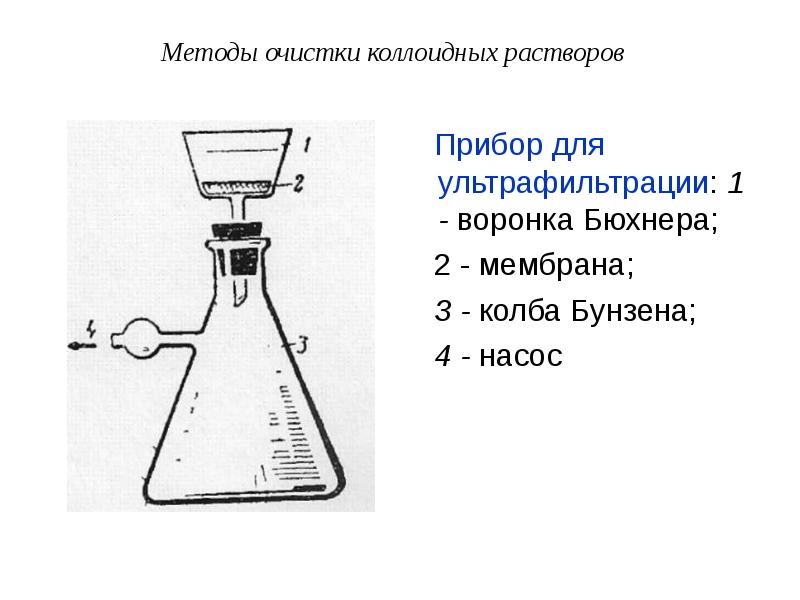
- 59. Методы очистки коллоидных растворов Для очистки коллоидных растворов от грубодисперсных
- 60. Методы очистки коллоидных растворов Прибор для ультрафильтрации: 1 - воронка
- 61. Методы очистки коллоидных растворов Для разделения частиц ДФ, имеющих различную
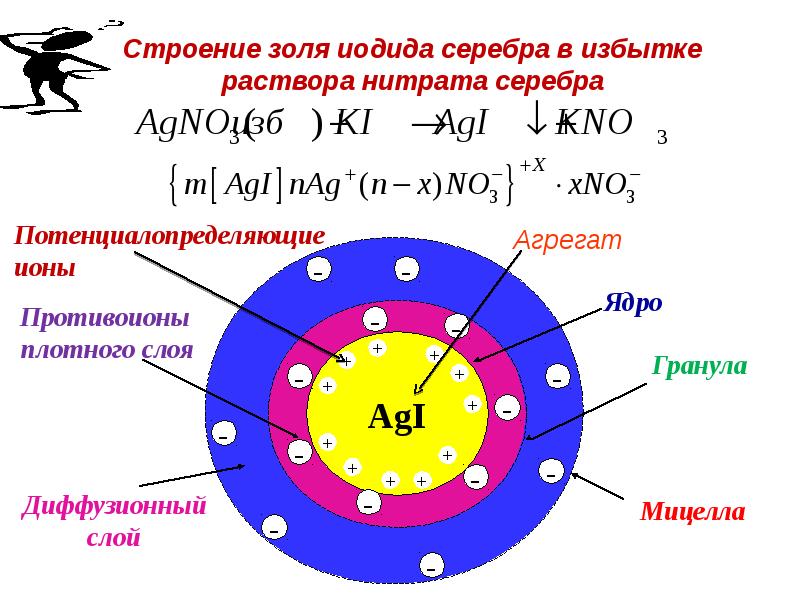
- 63. Строение мицеллы Заряд на коллоидных частицах возникает либо за счет
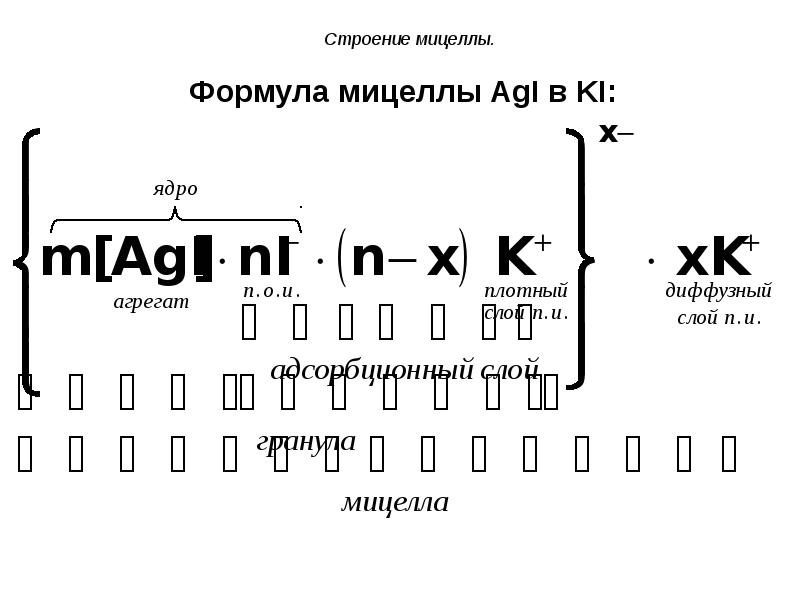
- 64. Строение мицеллы Рассмотрим второй случай – образование мицеллы AgI в
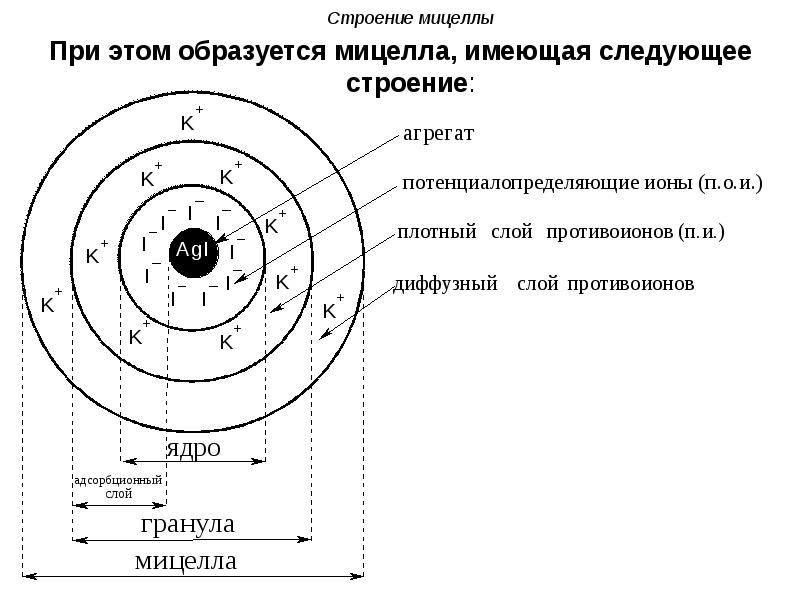
- 65. Строение мицеллы При этом образуется мицелла, имеющая следующее строение:
- 66. Строение мицеллы Осадок AgI является агрегатом мицеллы. На твердой
- 67. Строение мицеллы Агрегат и потенциалопределяющие ионы составляют ядро мицеллы.
- 68. Строение мицеллы Адсорбционный слой вместе с агрегатом составляют гранулу (или
- 69. Строение мицеллы. Формула мицеллы AgI в KI:
- 70. Строение мицеллы Ионы стабилизатора, адсорбируясь на поверхности агрегата, образуют ионогенную
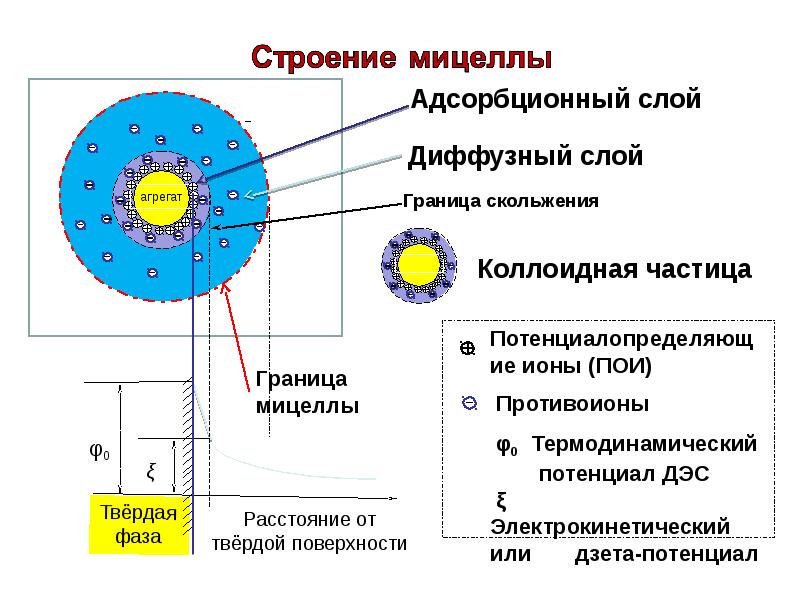
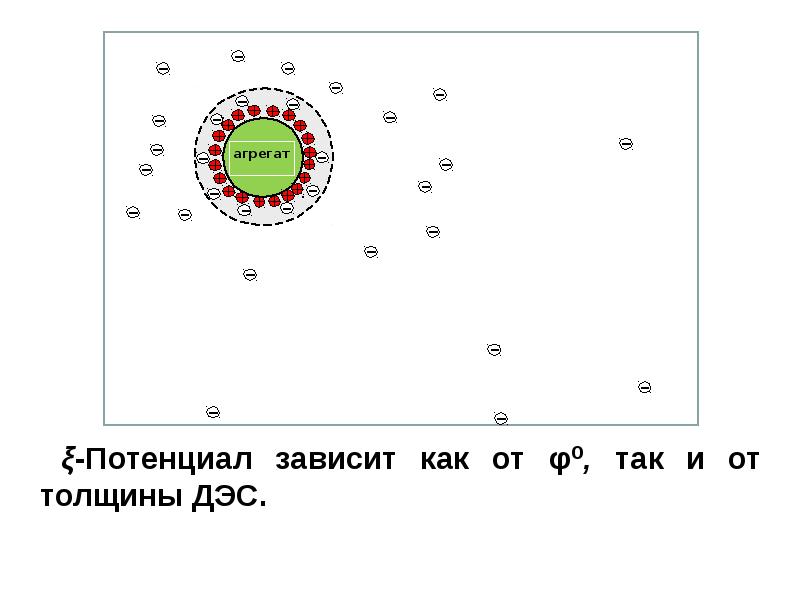
- 71. Электрокинетический потенциал В мицелле выделяют две границы: Граница
- 72. Электрокинетический потенциал Граница скольжения - проходит между гранулой и диффузным
- 74. Электрокинетический потенциал Название кинетический связано с тем, что его рассчитывают
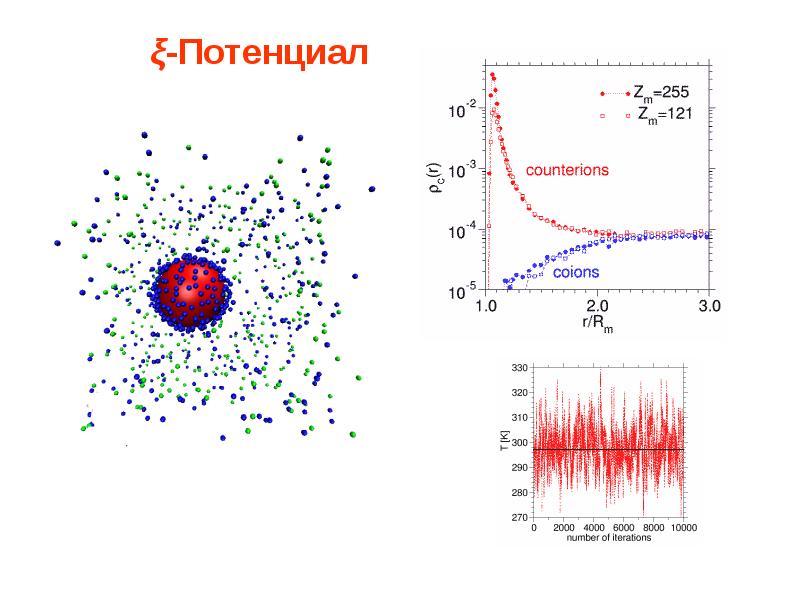
- 76. ξ-Потенциал
- 77. Электрокинетический потенциал. Чем больше заряд гранулы и, соответственно, величина дзета-потенциала,
- 78. Изоэлектрическое состояние мицеллы Изоэлектрическое состояние мицеллы С увеличением концентрации электролита
- 79. Изоэлектрическое состояние мицеллы В этом случае говорят об изоэлектрическом состоянии
- 80. Изоэлектрическое состояние мицеллы
- 81. Вопросы для самоконтроля
- 82. Строение золя иодида серебра в избытке раствора нитрата серебра
- 83. СПАСИБО ЗА ВАШЕ ВНИМАНИЕ! СПАСИБО ЗА ВАШЕ ВНИМАНИЕ!
- 84. Скачать презентацию



















































Слайды и текст этой презентации
Скачать презентацию на тему Коллоидные растворы. Методы получения и очистки коллоидных растворов. Строение мицеллы гидрофобных систем. (Часть 1) можно ниже:
Похожие презентации