Комплексообразователь. (Лекция 5) презентация
Содержание
- 2. Координационное число 4 1. Если комплексообразователь 3d – элемент и
- 3. комплекс [Au(NH3)4]3+ Комплексообразователь Au3+: 5d86s0 ; лиганд NH3 ; к.ч. 4
- 4. комплекс [NiCl4]2- комплексообразователь Ni2+: 3d84s2 ; лиганд Cl– ; к.ч. 4
- 5. Спектр видимого излучения и дополнительные цвета
- 6. Окраска комплексных соединений При поглощении кванта света (h) электрон переходит с
- 7. Гексаакватитан (III) [Ti(H2O)6]3+ Комплекс поглощает свет в желто-зеленой области спектра
- 8. комплекс [Сu(NH3)4]2+ Комплексообразователь Сu2+: 3d94s0 ; лиганд NH3 ; к.ч. 4
- 9. Ионная химическая связь А - nē→ Аn+ (катионы) А +
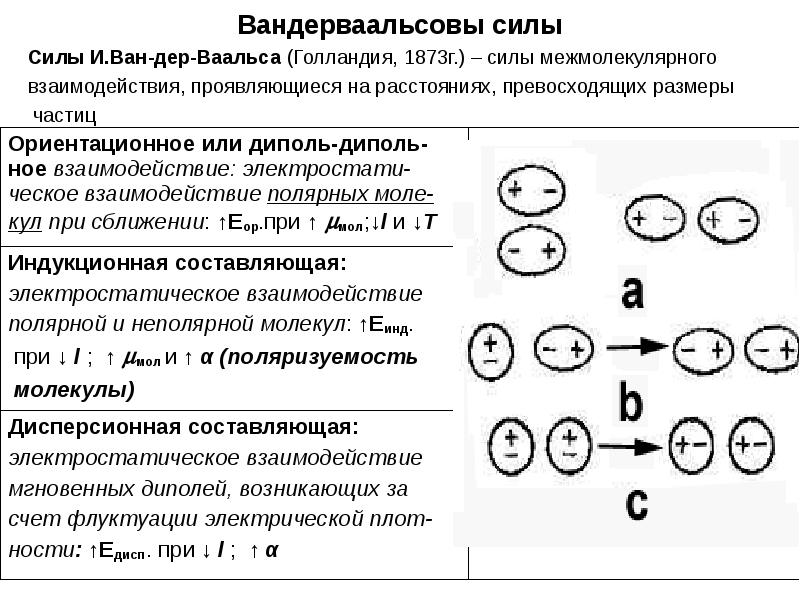
- 10. Вандерваальсовы силы Силы И.Ван-дер-Ваальса (Голландия, 1873г.) – силы межмолекулярного взаимодействия, проявляющиеся
- 11. Вклад отдельных составляющих в энергию межмолекулярного взаимодействия
- 12. ВОДОРОДНАЯ СВЯЗЬ Химическая связь, образованная положительно поляризованным водородом молекулы А-Н (или
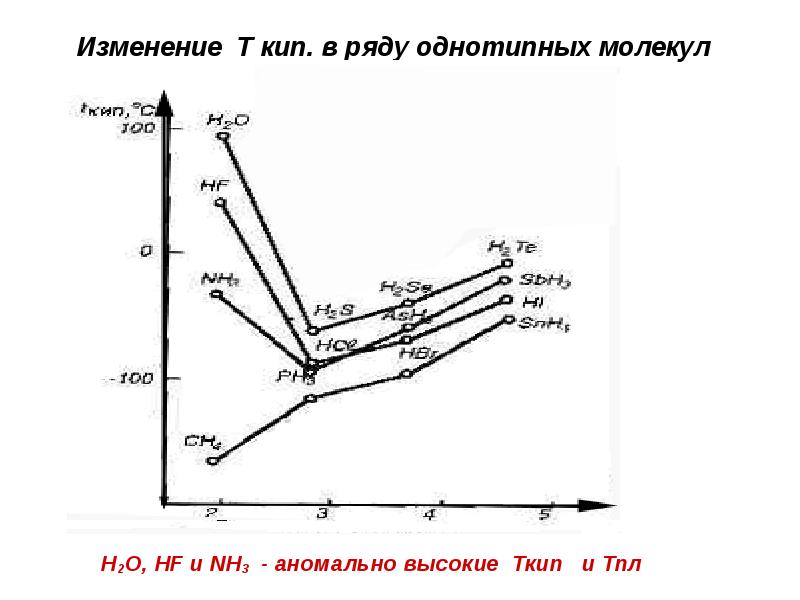
- 13. ► Е(н-связи) возрастает с ↑ ЭО и ↓ размеров атомов В
- 14. Изменение Т кип. в ряду однотипных молекул
- 15. Металлическая связь У большинства металлов на внешнем энергетическом уровне небольшое число
- 16. Скачать презентацию
![Комплекс [PtВr6]2-
Комплексообразователь Pt4+: 5d66s0 ; лиганд Br– ; к.ч. 6
Комплекс [PtВr6]2-
Комплексообразователь Pt4+: 5d66s0 ; лиганд Br– ; к.ч. 6](/documents_3/a73e9cb692a24163e99c28d3fb22b954/img0.jpg)

![комплекс [Au(NH3)4]3+
Комплексообразователь Au3+: 5d86s0 ; лиганд NH3 ; к.ч. 4
комплекс [Au(NH3)4]3+
Комплексообразователь Au3+: 5d86s0 ; лиганд NH3 ; к.ч. 4](/documents_3/a73e9cb692a24163e99c28d3fb22b954/img2.jpg)
![комплекс [NiCl4]2-
комплексообразователь Ni2+: 3d84s2 ; лиганд Cl– ; к.ч. комплекс [NiCl4]2-
комплексообразователь Ni2+: 3d84s2 ; лиганд Cl– ; к.ч.](/documents_3/a73e9cb692a24163e99c28d3fb22b954/img3.jpg)


![Гексаакватитан (III) [Ti(H2O)6]3+
Комплекс поглощает свет в желто-зеленой области спектра
Гексаакватитан (III) [Ti(H2O)6]3+
Комплекс поглощает свет в желто-зеленой области спектра](/documents_3/a73e9cb692a24163e99c28d3fb22b954/img6.jpg)
![комплекс [Сu(NH3)4]2+
Комплексообразователь Сu2+: 3d94s0 ; лиганд NH3 ; к.ч. 4
комплекс [Сu(NH3)4]2+
Комплексообразователь Сu2+: 3d94s0 ; лиганд NH3 ; к.ч. 4](/documents_3/a73e9cb692a24163e99c28d3fb22b954/img7.jpg)





Слайды и текст этой презентации
Скачать презентацию на тему Комплексообразователь. (Лекция 5) можно ниже:
Похожие презентации





























