Коррозия в жидких средах презентация
Содержание
- 2. К о р р о з и я в н
- 3. - химическая реакция с металлом, - химическая реакция с
- 4. К о р р о з и я в ж и
- 5. определяются предельной Р, V жидкого М и скоростью его циркуляции. Возможна
- 6. Опасен и часто встречается термический перенос массы - в горячей зоне
- 7. перенос М от более к менее напряженным участкам конструкции; самосваривание находящихся
- 8. Электролитная коррозия Основа - теория коррозионного полиэлектрода, а также термодинамика,
- 9. Устанавливаются равновесия (1) – (6): Устанавливаются равновесия (1) –
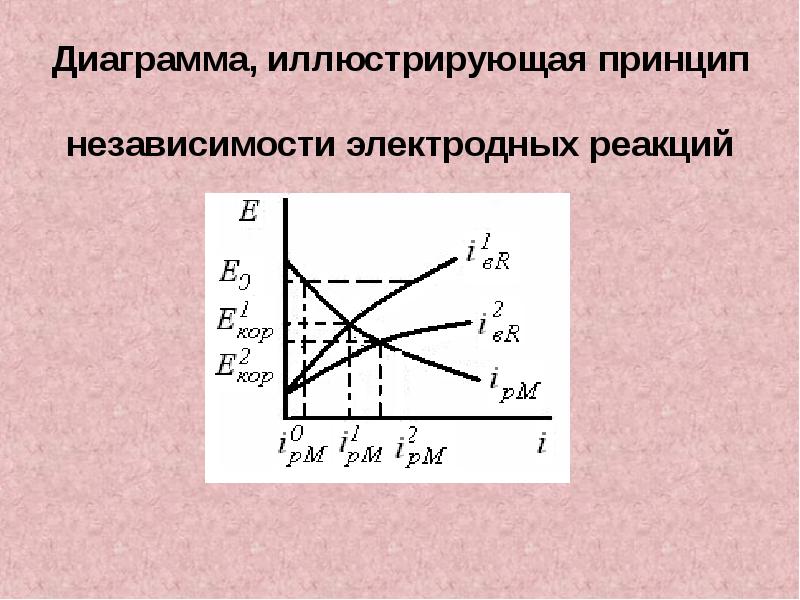
- 10. УСЛОВИЯ ПРОТЕКАНИЯ ПАРАЛЛЕЛЬНЫХ РЕАКЦИЙ Принцип независимости: на
- 11. Диаграмма, иллюстрирующая принцип
- 12. Следствия из принципа По первому следствию при заданном Е (Е=Е0) (рис.)
- 13. Выражение скорости и потенциала коррозии Если Екор удален от рЕ
- 14. Подставив Екор в выражения для скорости получим: Подставив Екор
- 15. Если катодная реакция лимитируется диффузией Ох или при Екор протекает с
- 16. Условие протекания коррозии: Условие протекания коррозии:
- 17. Теория локальных гальванических элементов При коррозии в короткозамкнутом
- 18. Теорию подтверждали: Теорию подтверждали: - обнаруженные катодные и
- 19. Предложены графический и аналитический расчеты скорости коррозии. Предложены
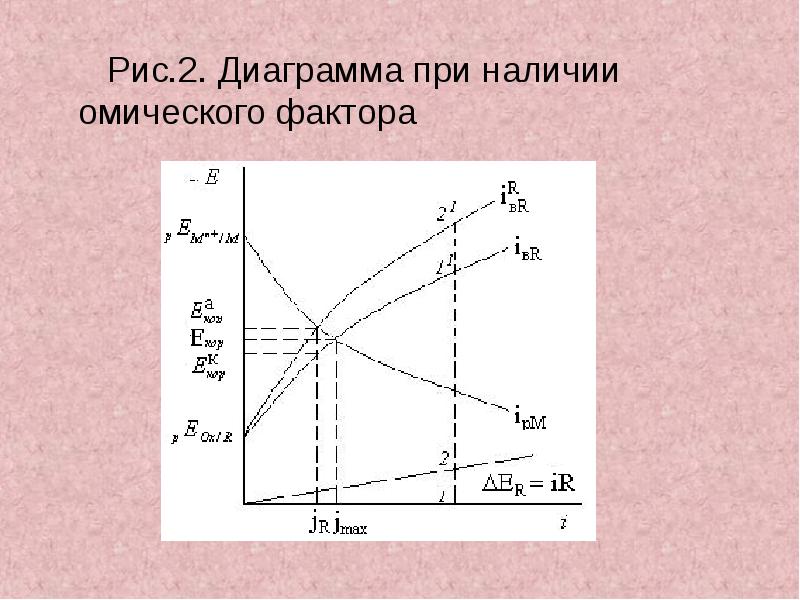
- 20. Рис.2. Диаграмма при наличии омического фактора Рис.2. Диаграмма при наличии
- 21. Точка пересечения исправленной катодной кривой Е – c анодной Е
- 22. 2. Аналитический расчет Уравнения, вытекающие из (10) и
- 23. jR= (рЕОх/R - рЕМn+/М)/( к + а + R) (12)
- 24. Недостатки ТЛГЭ Не объясняла коррозию чистых
- 25. Модификационная теория Использует верную модель ЛГЭ ,но отличается от положениями:
- 26. 2. Разность Е между катодными и анодными участками - следствие омического
- 27. Рис.3. Диаграмма для трех металлов при наличии омического фактора .
- 28. Механизмы коррозии Го м о г е н н о- э
- 29. Условие стационарности Екор имеет вид: Условие стационарности Екор имеет вид:
- 30. 2. Г е т е р о г е н н
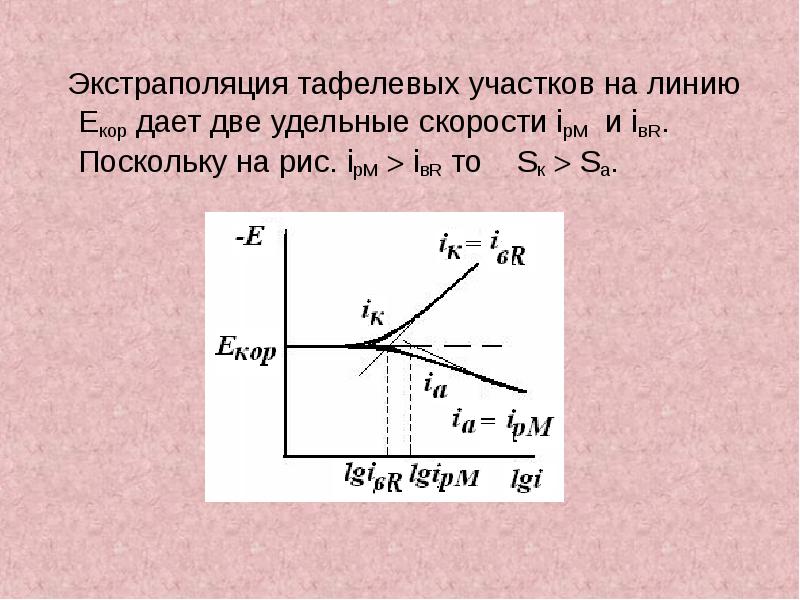
- 31. Экстраполяция тафелевых участков на линию Екор дает две удельные скорости ipM
- 32. Гетерогенность Различают макро- и микро-электрохимическую гетерогенность,
- 33. Скачать презентацию





























Слайды и текст этой презентации
Похожие презентации





























