Кристаллофизика, кристаллохимия презентация
Содержание
- 3. План лекции: Основы кристаллофизики механические свойства кристаллов оптические свойства кристаллов
- 4. Кристаллофизика изучает зависимость между физическими свойствами кристаллов и их внутренним строением.
- 5. Физические свойства кристаллов представлены механическими, оптическими, электрическими и пр. свойствами кристаллов.
- 6. Механические свойства кристаллов К механическим свойствам кристаллов относятся свойства, связанные с
- 7. Спайностью называется свойство кристаллов раскалываться или расщепляться по определенным кристаллографическим направлениям
- 8. В зависимости от степени В зависимости от степени совершенства выделяют несколько
- 9. Весьма совершенная Весьма совершенная спайность – кристалл способен расщепляться на тонкие
- 10. Совершенная Совершенная спайность при ударе молотком выколки по спайности, внешне очень
- 11. Средняя Средняя спайность – на обломках кристаллического вещества различаются следы спайности
- 12. Несовершенная Несовершенная спайность обнаруживается с трудом, ее нужно искать на обломке
- 13. Весьма Весьма несовершенная спайность практически отсутствует. Такие тела имеют раковистый
- 14. Спайность может быть Спайность может быть в нескольких направлениях, под постоянными
- 15. Излом – способность минералов Излом – способность минералов раскалываться не по
- 16. Типы изломов раковистый занозистый крючковатый ровный ступенчатый неровный
- 17. Раковистый Раковистый излом похож на внутреннюю поверхность раковины, характерен для кристаллов,
- 18. Занозистый Занозистый излом напоминает поперечный излом древесины и свойственен волокнистым минеральным
- 19. Крючковатый Крючковатый излом поверхность излома как бы покрыта мелкими крючочками (самородная
- 20. Землистый Землистый излом поверхность излома матовая и как бы покрыта мелкой
- 21. Ровный излом Ровный излом типичен для кристаллов с совершенной спайностью. Свойственен
- 22. Ступенчатый Ступенчатый излом для кристаллов со спайностью в нескольких
- 23. Удельный вес (плотность) – соответствует Удельный вес (плотность) – соответствует массе
- 24. Магнитность – Магнитность – способность некоторых минералов действовать на
- 25. Твердостью Твердостью кристаллов называется степень сопротивления вещества какому-либо внешнему механическому воздействию
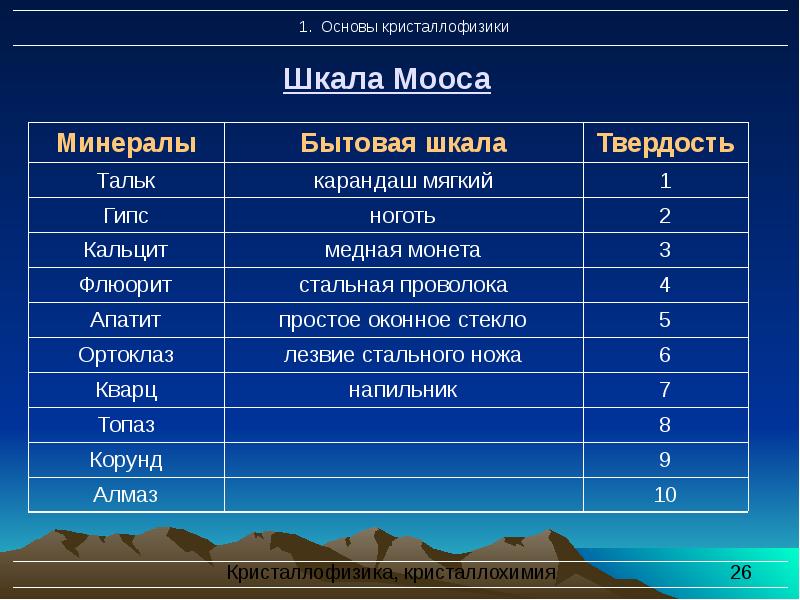
- 26. Шкала Мооса
- 27. Оптические свойства кристаллов Прозрачность Цвет Блеск Двупреломление
- 28. Прозрачность – способность минерала Прозрачность – способность минерала пропускать свет. В
- 29. Типы окраски минералов: идиохроматическая (от греческого идиос – собственный) – минерал
- 30. Идиохроматическая окраска минералов
- 31. Аллохроматическая окраска минералов
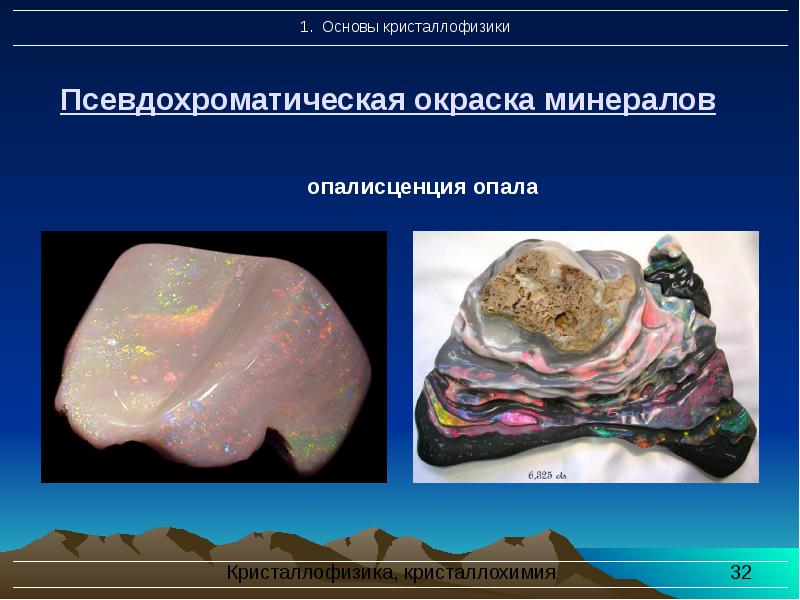
- 32. Псевдохроматическая окраска минералов
- 33. Разновидности псевдохроматической окраски
- 34. Блеск – способность минералов с различной интенсивностью отражать падающий на них
- 36. Металлический – Металлический – напоминает блеск полированного металла (серебро, золото, сульфиды).
- 37. Полуметаллический Полуметаллический блеск – более тусклый чем металлический, как у потускневших
- 38. Алмазный – сильный Алмазный – сильный блеск, обусловленный неоднократным отражением света
- 39. Стеклянный – Стеклянный – поверхность минерала блестит как стекло. Стеклянным блеском
- 40. Перламутровый – Перламутровый – минерал блестит и переливается как поверхность перламутра
- 41. Шелковистый – Шелковистый – обусловлен волокнистым строением минерала, поэтому минерал блестит
- 42. Жирный – поверхность Жирный – поверхность минерала кажется смазанной жиром или
- 43. Смоляной – блеск, Смоляной – блеск, напоминающий блеск застывшей смолы или
- 44. Восковой – Восковой – полуматовый блеск, напоминающий блеск пчелиного воска, характерный
- 45. Двупреломление – разложение в анизотропных средах светового луча, входящего в кристалл
- 46. Раздвоение надписи, рассматриваемой через кристалл исландского шпата
- 47. Кристаллохимия изучает связь между атомным строением (структурой) кристаллов и их химическими,
- 48. Атомные и ионные радиусы
- 49. Атомные и ионные радиусы Атомные и ионные радиусы – это минимальное
- 50. Величина радиуса зависит от ряда Величина радиуса зависит от ряда причин:
- 51. Во время роста кристаллов Во время роста кристаллов ионы, слагающие минерал,
- 52. В минерале галите В минерале галите (NaCl) атомы хлора и натрия
- 53. Когда размеры ионов Когда размеры ионов сильно отличаются по размеру, они
- 54. Типы химических связей между атомами Ковалентная связь – осуществляется
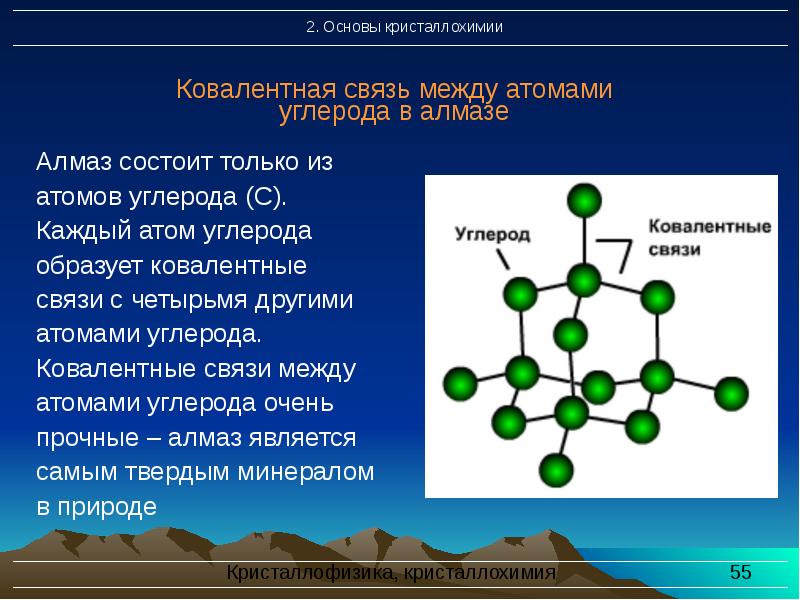
- 55. Ковалентная связь между атомами углерода в алмазе Алмаз состоит только из
- 56. Ионная связь – характеризуется тем, что силы связи обусловлены электростатическим притяжением
- 57. Ионные связи достаточно Ионные связи достаточно прочные, но не такие прочные
- 58. Химические связи в кремнекислородном тетраэдре SiO4 Промежуточная связь – большинство химических
- 59. Другие типы химических связей Металлическая связь характерна для атомов металлов, которые
- 60. Ван-дер Ваальсовые связи Ван-дер Ваальсовые связи – это слабые химические связи,
- 61. Водородные связи это слабые связи, возникающие в некоторых Водородные связи это
- 62. 3. Понятия изоморфизма и полиморфизма Понятия изоморфизма и полиморфизма впервые было
- 63. Изоморфизм (от греч. «изос» — равный, Изоморфизм (от греч. «изос» —
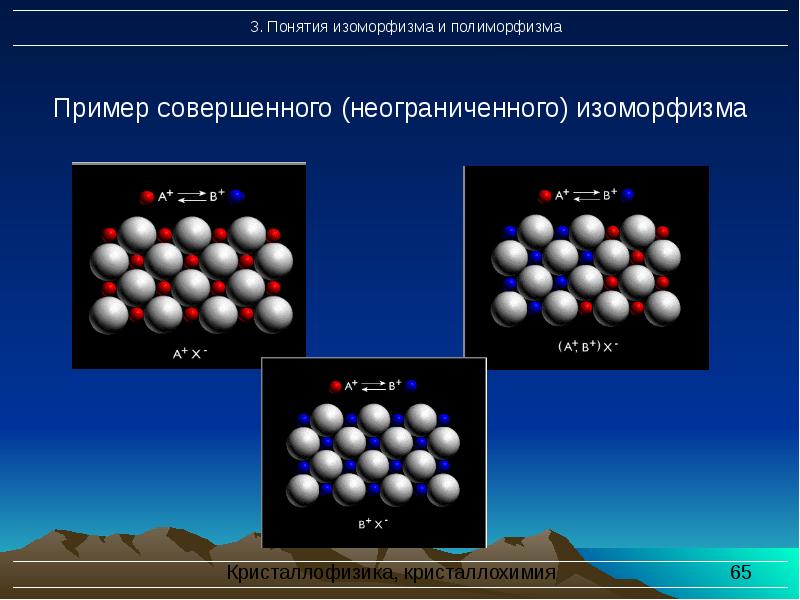
- 64. Виды изоморфизма: 1. Совершенный (неограниченный) изоморфизм – это явление полного без
- 65. Пример совершенного (неограниченного) изоморфизма
- 66. 2. Ограниченный (неполный) изоморфизм – когда крайние члены изоморфного ряда не
- 67. Причины проявления изоморфизма Внутренние причины, обусловленные строением атомов 1.
- 68. Внешние причины: Внешние причины: 1. Термодинамическая обстановка (температура,
- 69. Значение изоморфизма для изучения природных процессов 1. Осуществляет миграцию элементов в
- 70. Полиморфизм (от греч. «поли» — много, «морфэ» — форма) - свойство
- 71. Полиморфные превращения – переходы из одной кристаллической формы в другую. Устойчивые
- 73. Спасибо за внимание!
- 74. Скачать презентацию




































































Слайды и текст этой презентации
Похожие презентации





























