Культивирование растительных и животных клеток презентация
Содержание
- 2. Розділ 1 Предмет, завдання та перспективи розвитку культивування тваринних і рослинних
- 3. Тема 1. Предмет, завдання, історія розвитку напрямку культивування клітин Тема 1.
- 4. Культура клеток - это клетки многоклеточного организма, живущие и размножающиеся
- 5. Из истории Техника культуры ткани была впервые задумана и разработана в
- 6. Основные направления использования клеточных культур Генетика Клонирование. Хранение и
- 7. Основные направления использования клеточных культур Эмбриология, развитие и дифференцировка клеток
- 8. Тема 2. Сучасний стан та перспективи розвитку культивування тваринних і рослинних
- 9. Клеточные культуры с каждым годом находят все большее применение в самых
- 10. Важная роль отводится клеточным культурам в биотехнологии при производстве вакцин и
- 11. Преимущества использования клеточных культур Прижизненное наблюдение за клетками, их морфологическими
- 12. Преимущества использования клеточных культур Использование клеточной культуры снимает множество этических
- 13. Розділ 2 Обладнання та поживні середовища для роботи з клітинними
- 14. Тема 1. Обладнання, яке використовується для роботи з клітинними культурами Прилади
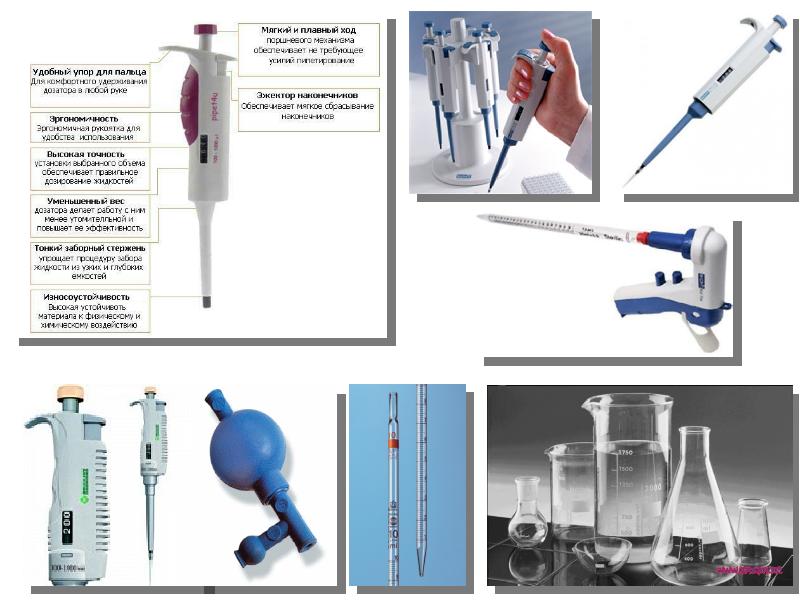
- 21. Культуральная посуда Очень важным вопросом является выбор соответствующей лабораторной посуды для
- 22. Культуральная посуда Основная часть ассортимента специальной культуральной посуды предназначена для
- 23. Культуральная посуда Посуда из стекла Хотя в последние годы широко применяется
- 24. Культуральная посуда Пластиковая посуда Начиная с 1965 года, все большее применение
- 25. Культуральная посуда Планшет культуральный
- 26. Культуральные флаконы (матрасы для клеточных культур) с отслаивающейся боковой поверхностью Культуральные
- 27. Помещения для работы с культурами клеток Все манипуляции при работе
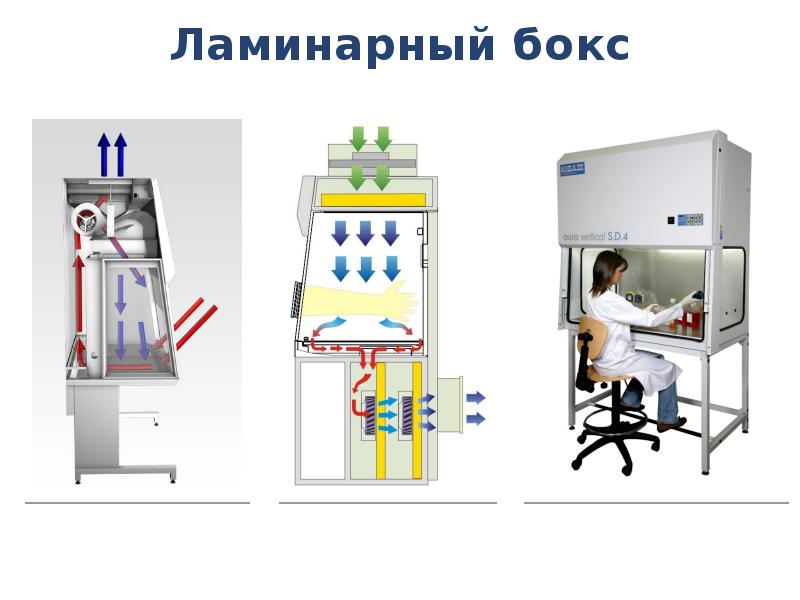
- 28. Ламинарный бокс
- 29. Ламинарный бокс
- 30. Лабораторные термостаты
- 31. Лабораторные термостаты Лабораторные термостаты для культивирования клеток должны отвечать ряду специальных
- 33. Необходимость поддержания постоянной величины рН в питательной среде и ее минимального
- 35. Большое значение в оснащении лаборатории, предназначенной для культивирования клеток, имеют приборы,
- 36. Аэраторы Для обеспечения аэрации культуральной среды – снабжения кислородом - используют
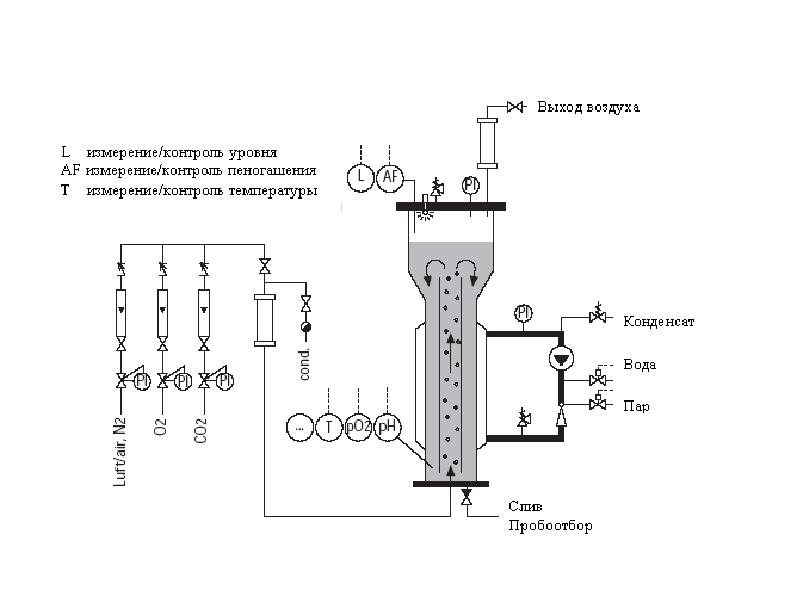
- 37. Лабораторные ферментеры Это комплексы приборов и аппаратов для массового суспензионного или
- 38. Лабораторные ферментеры Большинство перемешиваемых и аэрируемых культур во время роста образуют
- 39. Автоклавируемые лабораторные ферментеры рабочим объемом от 0,5 до 10 литров
- 40. Установка для культивирования микроорганизмов
- 41. Методы массового культивирования микроскопических водорослей
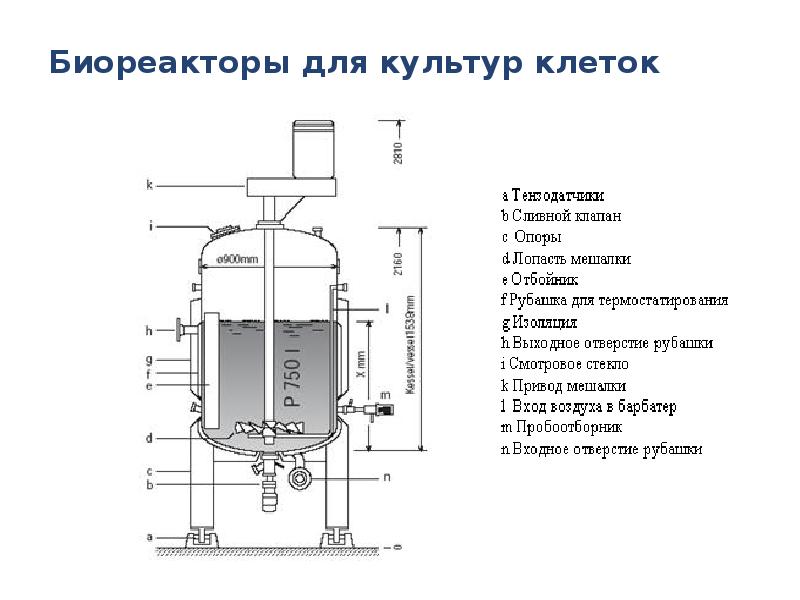
- 42. Биореакторы для культур клеток Клетки животных во многом отличаются от микробных
- 43. Для предотвращения повреждения клеток пузырьками воздуха уменьшают объем подаваемой газовой смеси,
- 44. Клеточный ферментер (компания Bioengineering) Клеточный ферментер представляет собой резервуар с
- 45. Биореакторы для культур клеток
- 46. Эрлифтный ферментер В этих ферментерах перемешивание осуществляется потоком воздуха, а
- 48. Многие клетки млекопитающих растут только будучи прикрепленными к поверхности. Такие опорнозависимые
- 49. Биореакторы с взвешенной твердой фазой рекомендуются для клеток на микроносителях, для
- 50. Для опорнозависимых клеток можно также использовать биореактор с фиксированной твердой фазой
- 52. Мембранный ферментер Мембранный ферментер состоит из внутренней и внешней камер, которые
- 53. Тема 2. Поживні середовища для роботи з клітинними культурами Тема 2.
- 54. Принципы составления питательных сред Все живые клетки нуждаются в экзогенных
- 55. Питательные среды и условия культивирования После извлечения клеток из ткани или
- 57. Основу питательных сред составляют солевые растворы. Минеральные компоненты в этих растворах
- 58. Другим важным условием культивирования является осмотическое давление. Оно определяется числом молей
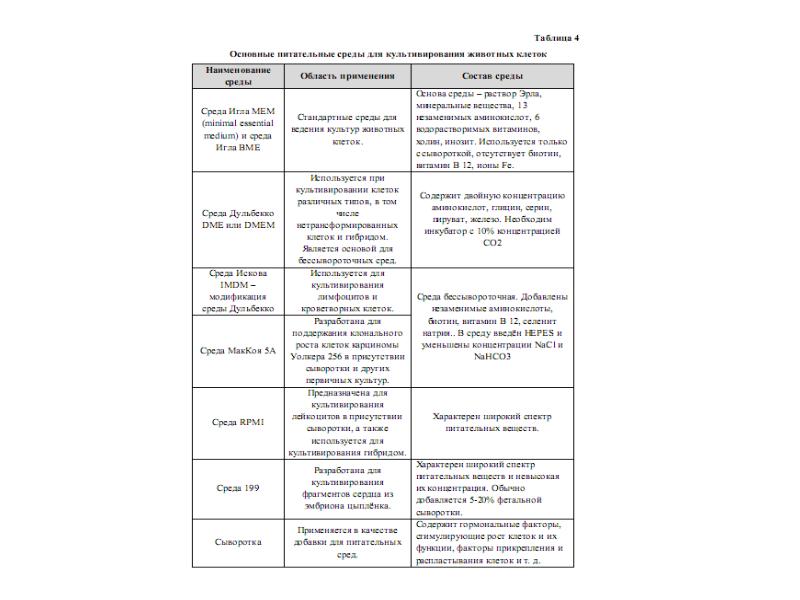
- 59. Стандартные среды для культур животных клеток Среды Игла MEM (minimal
- 60. Стандартные среды для культур животных клеток Среда МакКоя 5А и
- 61. Нормальные, сохраняющие специфические функции клетки на стандартных средах не размножаются (если
- 62. Белки сыворотки, прямо и специфически участвующие в стимуляции клеточного деления, называются
- 63. Гормоны стимулируют или подавляют рост в зависимости от типа клеток и
- 64. Недостатки культивирования клеток в присутствии сыворотки для большинства тканей сыворотка не
- 65. В настоящее время предпринимаются попытки создания и применения бессывороточных питательных сред,
- 66. Следовательно, оптимизация состава питательных сред для культур животных клеток развивается в
- 68. Розділ 3 Культивування рослинних клітин
- 69. Тема 1. Методи створення клітинних культур рослин Тема 1. Методи створення
- 70. Методы создания клеточных культур растений Культура клеток растений может быть получена
- 71. Основные виды культуры клеток растений: Каллусная, суспензионная, культура протопластов.
- 72. Каллусная культура картофеля
- 73. Цитоморфологические, физиолого-биохимические особенности каллусных культур Переход клетки in vitro из дифференцированного
- 74. Цитоморфологические, физиолого-биохимические особенности каллюсных культур Энергетический метаболизм каллусных клеток в значительной
- 75. Суспензионная культура клеток растений Для получения клеточной суспензии каллусную ткань помещают
- 76. Суспензионная культура клеток растений Примерно через две недели суспензию фракционируют на
- 77. Суспензионная культура клеток растений Как и каллусные культуры, суспензию клеток периодически
- 78. Суспензионная культура клеток растений Рост клеток в суспензионных культурах клеток оценивают
- 80. Тема 2. Протопласти рослинних клітин Тема 2. Протопласти рослинних клітин Способи
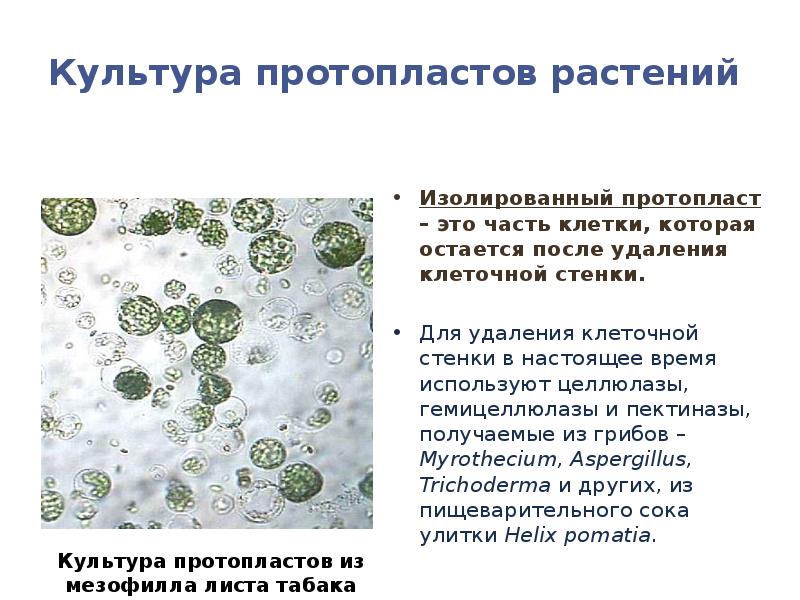
- 81. Культура протопластов растений Изолированный протопласт – это часть клетки, которая остается
- 82. Культура протопластов растений Протопласты выделяют из разных тканей растений, а также
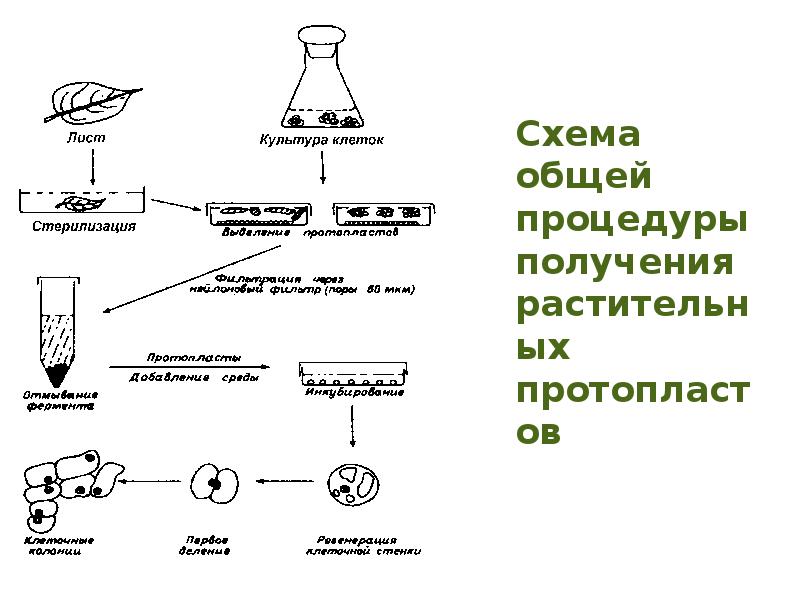
- 83. Протопласты растительных клеток как объекты биологического конструирования Способы выделения растительных протопластов
- 84. Впервые выделение растительных протопластов было осуществлено в 1892 г. Дж. Клеркером
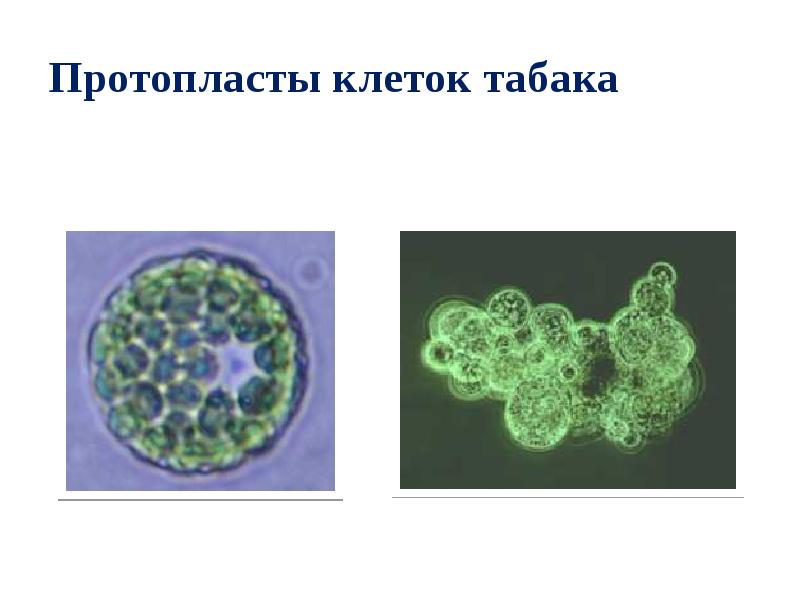
- 86. Протопласты клеток табака
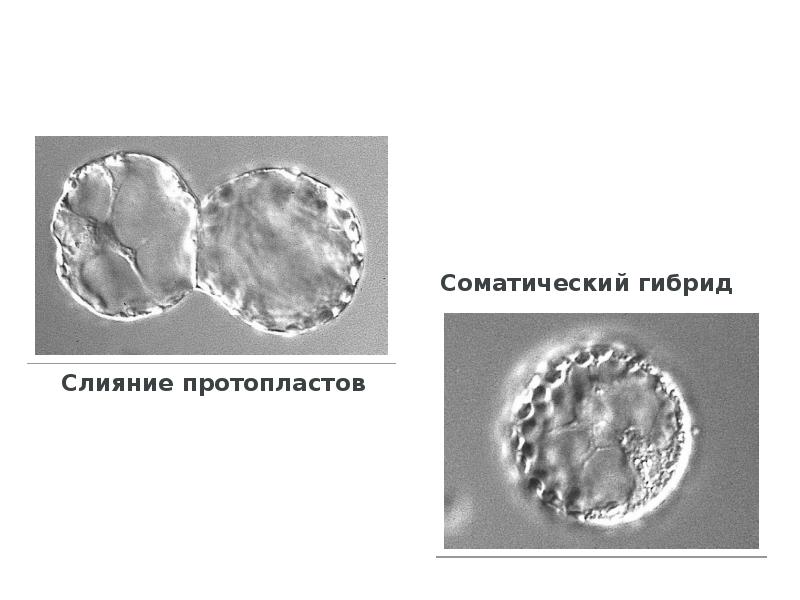
- 87. Слияние протопластов Слияние протопластов
- 88. Применение изолированных протопластов Протопласты являются уникальной моделью для изучения фундаментальных и
- 89. Розділ 4 Культивування тваринних клітин
- 90. Тема 1. Історія та проблеми розвитку культивування клітин тварин Тема 1.
- 91. Культивирование лимфоцитов периферической крови Реагенты Среда Игла 199. Фитогемагглютинин (ФГА). Инактивированная
- 92. Перед началом работы необходимо проверить наличие всей необходимой посуды и инструментов
- 93. Культуру животных тканей применяют для изучения механизмов роста и дифференцировки клеток,
- 94. История развития культивирования животных клеток Идея о том, что клетки тканей
- 95. Основные культивируемые элементы В настоящее время практически любые клетки человека и
- 96. Возможности и способы получения, особенности существования первичных культур Первичной называют клеточную
- 97. Возможности и способы получения, особенности существования первичных культур Отбор осуществляют при
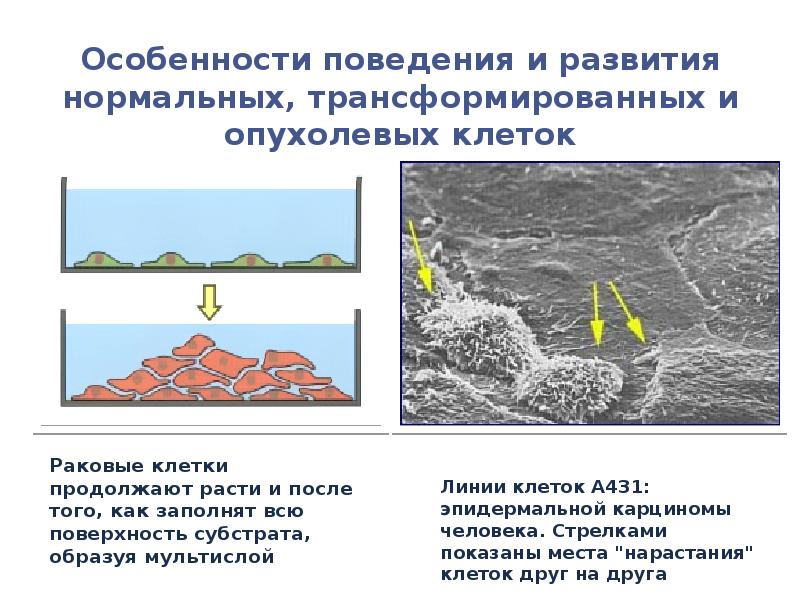
- 98. Раковые клетки продолжают расти и после того, как заполнят всю поверхность
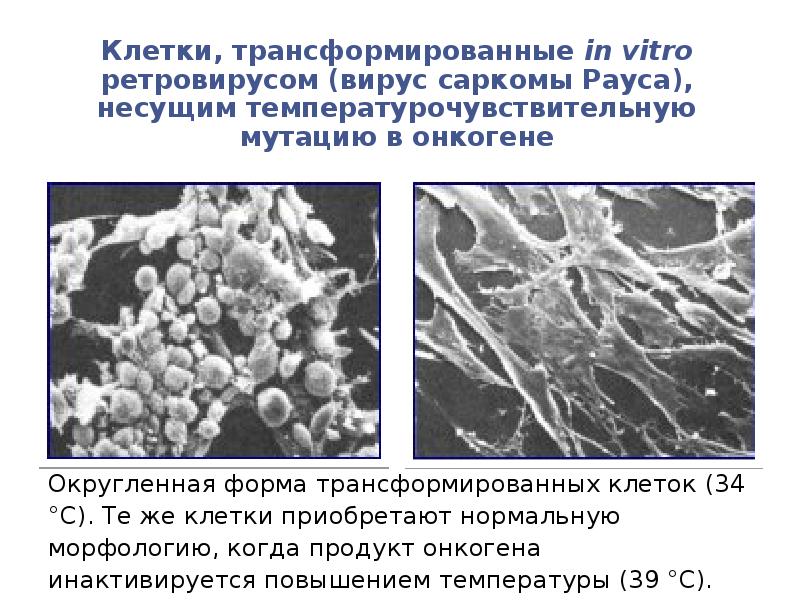
- 99. Округленная форма трансформированных клеток (34 °С). Те же клетки приобретают нормальную
- 100. Тема 2. Відмінні особливості культивування тваринних клітин Тема 2. Відмінні особливості
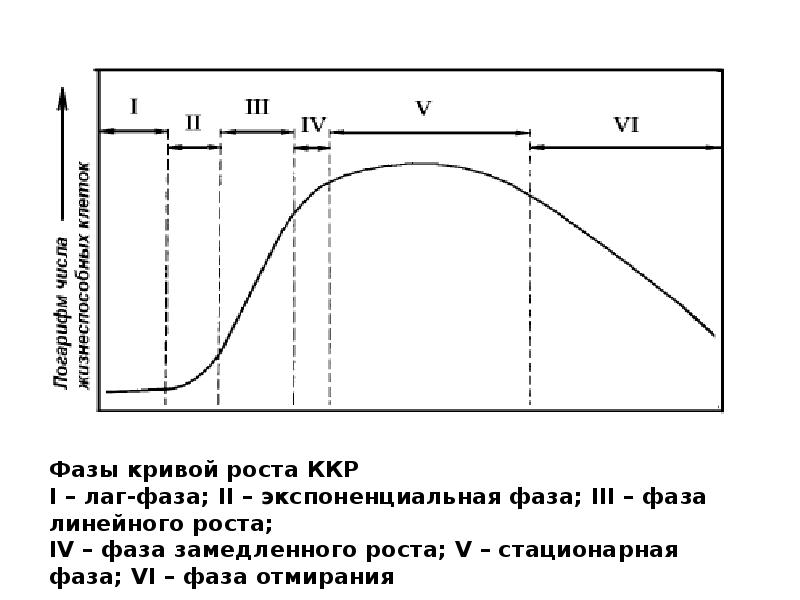
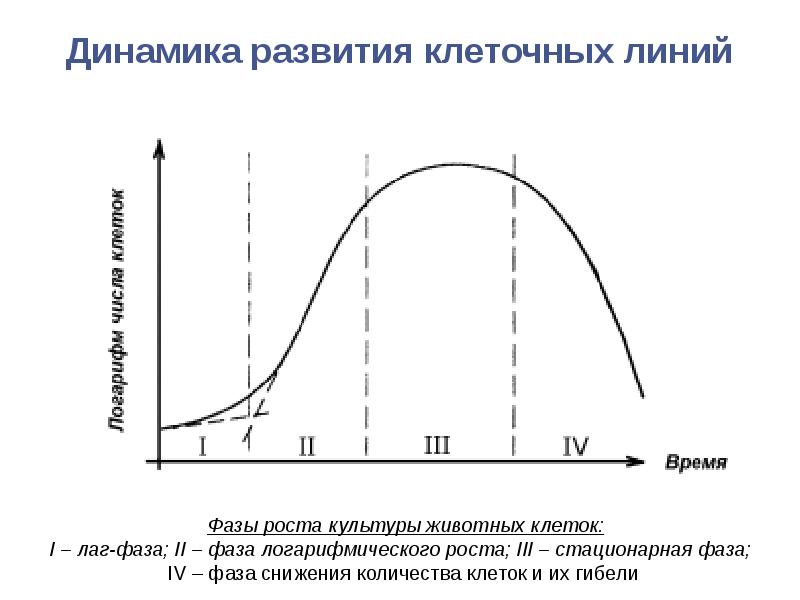
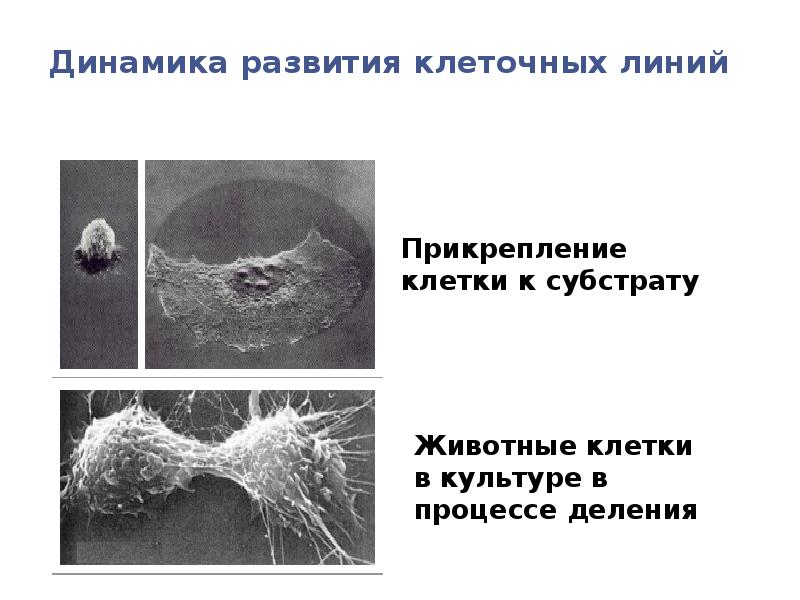
- 101. Динамика развития клеточных линий
- 102. Динамика развития клеточных линий
- 103. Существует 2 основных способа культивирования животных клеток: суспензионные культуры и монослойные
- 104. Суспензионное культивирование В 1953 г. Оуенс с сотрудниками получили первые суспензионные
- 105. Суспензионное культивирование дает 2-3-х кратную экономию питательных сред, по сравнению с
- 106. Монослойные культуры Большинство нетрансформированных клеток млекопитающих могут расти только в виде
- 107. Преимущества использования монослойных культур: Монослойные культуры могут быть применены к
- 108. Недостатки использования монослойных культур необходимость большого пространства; возрастание стоимости
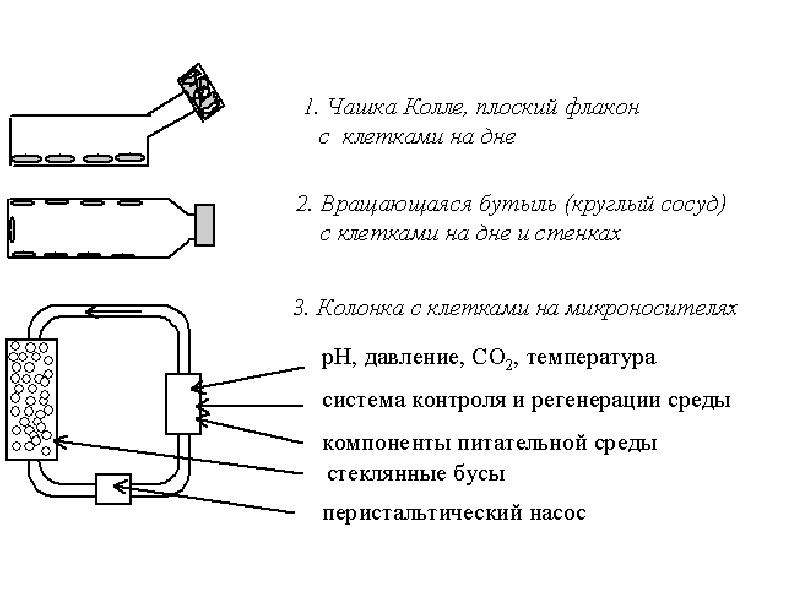
- 109. Разновидности монослойного культивирования Культивирование в плоских флаконах (матрацах). Культивирование во
- 110. Требования к микроносителям: Микроносители не должны быть: токсичными, не
- 111. Требования к микроносителям: Коммерческие классические микроносители имеют диаметр 100-250 мкм и
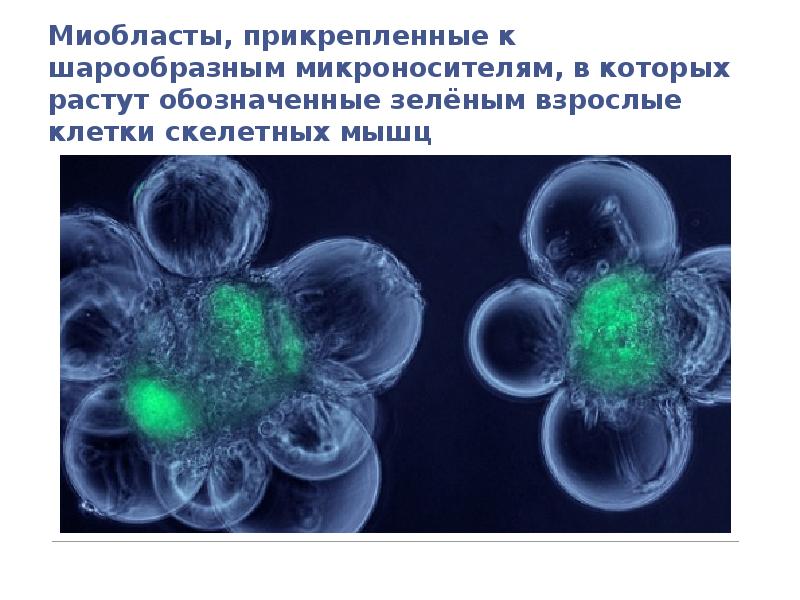
- 112. Миобласты, прикрепленные к шарообразным микроносителям, в которых растут обозначенные зелёным взрослые
- 113. Мультиклеточные опухолевые сфероиды (аденокарцинома человека MCF-7) в альгинат-хитозановых микрокапсулах
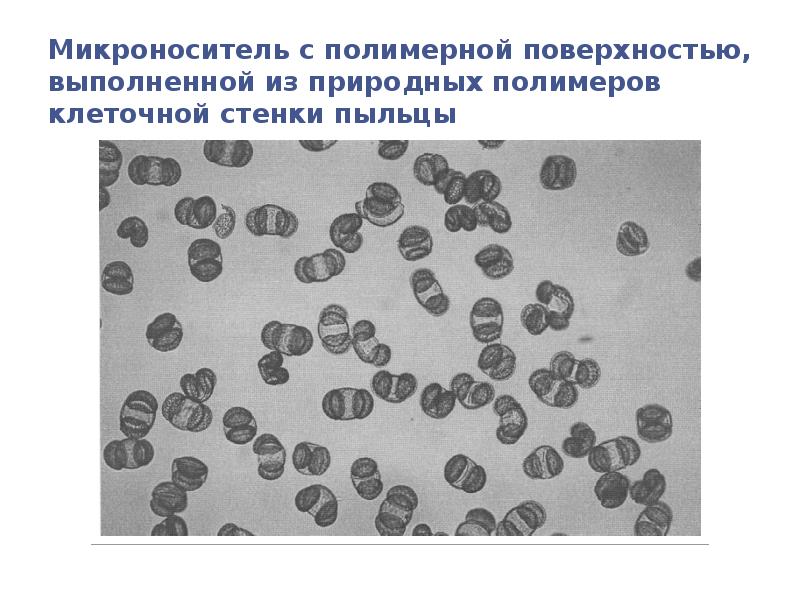
- 114. Микроноситель с полимерной поверхностью, выполненной из природных полимеров клеточной стенки пыльцы
- 115. Поверхности клеток животных и поверхности традиционных культуральных сосудов из стекла и
- 116. Системы культивирования клеток Непроточные культуры - тип культур, в котором клетки
- 117. Системы культивирования клеток 2. Проточные культуры Обеспечивают истинные гомеостатические условия.
- 120. Скачать презентацию

















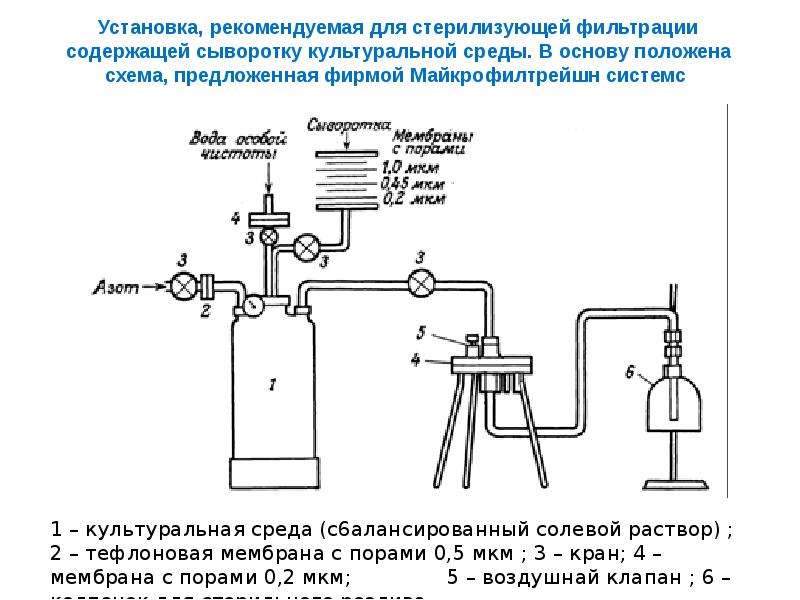




















































































Слайды и текст этой презентации
Скачать презентацию на тему Культивирование растительных и животных клеток можно ниже:
Похожие презентации