Молекулярная физика и основы термодинамики. Основные газовые законы презентация
Содержание
- 2. Основные газовые законы Закон Бойля-Мариотта: PV=const при t0=const Закон Шарля: P/T=const
- 3. Основные газовые законы Законы Шарля и Гей-Люссака имеют такой простой вид
- 4. Основные газовые законы Процессы, описываемые уравнениями 1-3 называются изопроцессами: Изотермическим
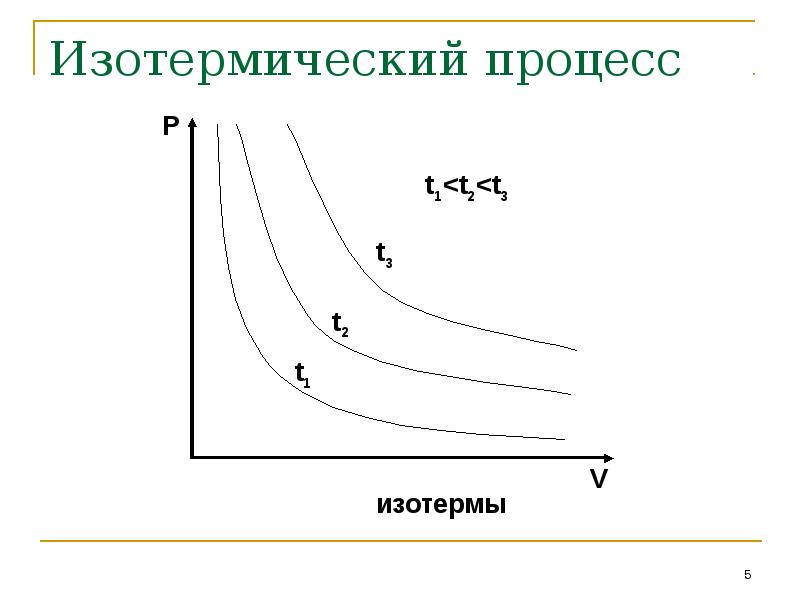
- 5. Изотермический процесс
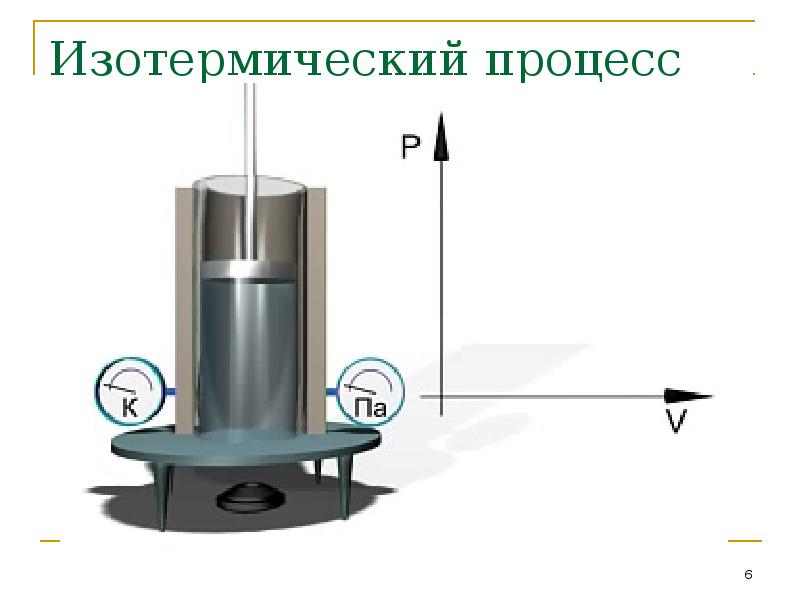
- 6. Изотермический процесс
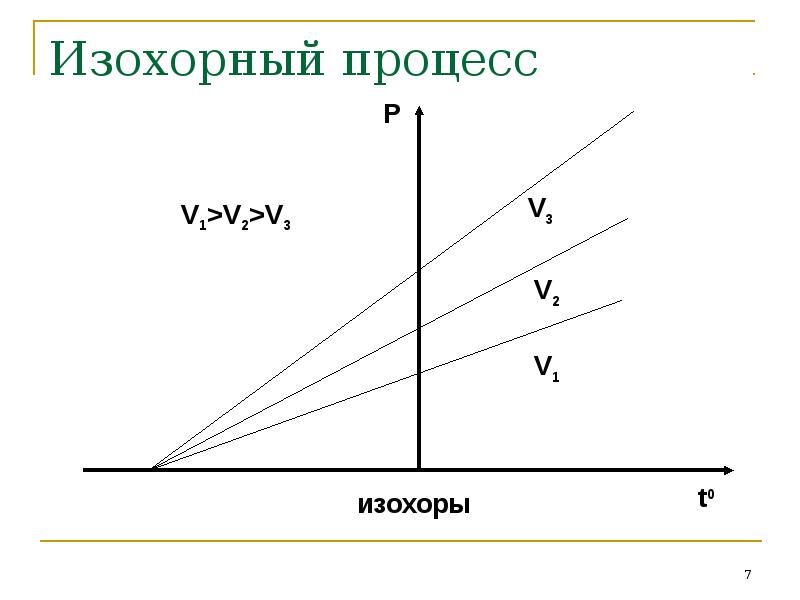
- 7. Изохорный процесс
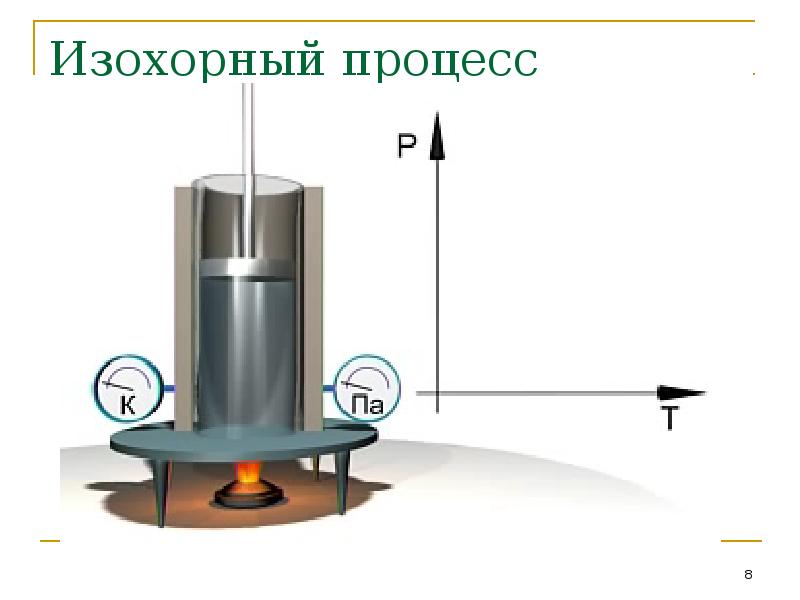
- 8. Изохорный процесс
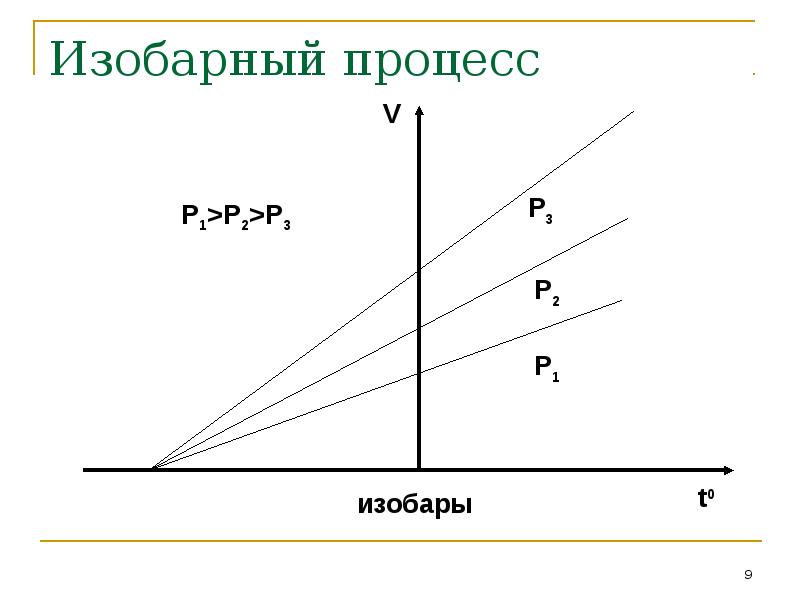
- 9. Изобарный процесс
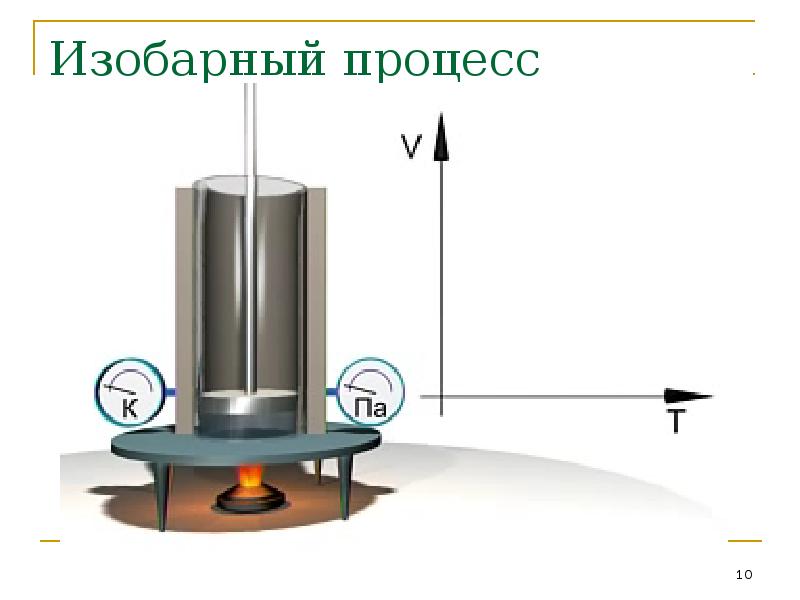
- 10. Изобарный процесс
- 11. Основные газовые законы Если измерять температуру по шкале Цельсия, то оказывается,
- 12. Основные газовые законы Если ввести новую шкалу температур, такую, что Т=t+273,15,
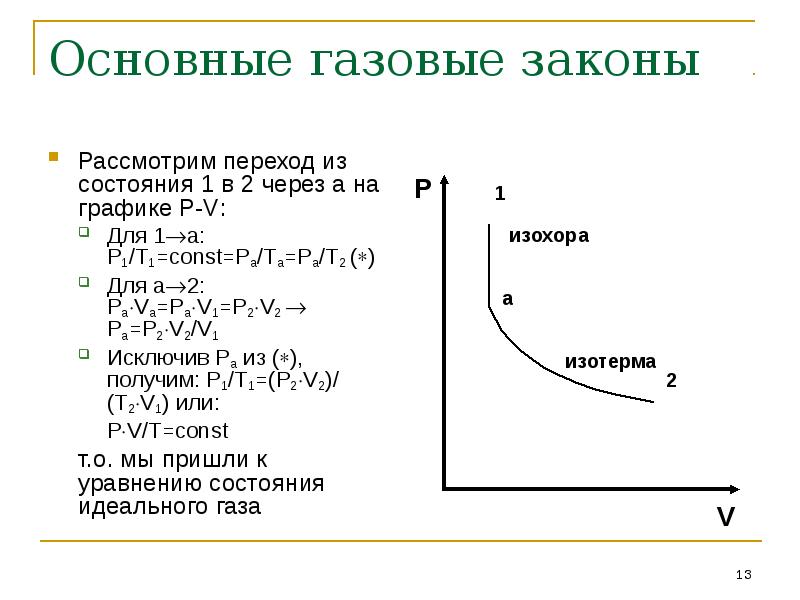
- 13. Основные газовые законы Рассмотрим переход из состояния 1 в 2 через
- 14. Основные газовые законы Из закона Авогадро следует, что величина соотношения (PV)/T
- 15. Основные газовые законы Т.о., мы пришли к уравнению Клапейрона-Менделеева: PV=RT или
- 16. Скачать презентацию








Слайды и текст этой презентации
Скачать презентацию на тему Молекулярная физика и основы термодинамики. Основные газовые законы можно ниже:
Похожие презентации





























