Общие пути обмена аминокислот. (Лекция 11) презентация
Содержание
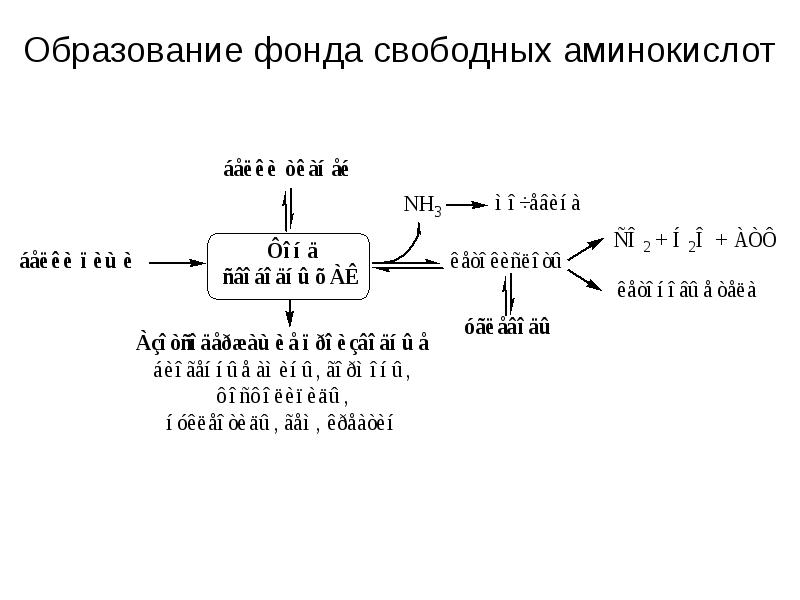
- 2. П Л А Н Классификация, строение, свойства аминокислот. Пути образования пула
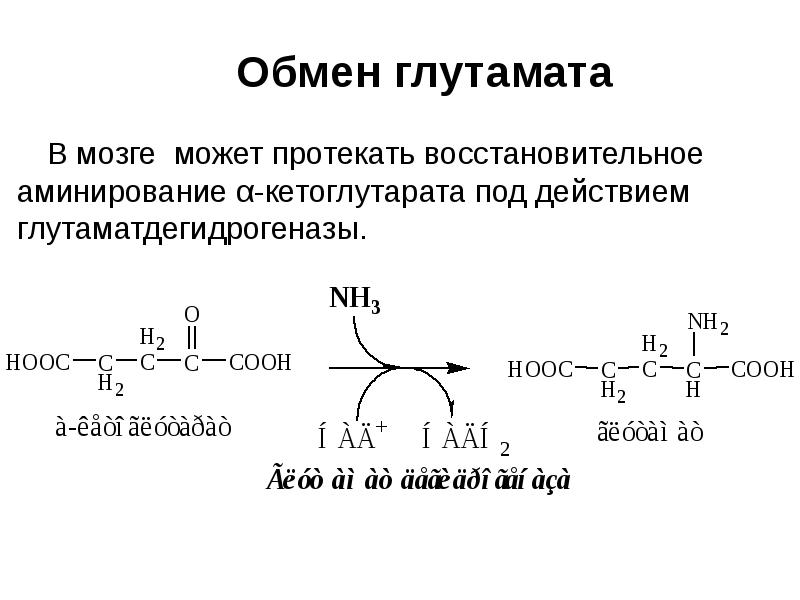
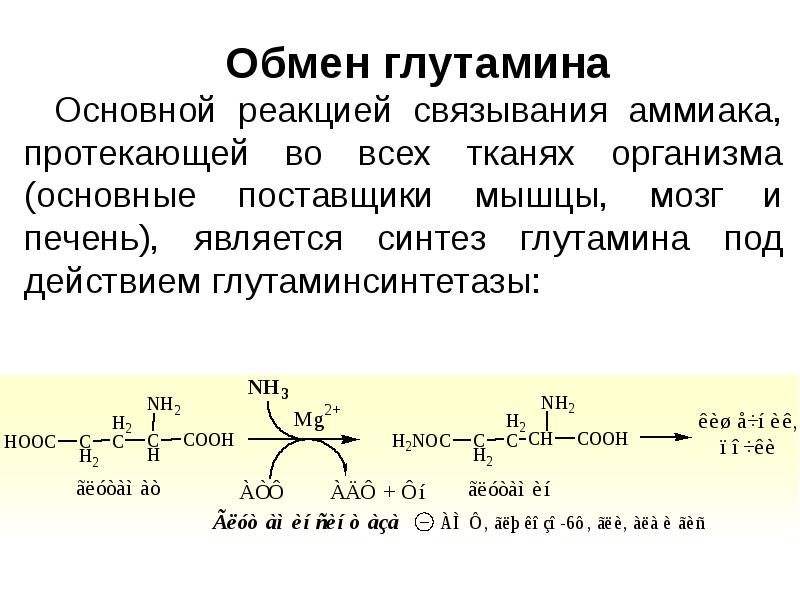
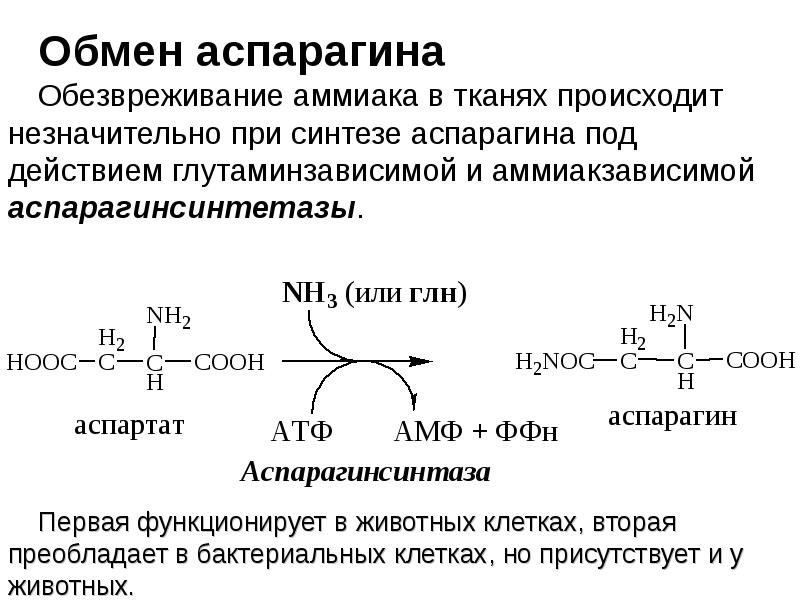
- 3. Реакции использования и обезвреживания аммиака: образование глутамина, аспарагина, мочевины. Тканевые особенности.
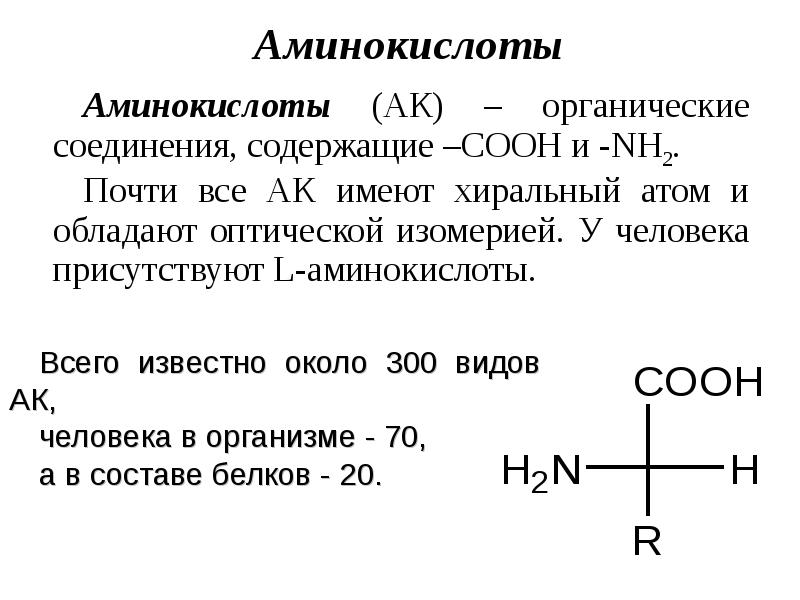
- 6. Классификация АК по природе радикала:
- 7. Классификация АК по способности к синтезу Заменимые - синтезируются в организме
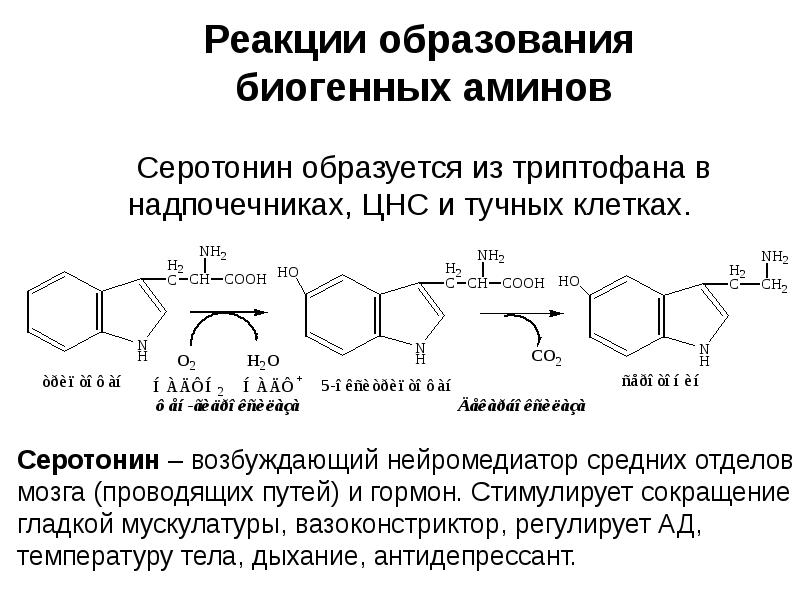
- 8. ФУНКЦИИ АК Используются для синтеза белков, углеводов, липидов, нуклеиновых кислот, биогенных
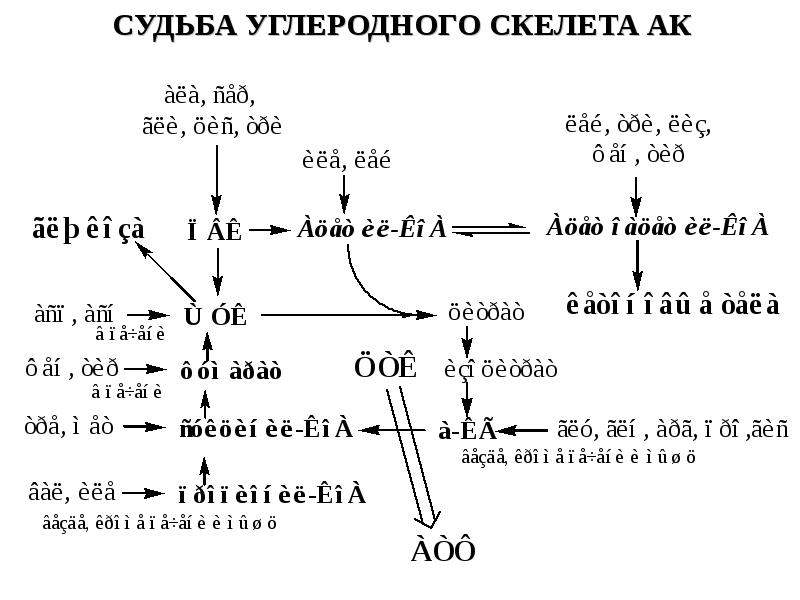
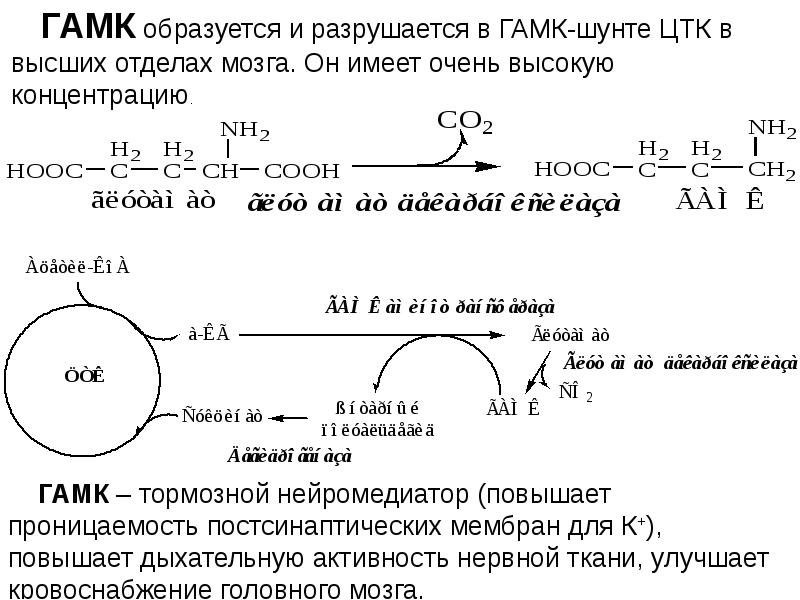
- 9. Гликогенные аминокислоты - превращаются в ПВК и промежуточные продукты ЦТК (а-КГ,
- 12. Общие реакции обмена аминокислот Биосинтез белка Трансаминирование Дезаминирование Декарбоксилирование
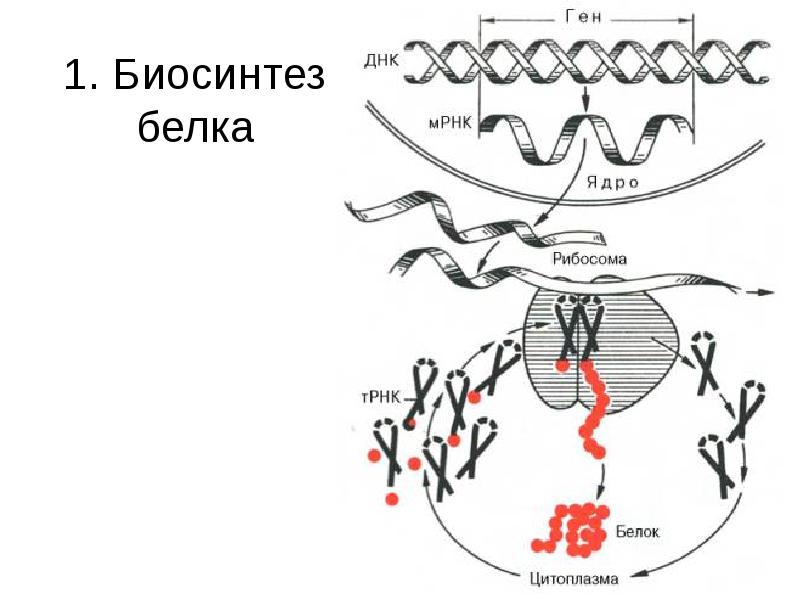
- 13. 1. Биосинтез белка
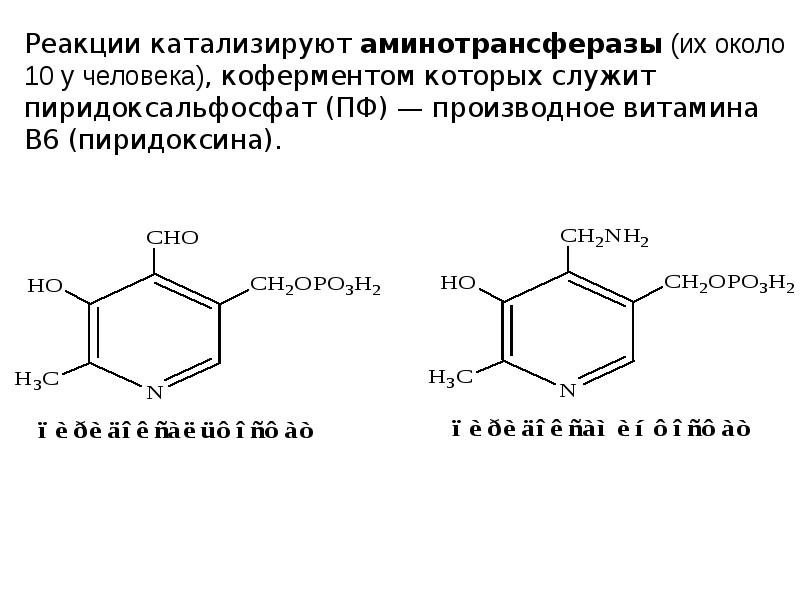
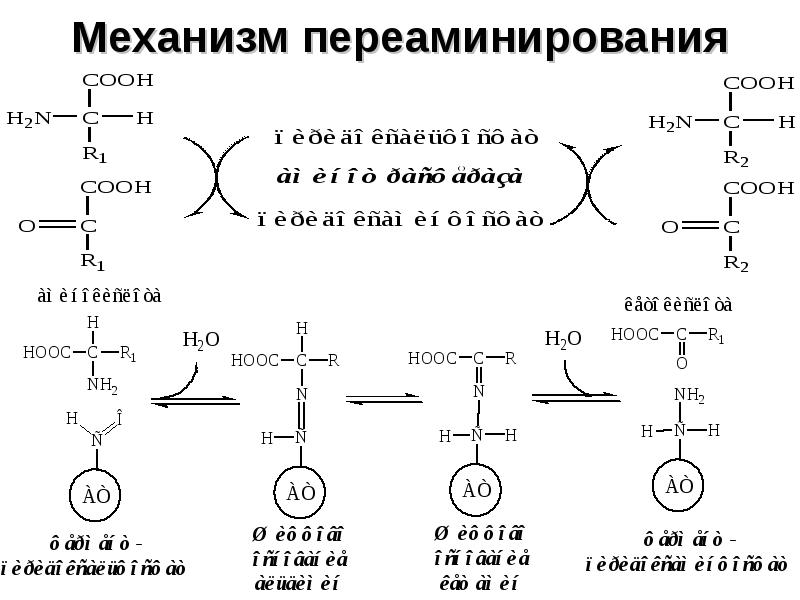
- 14. 2. Трансаминирование Трансаминирование — реакция переноса α-аминогруппы с АК на α-кетокислоту,
- 16. Механизм переаминирования
- 17. 3. ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ — реакция отщепления α-аминогруппы от АК, в
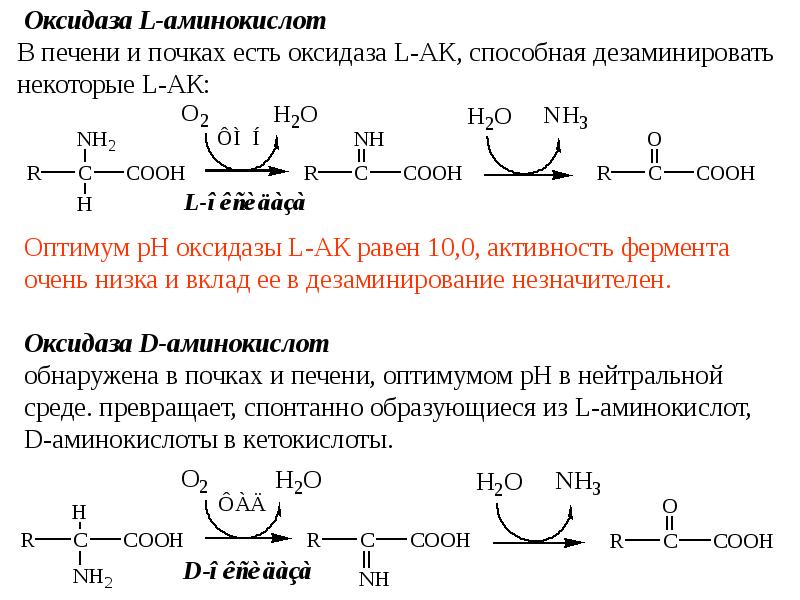
- 18. А. виды прямого дезаминирования АК окислительное; неокислительное; внутримолекулярное; восстановительное; гидролитическое.
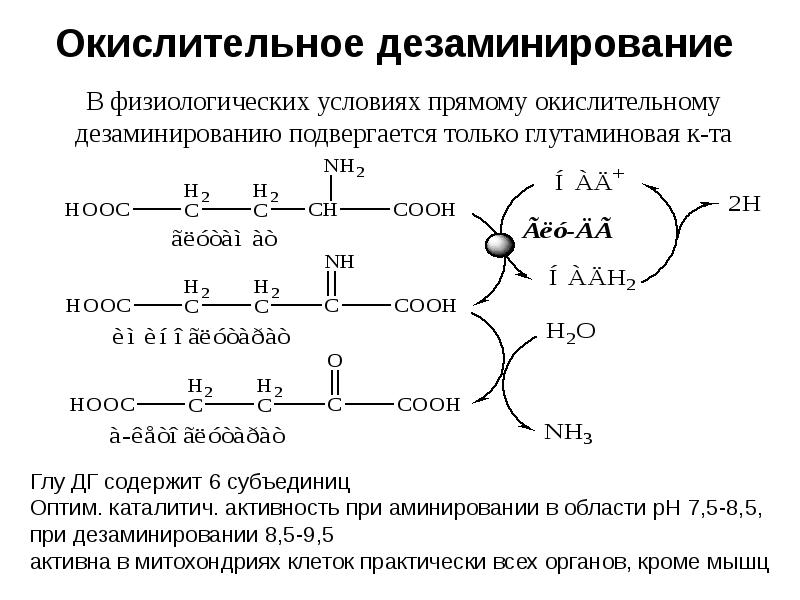
- 19. Окислительное дезаминирование
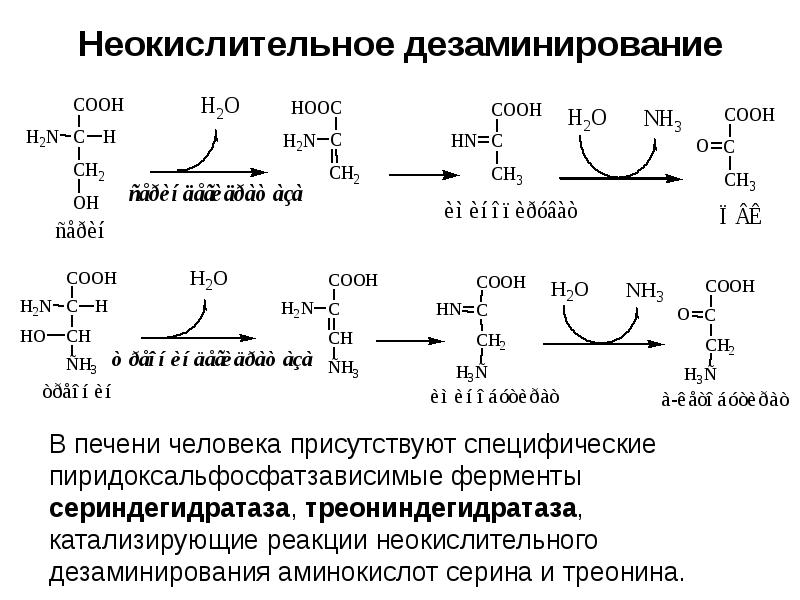
- 21. Неокислительное дезаминирование
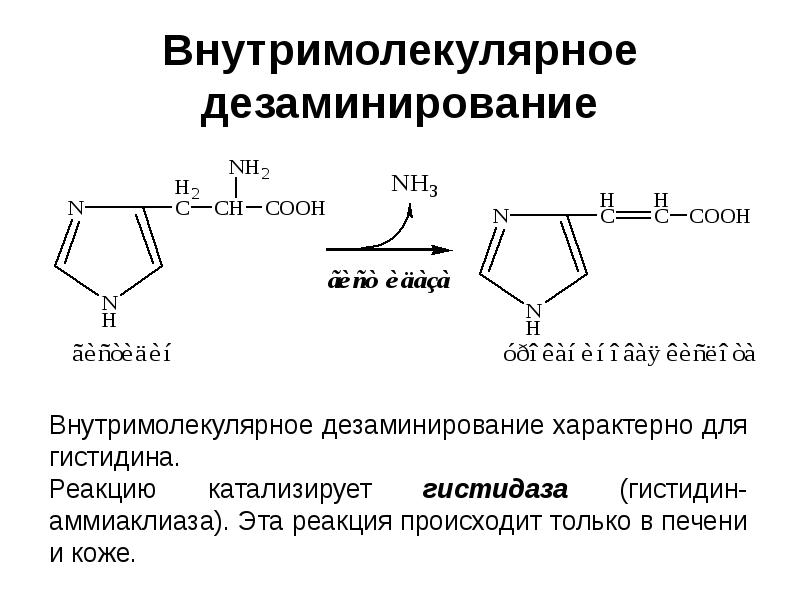
- 22. Внутримолекулярное дезаминирование
- 23. Б. Непрямое дезаминирование АК происходит в 2 стадии с участием нескольких
- 25. Органоспецифичные ферменты АЛТ: ала + α-КГ ↔ ПВК
- 27. 4. Декарбоксилирование Декарбоксилирование –это процесс отщепления карбоксильной группы от аминокислот.
- 28. типы декарбоксилирования аминокислот α-Декарбоксилирование, ω-Декарбоксилирование Декарбоксилирование, связанное с реакцией трансаминирования,
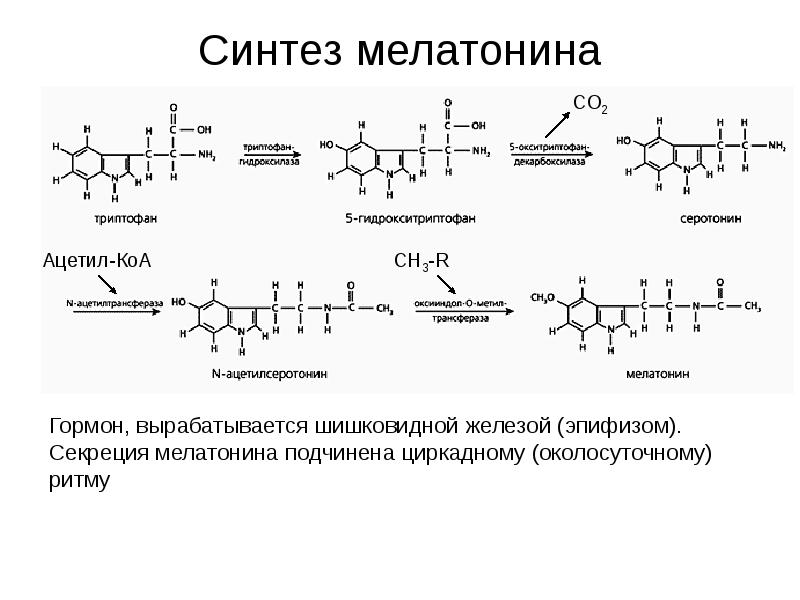
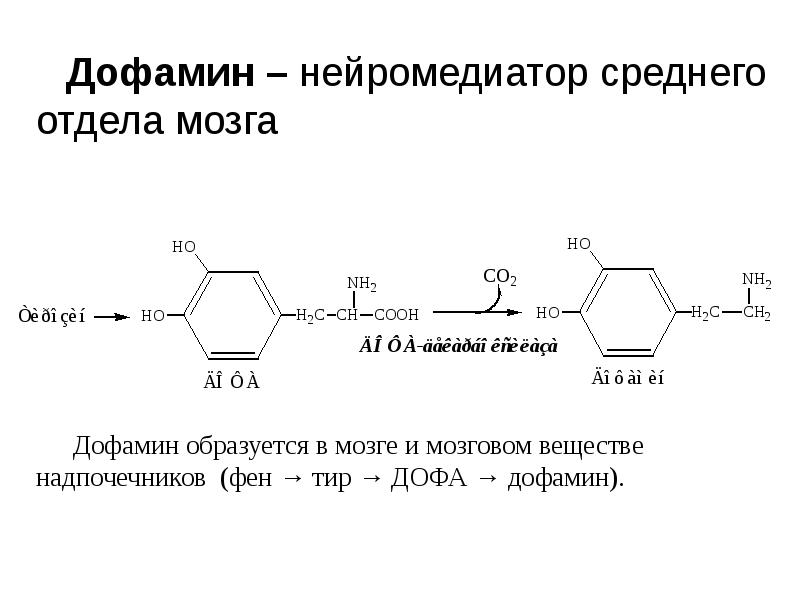
- 30. Синтез мелатонина
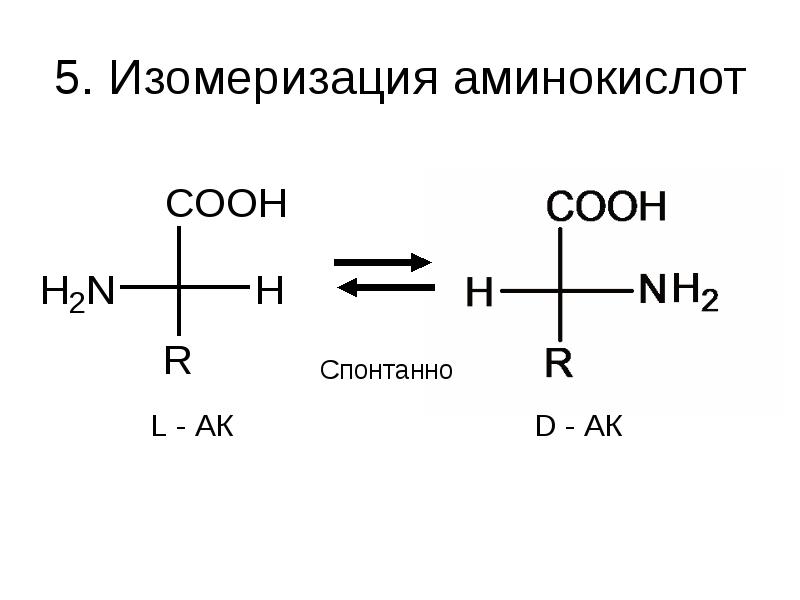
- 34. 5. Изомеризация аминокислот
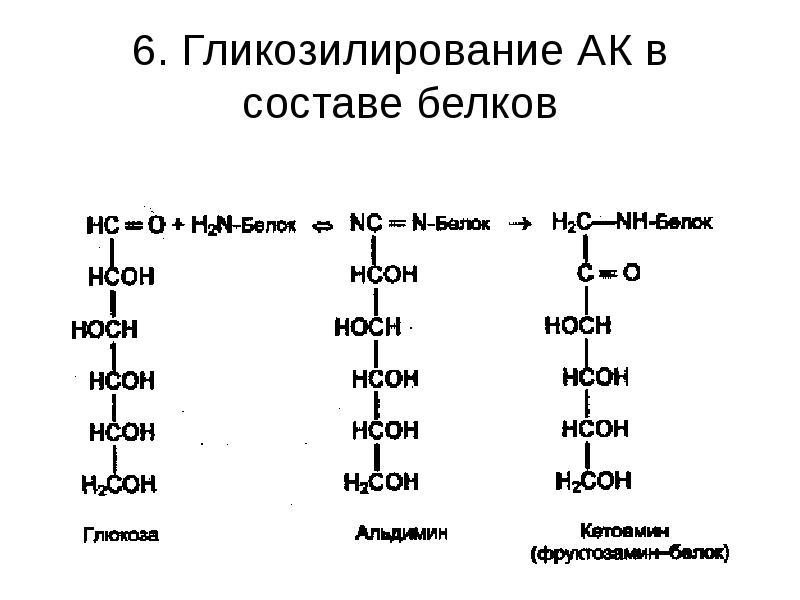
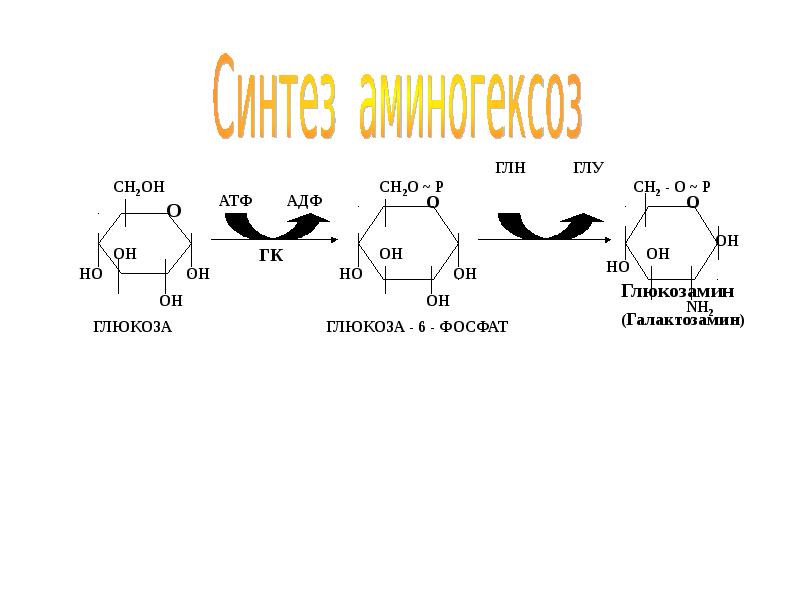
- 35. 6. Гликозилирование АК в составе белков
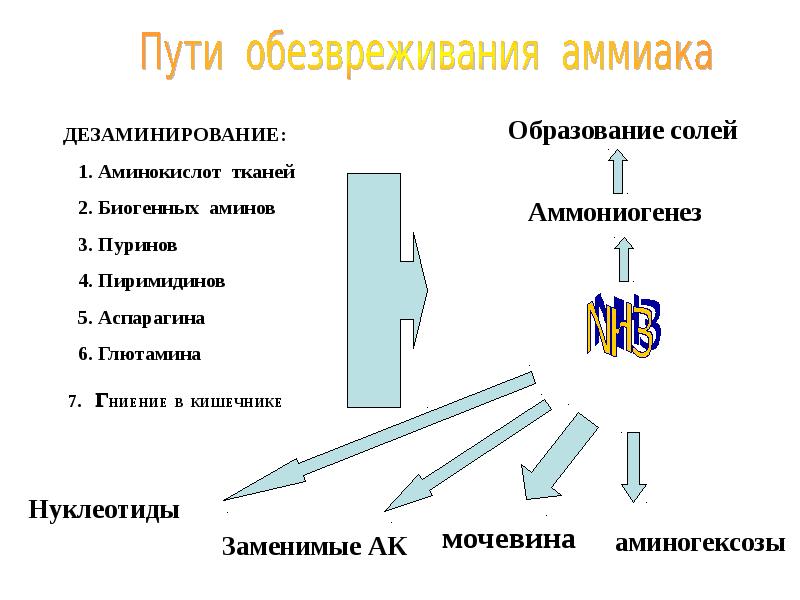
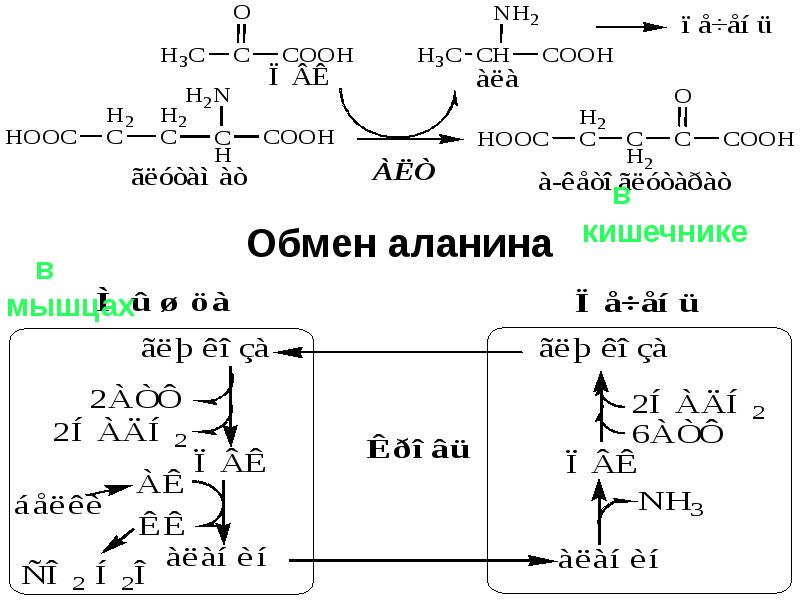
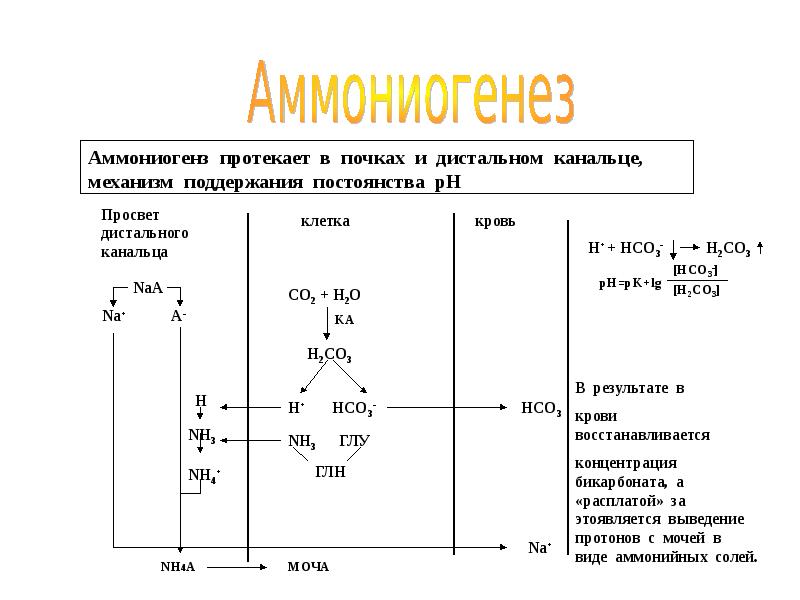
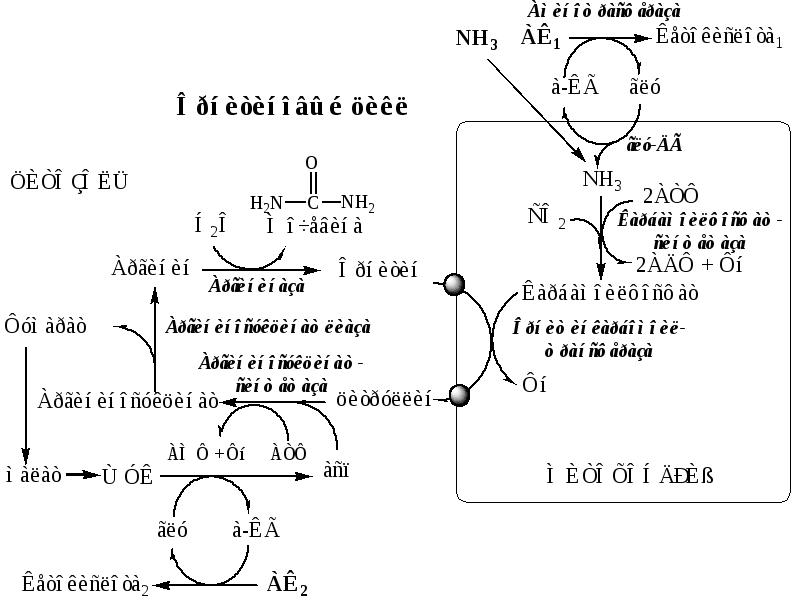
- 36. ОБМЕН АММИАКА образуется при: дезаминировании АК во всех тканях (много)
- 37. Концентрация аммиака в норме 99% - в виде иона аммония
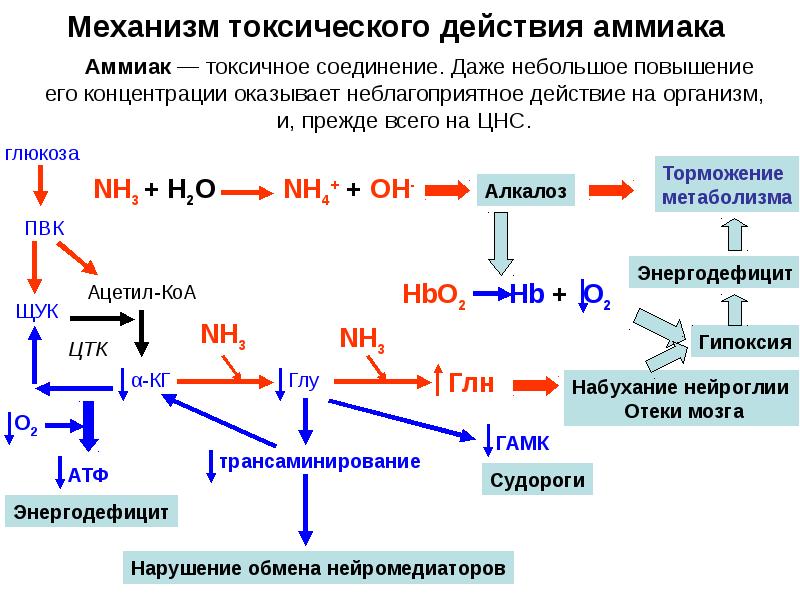
- 38. Механизм токсического действия аммиака
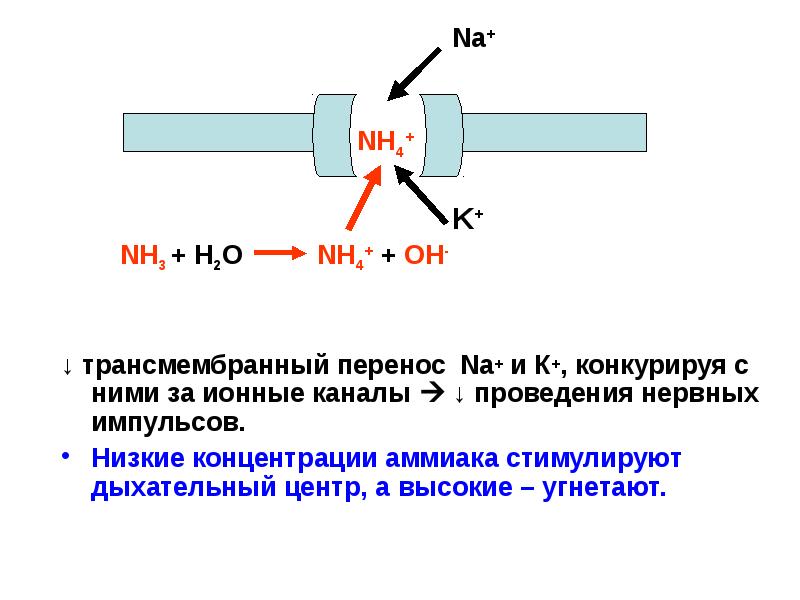
- 39. ↓ трансмембранный перенос Na+ и К+, конкурируя с ними за ионные
- 40. Клинические признаки острого отравления парами аммиака Головокружение Потеря памяти Потеря сознания
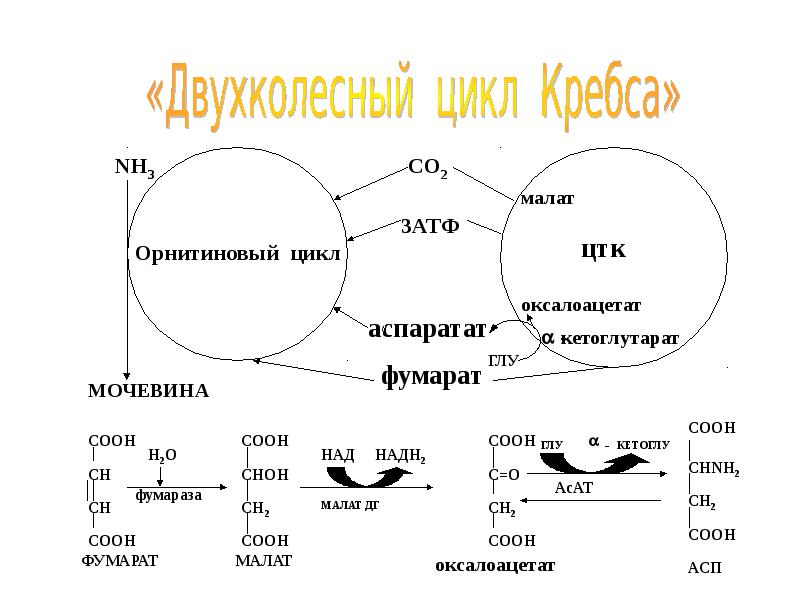
- 55. суммарно СO2 + NH3 + 3АТФ + 2H2O + Асп
- 56. Взаимосвязь орнитинового цикла с ЦТК Взаимосвязь орнитинового цикла с ЦТК Для
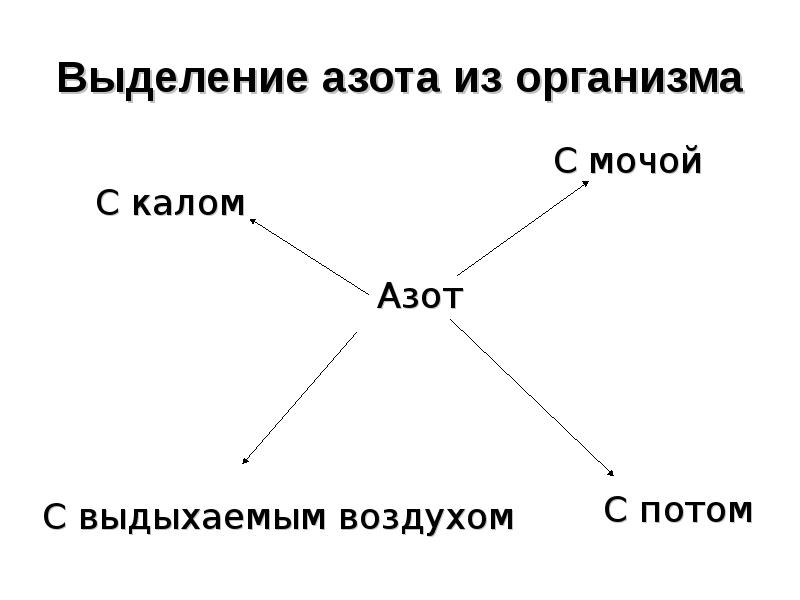
- 58. Выделение азота из организма
- 60. Скачать презентацию























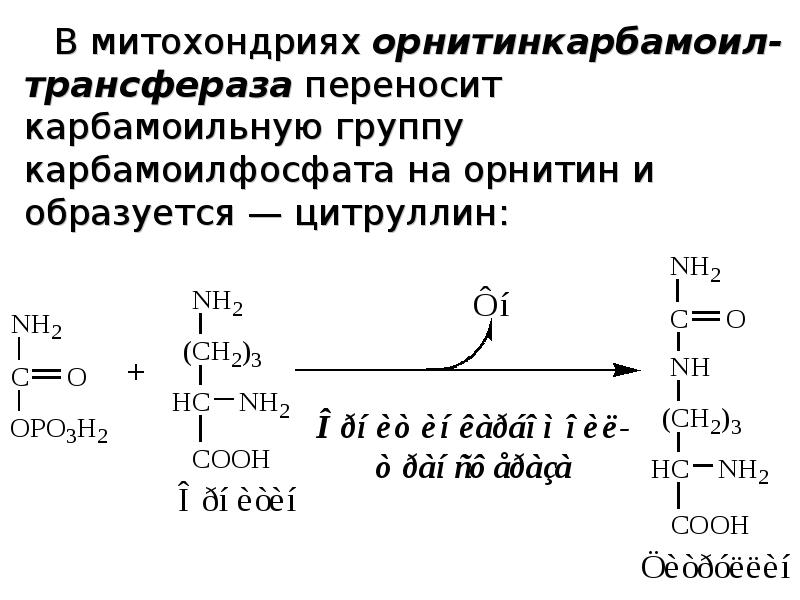
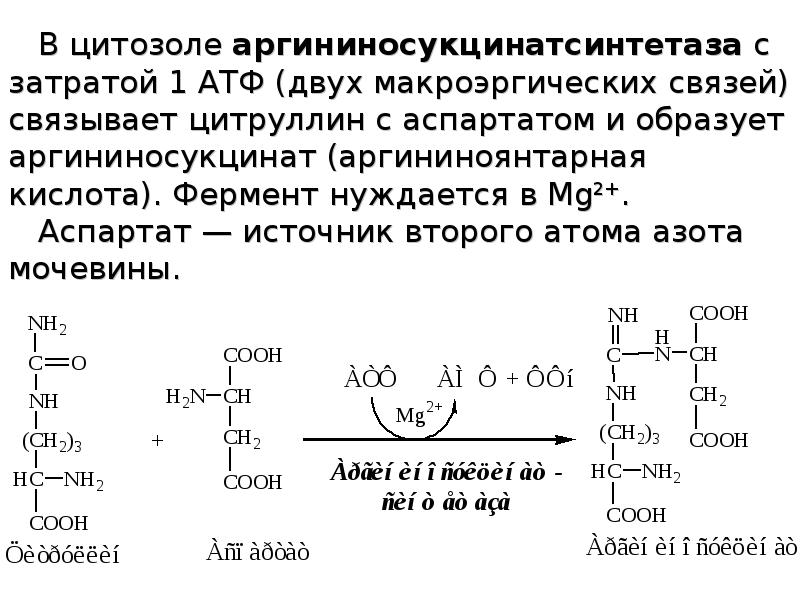
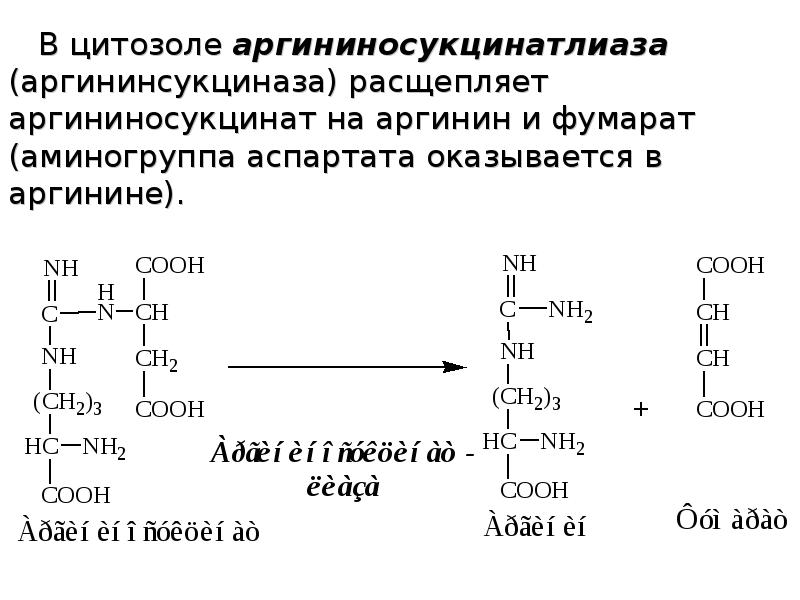

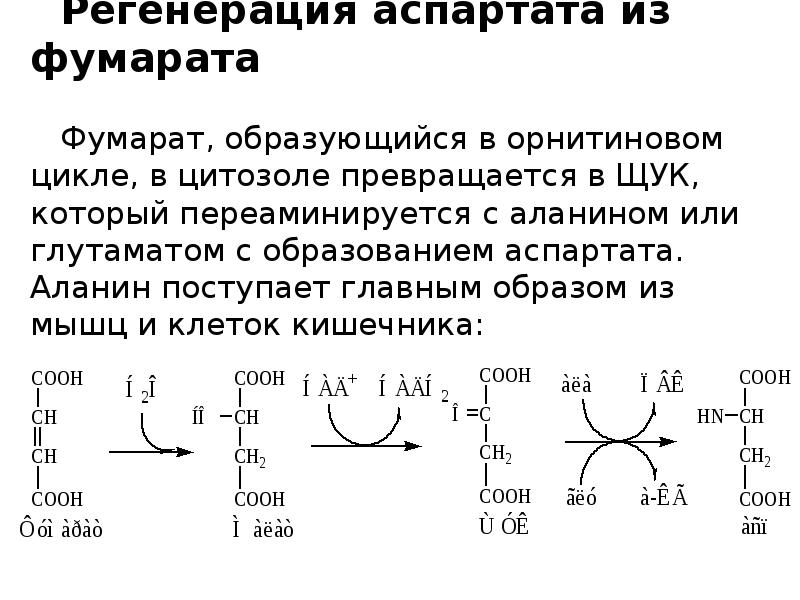



Слайды и текст этой презентации
Скачать презентацию на тему Общие пути обмена аминокислот. (Лекция 11) можно ниже:
Похожие презентации