Окислительно-восстановительные реакции в органической химии презентация
Содержание
- 3. С3 . Задания этого блока проверяют знания по органической химии
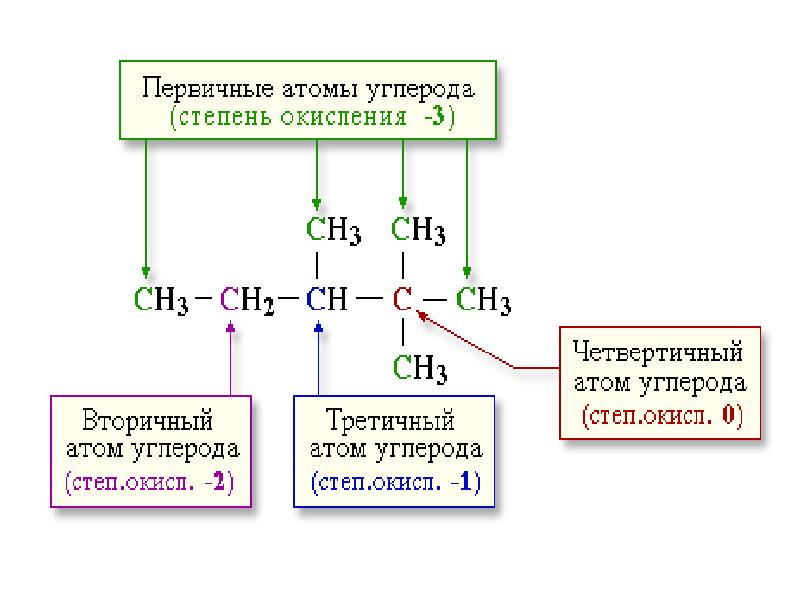
- 4. Определение степени окисления атомов в молекулах органических соединений ПРАВИЛО: СО
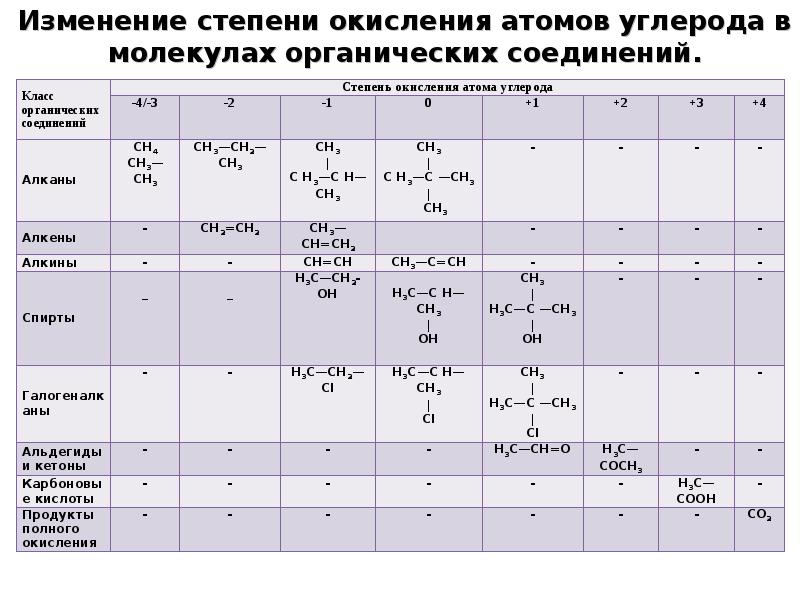
- 5. Изменение степени окисления атомов углерода в молекулах органических соединений.
- 7. Склонность органических соединений к окислению связывают с наличием: кратных связей (легко
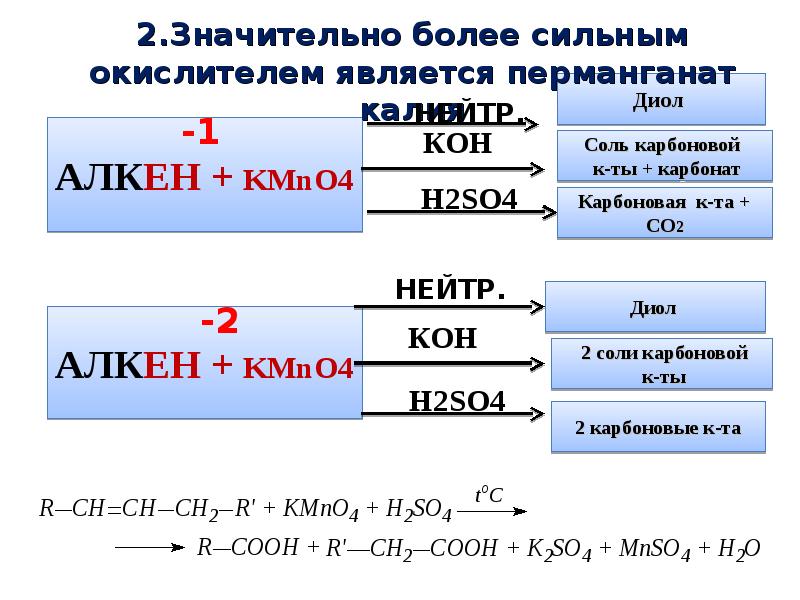
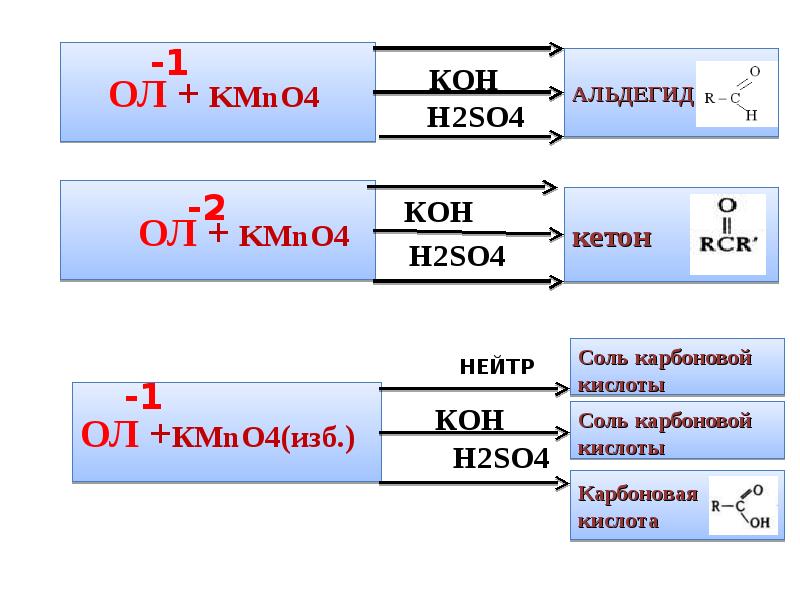
- 8. 1.МЯГКОЕ ОКИСЛЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Для мягкого окисления органических соединений
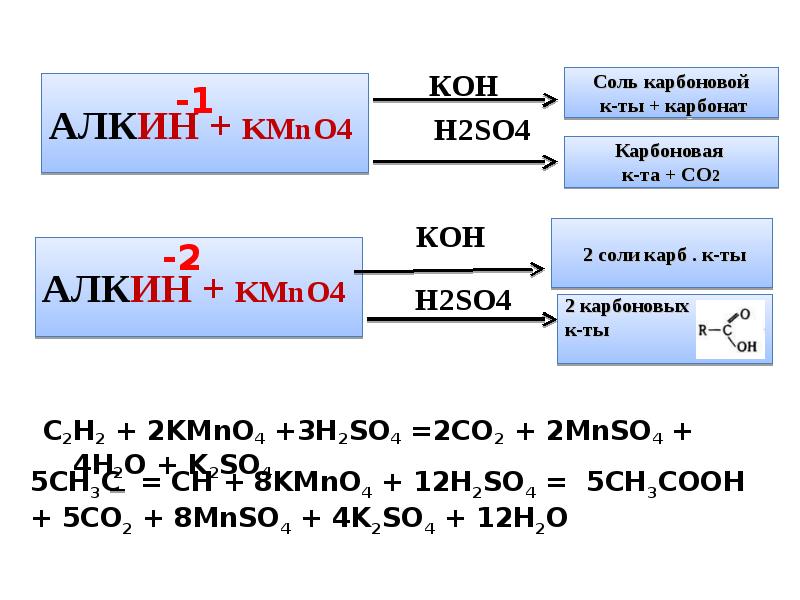
- 10. C2H2 + 2KMnO4 +3H2SO4 =2CO2 + 2MnSO4 + 4H2O + K2SO4
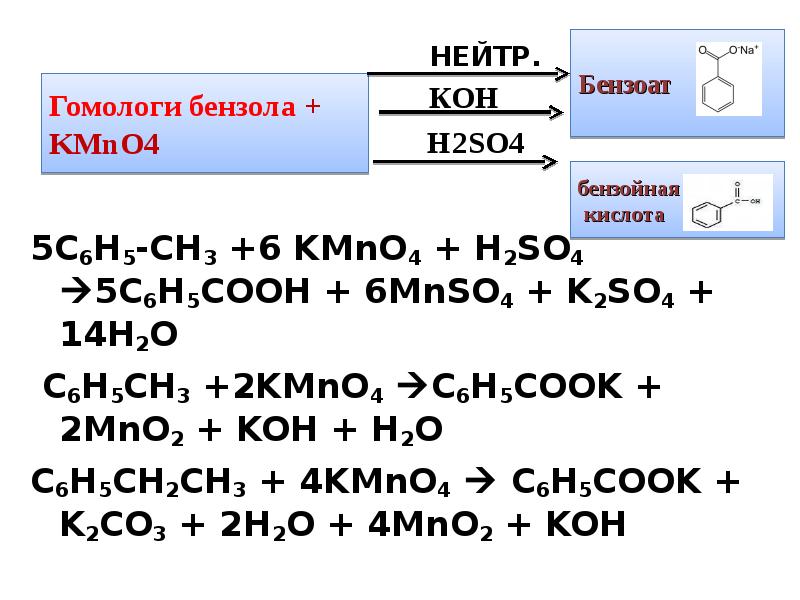
- 11. 5C6H5-CH3 +6 KMnO4 + H2SO4 5C6H5COOH + 6MnSO4 + K2SO4 +
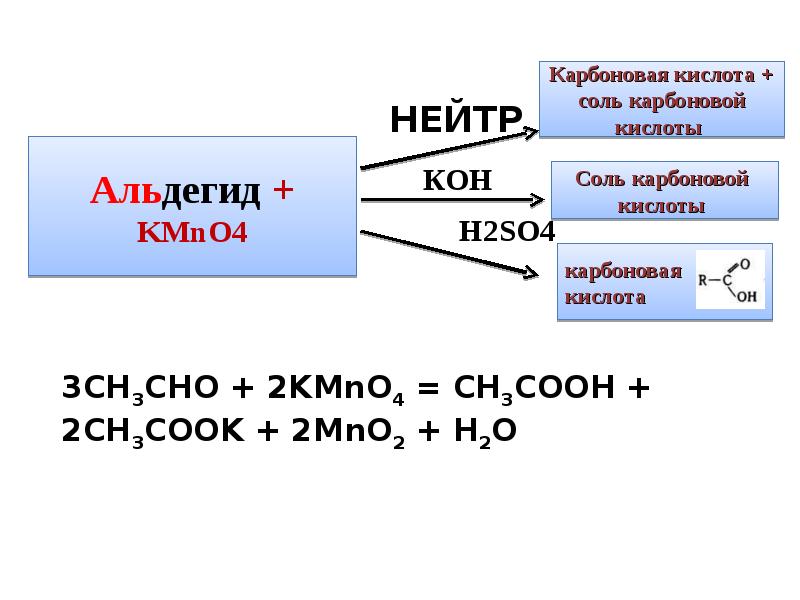
- 12. Окислительно-восстановительные свойства кислородсодержащих соединений
- 16. Алгоритм подбора коэффициентов Поскольку в задании С3 при
- 17. Пример тестового задания(С3) 1. Напишите уравнения реакций, с помощью
- 18. Сайты тренажеры: http://reshuege.ru/ (Решу ЕГЭ) http://4ege.ru/himiya/4181-demoversiya-ege-po-himii-2014.html (ЕГЭ портал) http://www.alleng.ru/edu/chem3.htm (Образовательные ресурсы
- 20. Скачать презентацию












Слайды и текст этой презентации
Скачать презентацию на тему Окислительно-восстановительные реакции в органической химии можно ниже:
Похожие презентации





























