Основні закономірності термодинаміки. Термостатика та термодинаміка. Лекція 1 презентация
Содержание
- 2. Перший закон термодинаміки Зміна внутрішньої енергії закритої системи, яка відбувається
- 3. Другий закон термодинаміки Для системи із сталою температурою існує певна функція
- 4. Теорема Нернста, відома також під назвою третій закон термодинаміки, стверджує, що
- 5. Нульовий закон термодинаміки — теорема, яка формулюється таким чином: якщо дві
- 7. ОСНОВНІ ПОНЯТТЯ ТА ВИЗНАЧЕННЯ ХІМІЧНОЇ ТЕРМОДИНАМІКИ Термодинаміка історично виникла як вчення
- 8. Одним із основних понять хімічної термодинаміки є поняття термодинамічної системи. Системою
- 9. Стан термодинамічної системи, яка складається з чистої речовини і перебуває в
- 12. Найважливішою характеристикою термодинамічної системи є її внутрішня енергія U, яка являє
- 13. Енергія, яка передається одним тілом іншому при їх взаємодії, яка залежить
- 15. ПЕРШИЙ ЗАКОН ТЕРМОДИНАМІКИ. ТЕПЛОЄМНІСТЬ Перший закон термодинаміки являє собою постулат, який
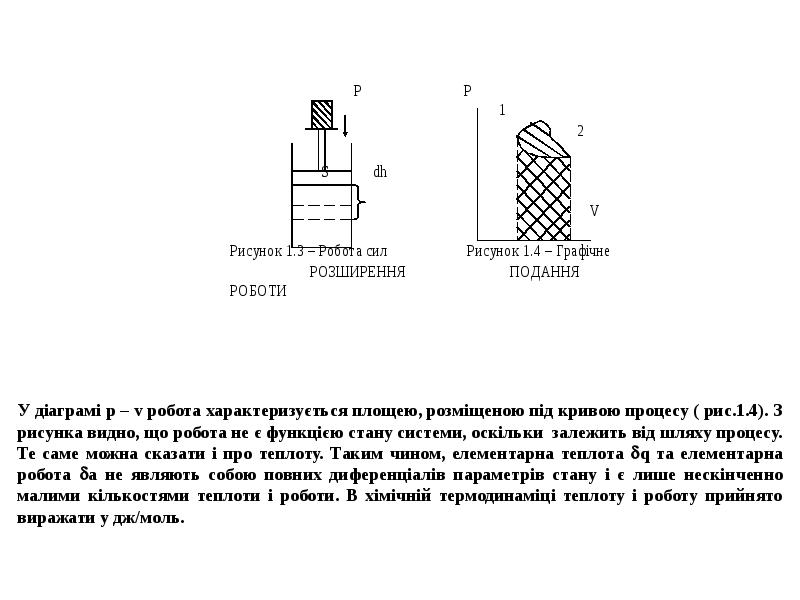
- 16. Для випадку, коли єдиним видом роботи, яку здійснює система, є робота
- 17. При Р=const та Н=U+PV, або U=H–PV, знаходимо dU=dH–PdV і підставляємо це
- 18. РОЗРАХУНОК ТЕПЛОТИ І РОБОТИ В ОСНОВНИХ ТЕРМОДИНАМІЧНИХ ПРОЦЕСАХ 1) Ізотермічний
- 19. 3) Ізобаричний процес (Р = const). У цьому випадку АР =
- 20. Але із рівняння Менделєєва-Клапейрона
- 21. Скачать презентацию



















Слайды и текст этой презентации
Скачать презентацию на тему Основні закономірності термодинаміки. Термостатика та термодинаміка. Лекція 1 можно ниже:
Похожие презентации





























