Основные классы неорганических соединений презентация
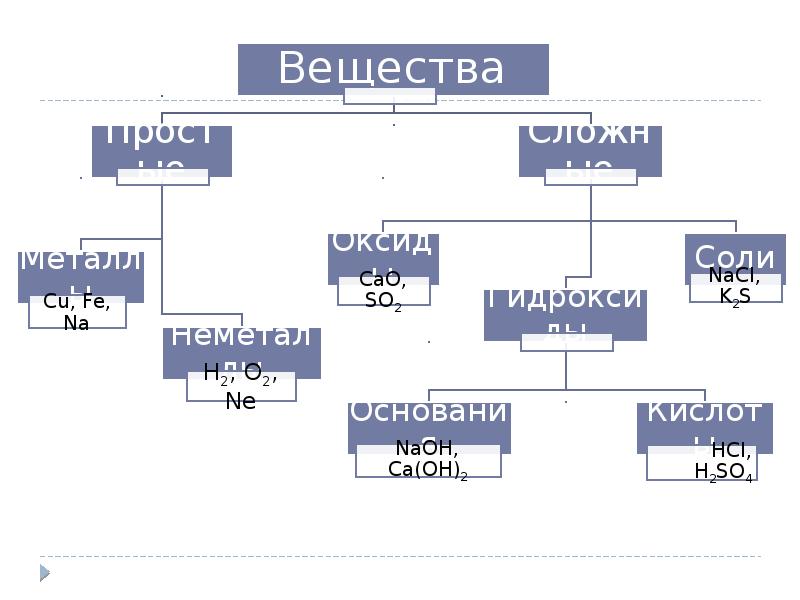
Содержание
- 3. Простые вещества Металлы І группа главная подгруппа – щелочные металлы ІІ
- 4. Металлы. Неметаллы
- 5. Физические свойства простых веществ
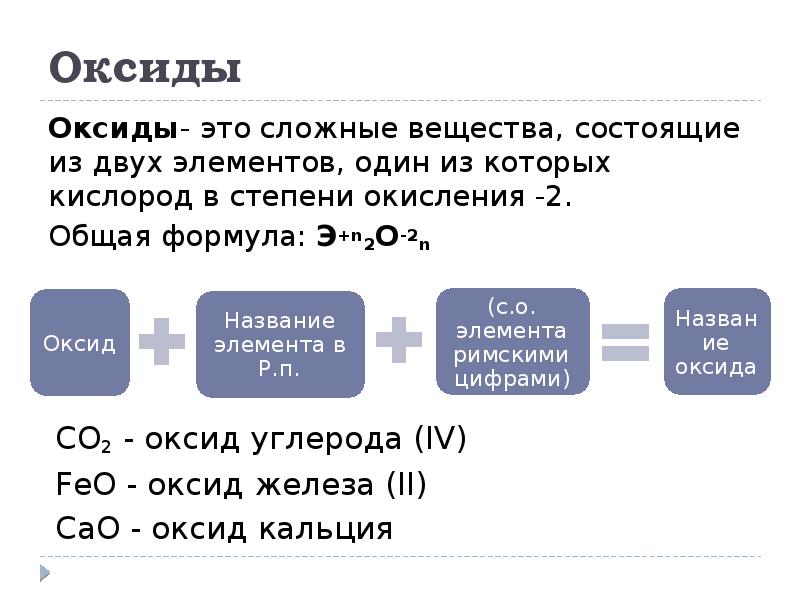
- 6. Оксиды Оксиды- это сложные вещества, состоящие из двух элементов, один из
- 7. Оксиды 1) Несолеобразующие - CO, SiO, N2O, NO, NO2 2) Солеобразующие
- 8. Гидриды Гидриды - соединения водорода с металлами или менее электроотрицательными, чем
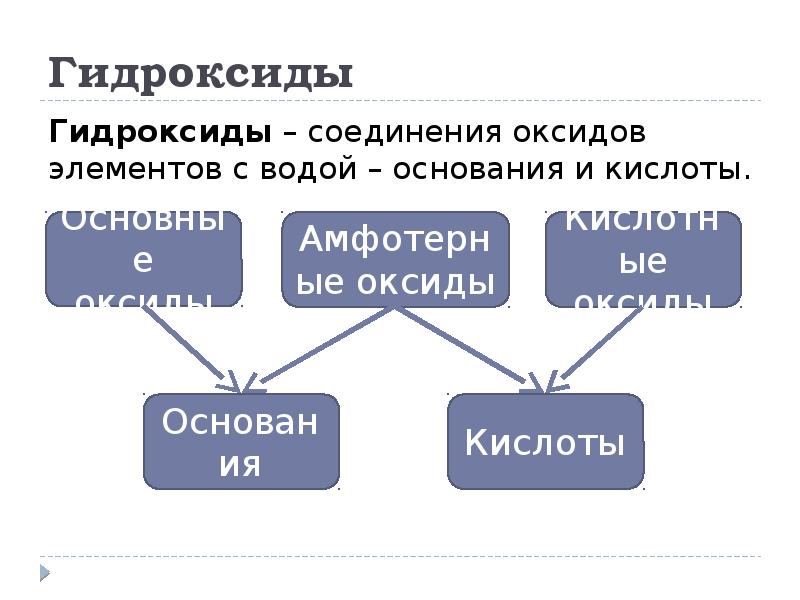
- 9. Гидроксиды Гидроксиды – соединения оксидов элементов с водой – основания и
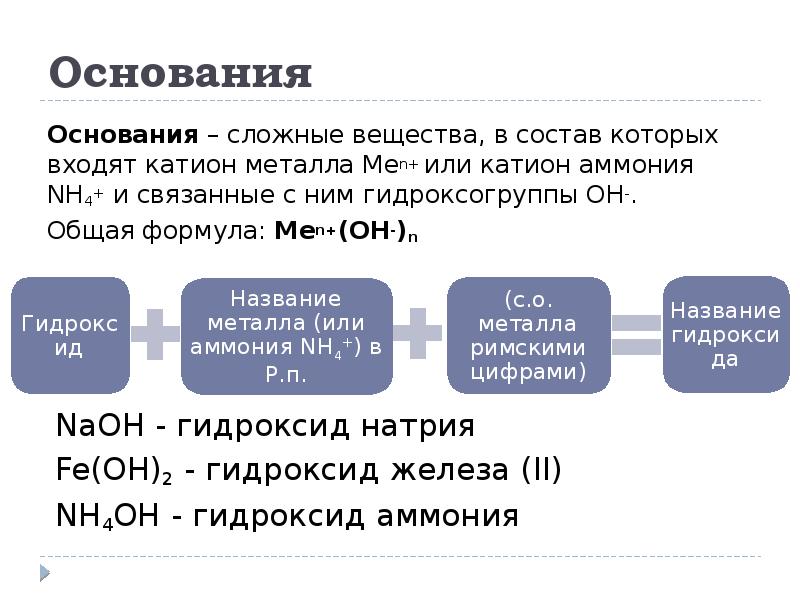
- 10. Основания Основания – сложные вещества, в состав которых входят катион металла
- 11. Основания По числу гидроксогрупп OH: Однокислотные – NaOH, KOH Двухкислотные –
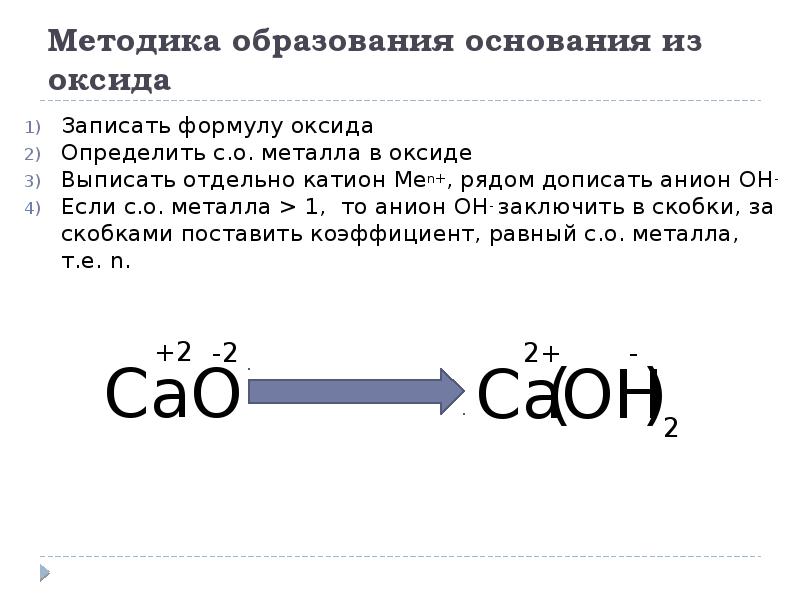
- 12. Методика образования основания из оксида Записать формулу оксида Определить с.о. металла
- 13. Кислоты Кислоты – сложные вещества, молекулы которых состоят из атомов водорода
- 14. Кислоты По основности: Одноосновные – HF, HCl Двухосновные – H2S, H2SO4
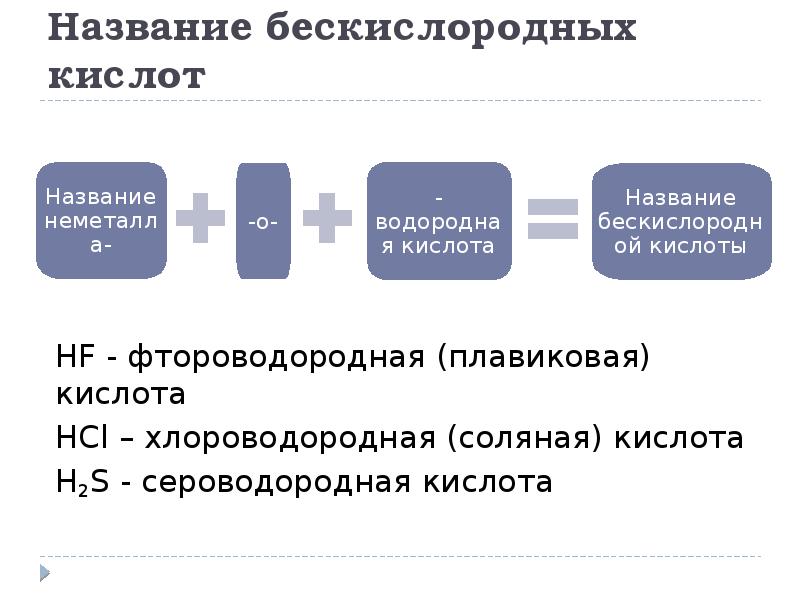
- 15. Название бескислородных кислот
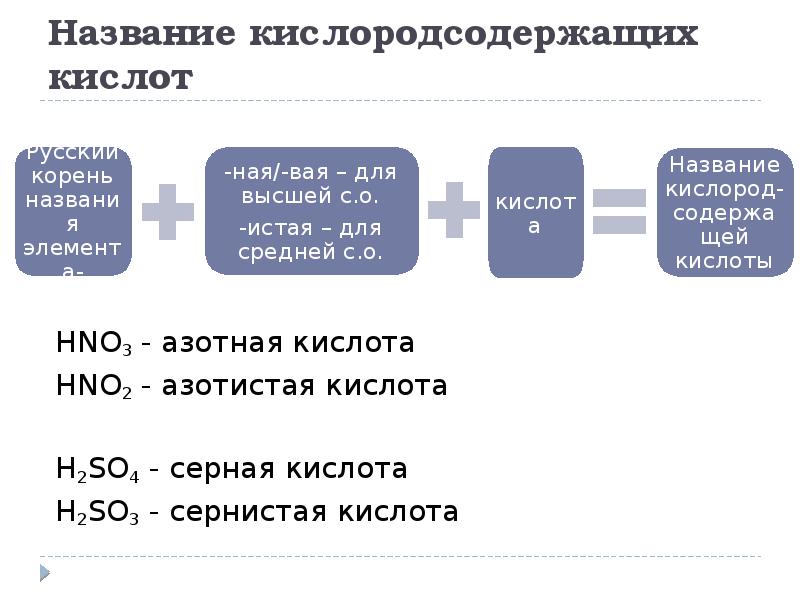
- 16. Название кислородсодержащих кислот
- 17. Название кислородсодержащих кислот
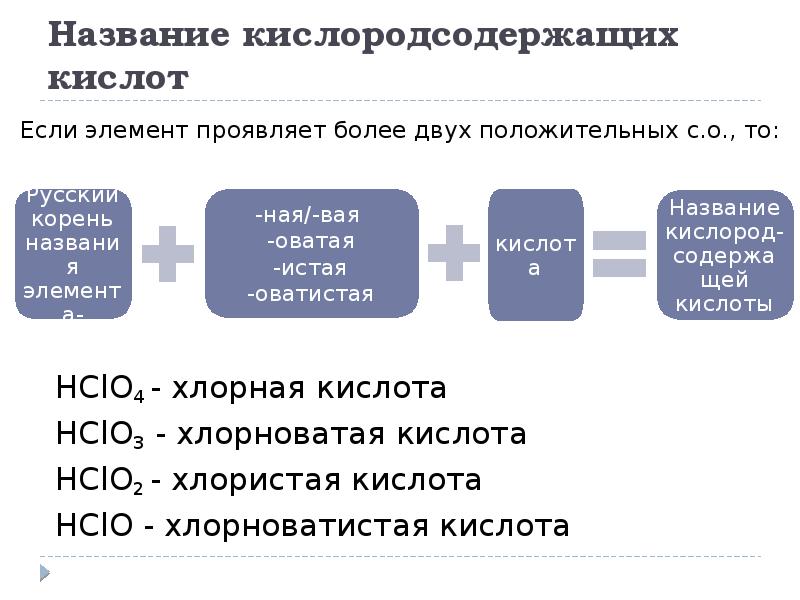
- 18. Название кислородсодержащих кислот
- 19. Методика образования кислоты из оксида Записать формулу оксида К оксиду алгебраически
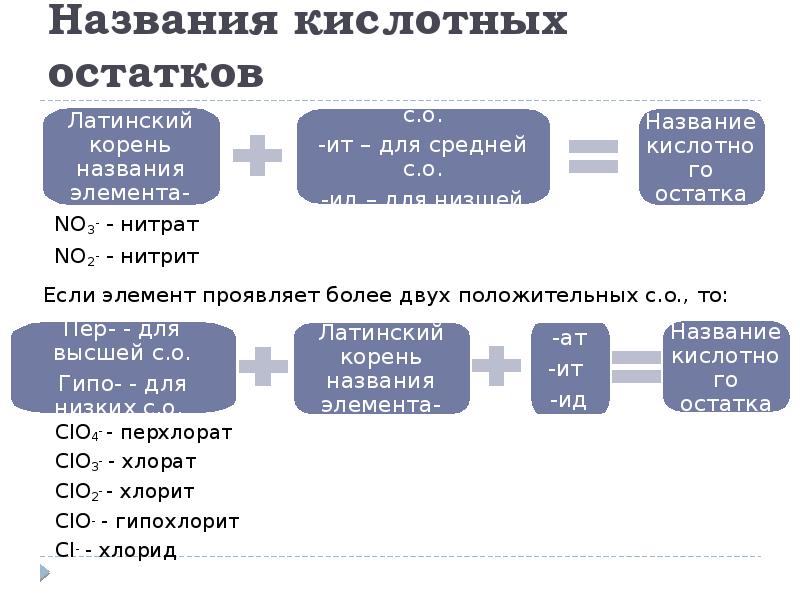
- 20. Названия кислотных остатков
- 21. Соли 1) Как продукты замены протонов в кислотах или гидроксогрупп в
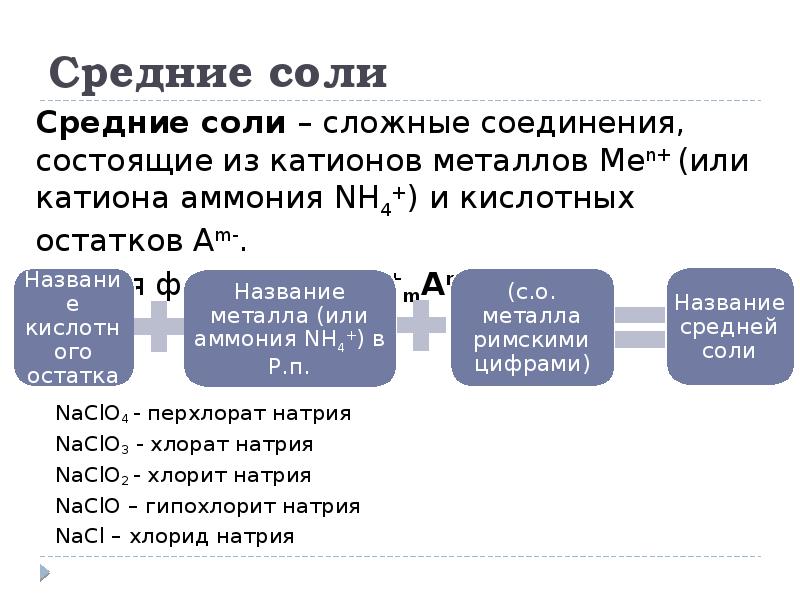
- 22. Средние соли Средние соли – сложные соединения, состоящие из катионов металлов
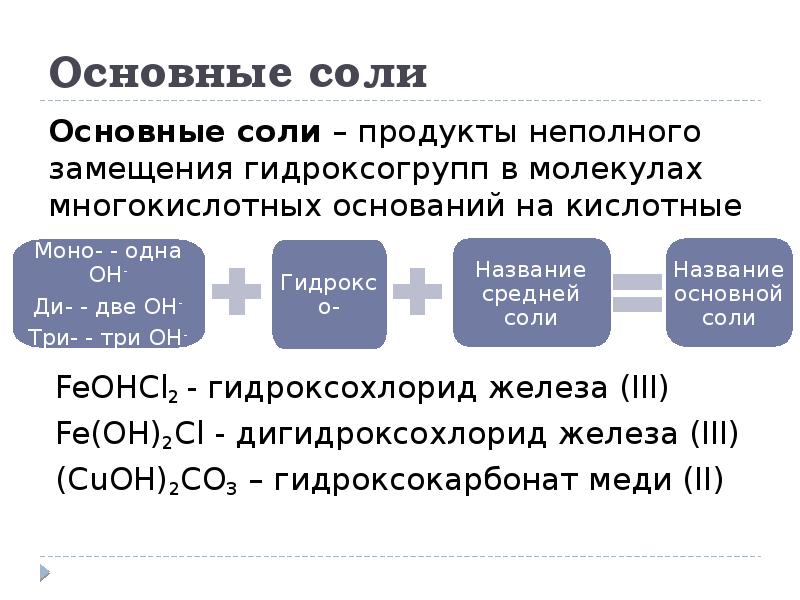
- 23. Основные соли Основные соли – продукты неполного замещения гидроксогрупп в молекулах
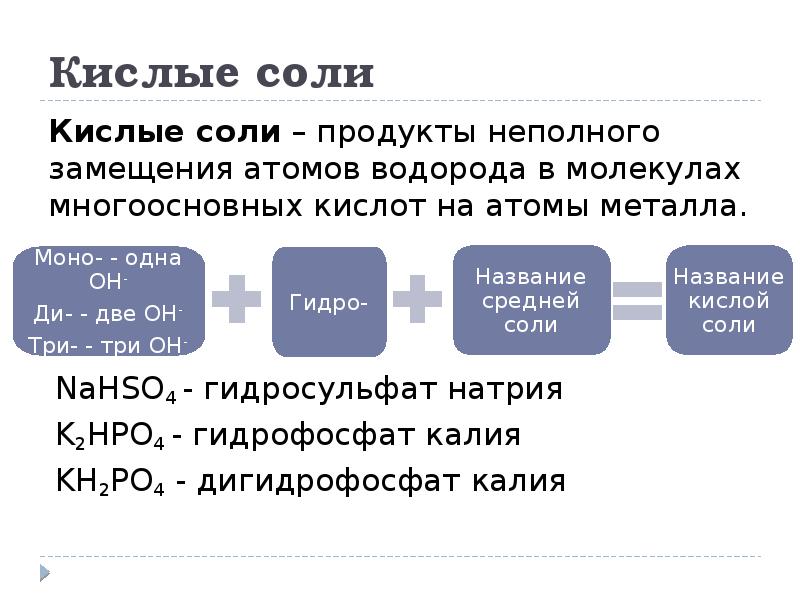
- 24. Кислые соли Кислые соли – продукты неполного замещения атомов водорода в
- 25. По числу присутствующих в структуре катионов и анионов Двойные соли –
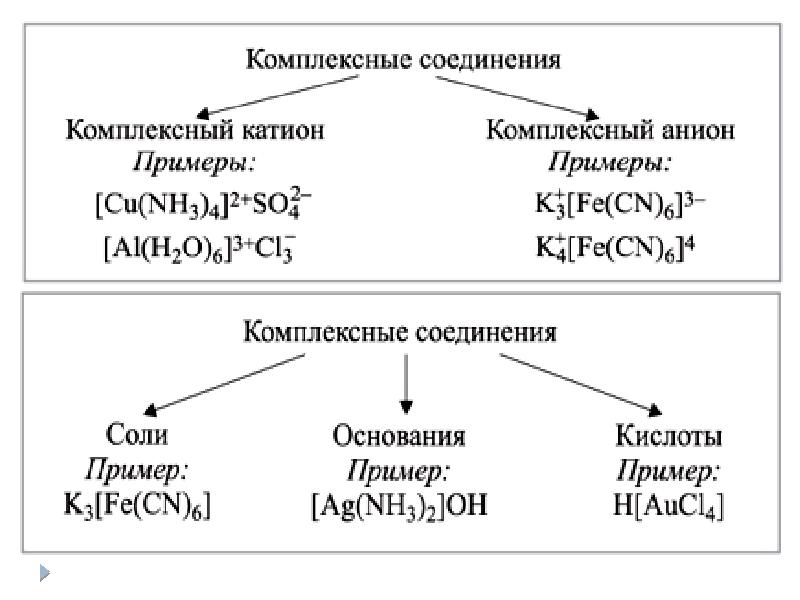
- 26. Комплексные соединения
- 28. Номенклатура комплексных соединений Если комплексный – анион: 1) Число лигандов (греческие
- 29. Номенклатура комплексных соединений Если комплексный – катион: 1) Число анионов внешней
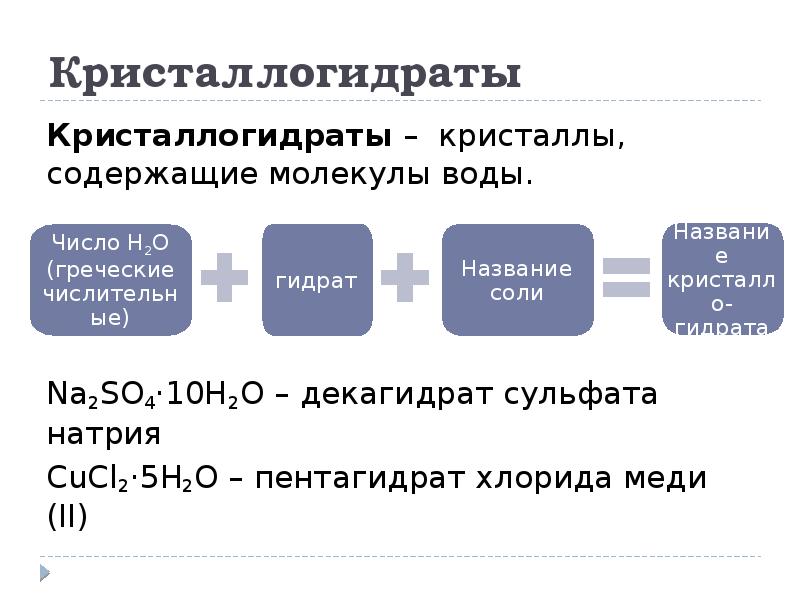
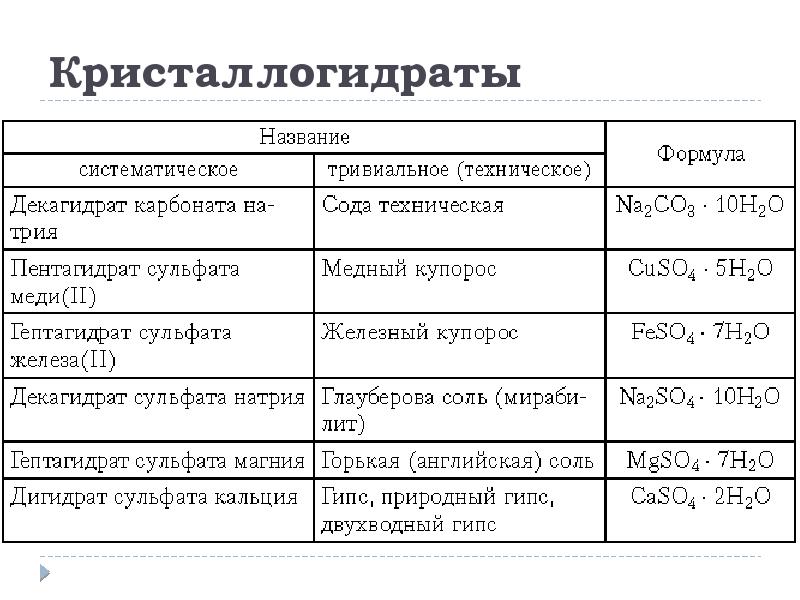
- 30. Кристаллогидраты
- 31. Кристаллогидраты
- 32. Скачать презентацию
















Слайды и текст этой презентации
Скачать презентацию на тему Основные классы неорганических соединений можно ниже:
Похожие презентации





























