Основные понятия и законы химии презентация
Содержание
- 2. Предмет химии Химия – одна из наук, изучающих природу и различные
- 3. Веществом называют материальные образования, состоящие из частиц, имеющих собственную массу (массу
- 4. Основные понятия и определения Химия — наука о веществах, их свойствах
- 5. Атомно-молекулярное учение 1) Вещества состоят из молекул; 2) Молекулы состоят
- 6. Простыми веществами называются вещества, состоящие из атомов одного химического элемента. Простыми
- 7. Атомы и молекулы Атом – электронейтральная микросистема взаимодействующих элементарных частиц, состоящая
- 8. Молекула – наименьшая электронейтральная частица вещества, которая может существовать самостоятельно, сохраняя
- 9. Изотопы Изотопы - атомы одного и того же химического элемента, имеющие
- 10. Изобары Атомы различных химических элементов, отличающиеся величиной заряда ядра (Z), но
- 11. Аллотропия Явление, при котором один и тот же элемент может образовать
- 12. Аллотропия Явление аллотропии вызывается двумя причинами: различным числом атомов в молекуле,
- 14. Относительная атомная масса
- 16. Относительная атомная масса
- 18. Относительная молекулярная масса Относительной молекулярной массой Mr вещества называется величина, равная
- 20. Моль — единица количества вещества Количества, в которых вещества вступают в
- 21. Моль — единица количества вещества Моль — это количество вещества, в
- 22. Число Авогодро NА = 12 г / 1,9952х10 –23 г =
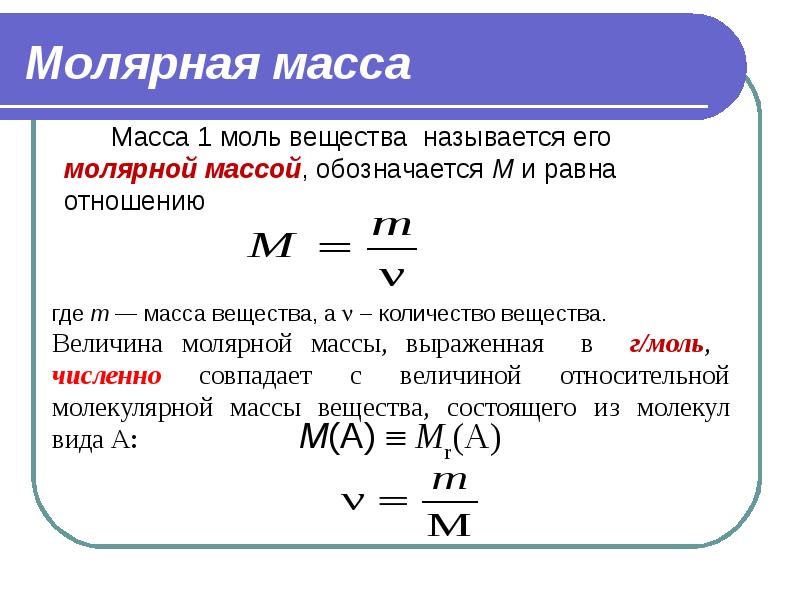
- 23. Молярная масса
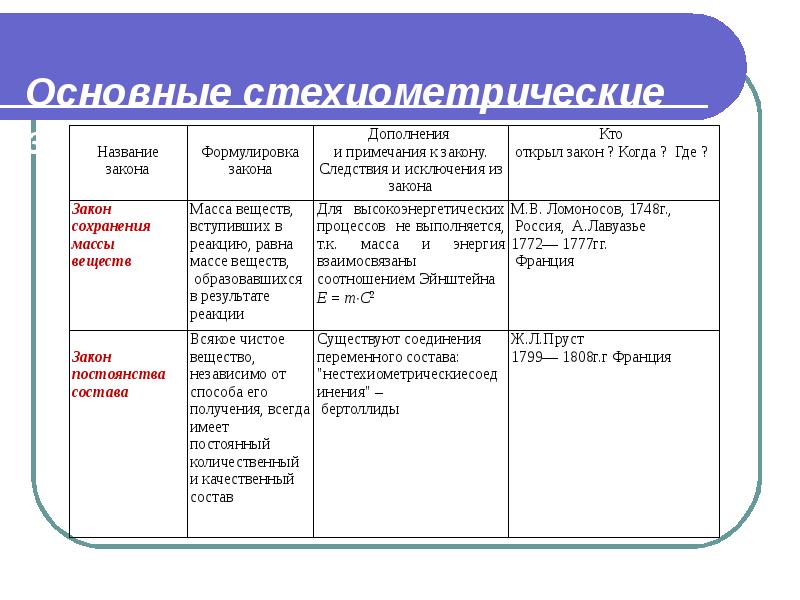
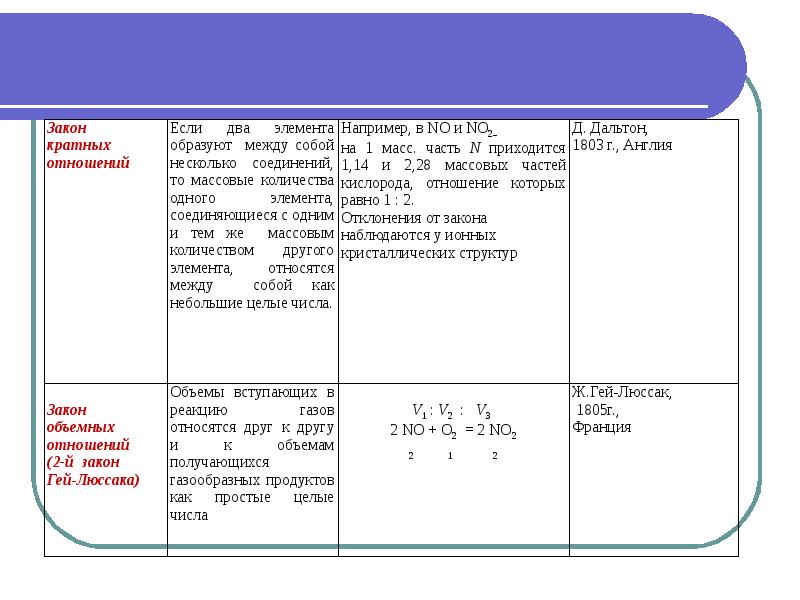
- 24. Основные стехиометрические законы
- 26. Закон Авогадро Закон Авогадро Следствие 3: Молярная масса вещества в газообразном
- 29. Закон эквивалентов Из закона постоянства состава следует, что элементы соединяются
- 30. Закон эквивалентов Закон эквивалентных отношений сформулирован Рихтером в 1793 г.
- 31. В соединениях HCl, H2S, NH3, CH4 эквивалент хлора, серы, азота, углерода
- 33. Эквивалент и эквивалентная масса элементов величина не постоянная. Она зависит от
- 34. Эквиваленты и эквивалентные массы сложных химических соединений могут быть определены по
- 36. Эквивалентная масса сложного вещества складывается из суммы эквивалентных масс простых веществ.
- 37. mэ осн. =экв. масса Me+ экв. масса гидроксильн. группы ( 17
- 38. Химический эквивалент –это реальная или условная частица, равноценная одному атому водорода
- 39. Идеальный газ. Уравнение состояния идеального газа
- 40. Идеальный газ. Уравнение состояния идеального газа
- 44. Скачать презентацию








































Слайды и текст этой презентации
Похожие презентации





























