Основные понятия химии. Законы стехиометрии презентация
Содержание
- 2. Поддубная Ольга Владимировна, канд. с.-х. наук, доцент Тел. (8-0-2233) 59489 кафедра
- 3. Литература Химия: Учебно-методический комплекс: учебно-методическое пособие / О. В. Поддубная,
- 4. Литература Цыганов, А. Р. Сборник задач и упражнений по химии:
- 5. Литература Химия. Учебно-методический комплекс : учебно-методическое пособие / О. В.
- 6. Литература Химия. Общая химия с основами аналитической : учебно-методическое пособие
- 7. План: Химия как наука о веществах и их превращениях. Цели и
- 8. 1. Химия как наука о веществах и их превращениях. Цели и
- 9. Химия - наука о составе, строении, свойствах и превращениях веществ.
- 10. 2.Международная номенклатура неорганических соединений. 2.Международная номенклатура неорганических соединений.
- 11. Основой химических веществ являются химические соединения. В настоящее время известно более
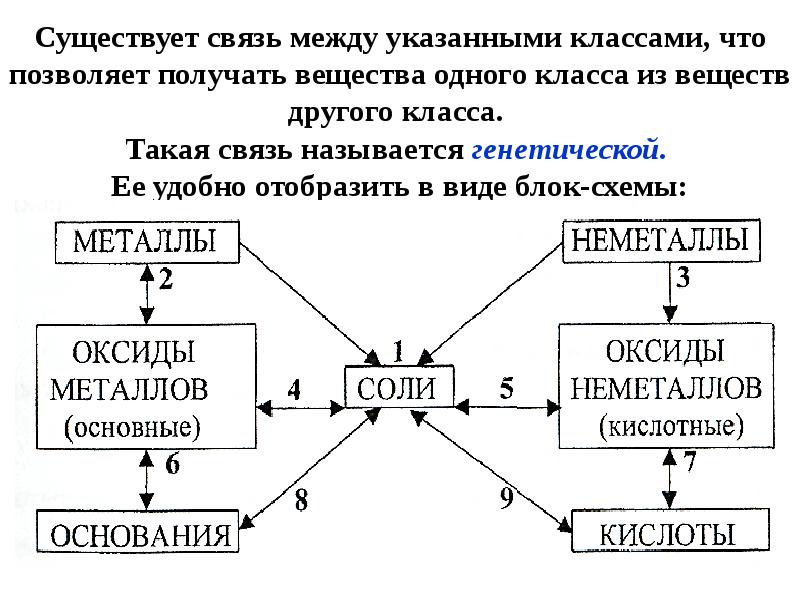
- 12. Существует связь между указанными классами, что позволяет получать вещества одного класса
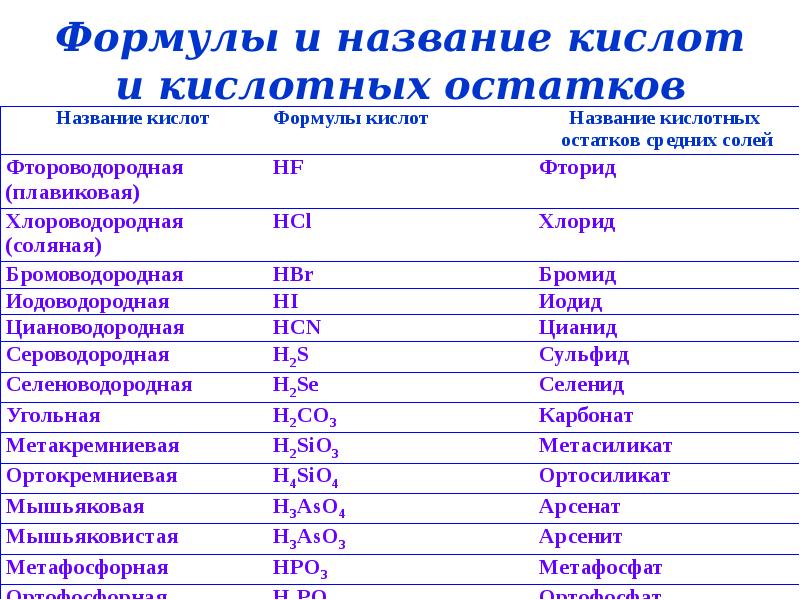
- 13. Формулы и название кислот и кислотных остатков
- 14. 3.Основные понятия химии В химических расчетах используется единица количества вещества –
- 15. 4.Основные стехиометрические законы Стехиометрия – раздел химии, который рассматривает количественные
- 16. 4.1. Закон сохранения массы и энергии: (Ломоносов, 1748) Масса веществ, вступающих
- 17. 4.2.Закон постоянства состава (Пруст, 1808) Любое сложное вещество молекулярного строение независимо
- 18. 4.3. Закон кратных отношений (Дальтон, 1803) Атомы в молекуле, а также
- 19. 4.4. Закон простых объёмных отношений (Гей-Люссак, 1808) Объёмы вступающих в реакцию
- 20. 4.5. Закон Авогадро В равных объёмах различных газов при одинаковых условиях
- 21. 4.6. Закон Менделеева – Клапейрона pV = nRT ;
- 22. 5.Химический эквивалент. Закон эквивалентов. Эквивалент – условная или реальная частица
- 23. Фактор эквивалентности (fэкв) – доля условной или реальной частицы
- 24. При вычислении молярных масс эквивалентов веществ необходимо учесть следующее: молярная масса
- 25. Эквивалентные объёмы газов: Эквивалентные объёмы газов:
- 26. Закон эквивалентов массы веществ m, реагирующих друг с другом или
- 27. Спасибо за внимание!
- 28. Скачать презентацию

























Слайды и текст этой презентации
Скачать презентацию на тему Основные понятия химии. Законы стехиометрии можно ниже:
Похожие презентации





























